VEGF-A抑制剂sFLT-1改善1型糖尿病小鼠的肾功能的研究
陈绵雄,林 慧,张菊云,刘婷婷
(中南大学湘雅附属海口医院/海口市人民医院,内分泌科 海口 570208)
糖尿病肾病的主要特征表现为微血管系统的损伤和功能障碍,调控微血管系统的关键因素是血管内皮生长因子(VEGF-A),它通过调节内皮细胞的迁移、增殖和存活影响血管通透性[1]。在糖尿病肾病的动物模型中应用VEGF-A抗体能明显预防蛋白尿和肾小球肥大,证实抑制VEGF-A可能是糖尿病肾并发症的潜在治疗靶点[2]。除了维持血管内稳态,VEGF-A还可以促进单核细胞和巨噬细胞的迁移[3]。研究发现:VEGF-A通过结合细胞表面的VEGF受体(VEGFR,也称FLT-1),促进单核细胞和巨噬细胞的迁移,在糖尿病肾病中发挥作用[4]。然而,在这些研究中均是在糖尿病肾病发生之前(即在蛋白尿、肾小球肥大和系膜扩张产生之前)抑制VEGF-A,因此,目前尚不清楚该策略是否适用于已经发生糖尿病肾损害的临床患者。
本研究中,我们观察VEGF-A抑制剂可溶性FLT-1(sFLT-1;也称可溶性VEGFR-1)对1型糖尿病合并肾损伤小鼠的肾功能,包括蛋白尿和系膜基质扩张的治疗作用以及对血管内皮细胞活化和巨噬细胞浸润的调控,现将研究结果报道如下。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
本研究选用8周龄雌性,SPF级C57BL/6J小鼠,体重(17.8±1.1)g,共30只,购自湘雅医学院实验动物中心[SCXK(湘)20180032],饲养于湘雅医学院实验动物中心[SYXK(湘)20180025],所有实验均按照中国国家“实验动物护理和使用指南”进行,全部实验内容遵循3R原则,经湖南省湘雅医学院伦理审批通过(2018HK0347)。小鼠置于单独通风的笼内,自由饮水和饮食。
1.1.2 细胞
HEK293细胞系和人脐静脉内皮细胞购买自美国ATCC生物公司。
1.2 主要试剂与仪器
链脲佐菌素购买自美国Sigma生物公司;DNA提取试剂盒(Qiagen公司);TRIzol(Invitrogen公司);Tris-EDTA缓冲液、4%甲醛固定液和无水乙醇(国药集团化学试剂有限公司);30%H2O2溶液(北京中杉金桥有限公司);SYBR Green酶(Qiagen公司);pcDNA3.1空载质粒(美国invitrogen公司);PECAM-1(美国Santa Cruz Biotechnology);兔抗人Wilms瘤(WT)(美国Santa Cruz Biotechnology);兔抗鼠Ⅳ型胶原(英国Abcam),抗兔-HRP偶联二抗(丹麦DAKO生物公司);兔抗鼠纤维连接蛋白fibronectin(1∶2400;美国Sigma-Aldrich);鼠抗鼠CD68(1∶15;英国Abcam);鼠抗鼠VCAM-1(1∶1400;美国BD Pharmingen);鼠抗鼠ICAM-1(1∶200;美国ATCC);兔抗鼠TNF-α(1∶100;英国Abcam);兔VSV(1∶250;英国Abcam)。
倒置相差显微镜(日本Olympus公司);5%CO2孵育箱(美国Thermo Fisher公司);微量孔板分光光度计(美国BioTek公司);低温离心机(德国R&D公司);URIT-150Vet小动物尿液生化检测仪(中国常州锐品精密仪器有限公司);倒置荧光显微镜(日本Olympus公司);Leica CM1860组织冷冻切片机(德国Leica生物公司);蛋白免疫电泳仪(德国Bio-Rad生物公司);实时荧光定量PCR仪(ABI7500)(美国应用生物系统公司)。
1.3 实验方法
1.3.1 糖尿病小鼠模型
模型组采用75 mg/kg剂量进行腹腔注射链脲佐菌素,对照组注射相同剂量生理盐水,每隔2 d注射1次,重复3次构建糖尿病小鼠模型。(1)在造模后1周、5周测定血糖水平,血糖水平稳定在15 mmol/L或更高的小鼠被认为是糖尿病造模成功。将所有造模成功的小鼠随机分为六组:5周:健康对照组(n=5)、糖尿病组(n=5);15周:健康对照组(n=5)、糖尿病组(n=5),对照+sFLT-1治疗组(n=5),糖尿病+sFLT-1治疗组(n=5)。(2)造模后第5周处死一部分动物,获取肾组织及血清标本。(3)确认小鼠在5周内出现肾损伤后在造模后第6周,将sFLT-1质粒通过尾静脉注射方式转染剩下的小鼠。(4)同时间隔2周后通过小鼠腹腔注射荧光素检测转染效率。(5)糖尿病建模后15周处死剩下所有小鼠,获取相应肾和血清标本进行分析。(6)分别于第5周和第15周采集点状尿液分析尿蛋白排泄率。
1.3.2 质粒构建和转染
以pcDNA3.1为载体构建包含小鼠sFLT-1-VSV以及荧光素酶基因的巨细胞病毒启动子驱动的表达质粒。质粒在大肠杆菌中扩增,经纯化后溶解在Tris-EDTA缓冲液中。在造模后第6周,将sFLT-1-vsv和荧光素酶的表达质粒同时转染到小鼠的两条小腿肌肉中(各20μg)。为了监测转染效率,注射sFLT-1-vsv和荧光素酶的表达质粒操作的2周后通过腹腔注射荧光素,生物荧光相机观察荧光素酶活性,质粒图谱见图1。
图1 pcDNA3.1(-)空载质粒图谱(Invitrogen,Carlsbad,CA)Figure 1 pcDNA3.1(-)empty plasmid mapping
1.3.3 血管形成实验
进一步通过血管形成实验,明确sFLT-1对血管结构的调控作用。将人脐静脉内皮细胞(HUVECs)接种在Matrigel涂层的96孔板上。通过脂质体Lipo3000在HEK293细胞中转染sFLT-1质粒和荧光素酶的表达质粒,转染2 d后收集细胞培养上清,将收集的细胞培养上清孵育人脐静脉内皮细胞6 h。同时向细胞培养基中加入或不加入VEGF-A(10 ng/mL)。计数5个400倍视野内的管状分支数目。使用Moticam相机进行图像拍摄。
1.3.4 尿白蛋白排泄率测定
分别于采集建模后的第5周健康对照组(n=5)、糖尿病组(n=5)和第15周的健康对照组(n=5)、糖尿病组(n=5)以及sFLT-1治疗组(n=5)小鼠的点状尿液,用兔抗小鼠白蛋白免疫电泳法测定尿白蛋白含量,以纯化的小鼠血清白蛋白作为对照。同时测定尿肌酐水平,计算尿液中的白蛋白/肌酐比值。
1.3.5 免疫组织化学染色
分别获取糖尿病组(n=5)及sFLT-1治疗组(n=5)小鼠的肾组织,进行石蜡包埋处理后切成4μm的薄片。采用兔抗鼠血小板/内皮细胞粘附分子1(PECAM-11∶400)、兔抗人Wilms瘤(WT)(1∶500)和兔抗鼠Ⅳ型胶原(1∶200)抗体进行免疫组化染色,随后使用抗兔-HRP偶联二抗(未稀释;DAKO)进行二抗染色。此外,分别获取糖尿病组(n=5)及sFLT-1治疗组(n=5)小鼠的冰冻肾组织切成4μm薄片。兔抗鼠纤维连接蛋白fibronectin、鼠抗鼠CD68、鼠抗鼠VCAM-1、鼠抗鼠ICAM-1、兔抗鼠TNF-α和兔VSV进行染色。
1.3.6 血管内皮细胞活性检测
HUVECs细胞中加入VEGF-A(20 ng/mL)孵育2、4、6、8 h后,加入sFLT-1(0、10、100、1000 ng/mL)孵育4 h,观察sFLT-1对VEGF-A诱导内皮细胞活化的影响。采用TRIzol从HUVECs中提取总RNA,反转录成cDNA后,进行定量实时PCR检测目的基因的表达水平。涉及到的目的基因引物序列根据网络数据库Primerbank设计(https://pga.mgh.harvard.edu/primerbank/)如下:HPRT1:正向:5’-AGATGGTCAAGGTCGCAAGC-3’; 反 向:5’-TCAAGGGCATATCCTACAAAAC-3’;ICAM-1:正向:5’-CAGAGGTTGAACCCCACAGT-3’;反 向:5’-CCTC TGGCTTCGTCAGAATC-3’;SELEE:正向:5’-AGCCCAGAGCCTTCAGTGTA-3’;反 向: 5’-AACTGGGATTTGCTGTGTCC-3’。引物合成委托由生工生物有限公司进行。
1.4 统计学方法
采用SPSS 22.0软件进行数据分析,计量资料以平均数±标准差(±s)表示。采用单因素方差分析(ANOVA)分析进行组间比较,P<0.05认为差异有统计学意义。
2 结果
2.1 体外转染sFLT-1可减少血管的形成
通过血管形成实验,我们发现:在培养基中添加VEGFA后可导致血管形成增加(图2),血管分支点的数量显著增加;而从转染sFLT-1质粒的HEK293细胞获得的培养基可显著抑制VEGF-A诱导的管形成,提示sFLT-1能够抑制了VEGF-A诱导的血管形成。
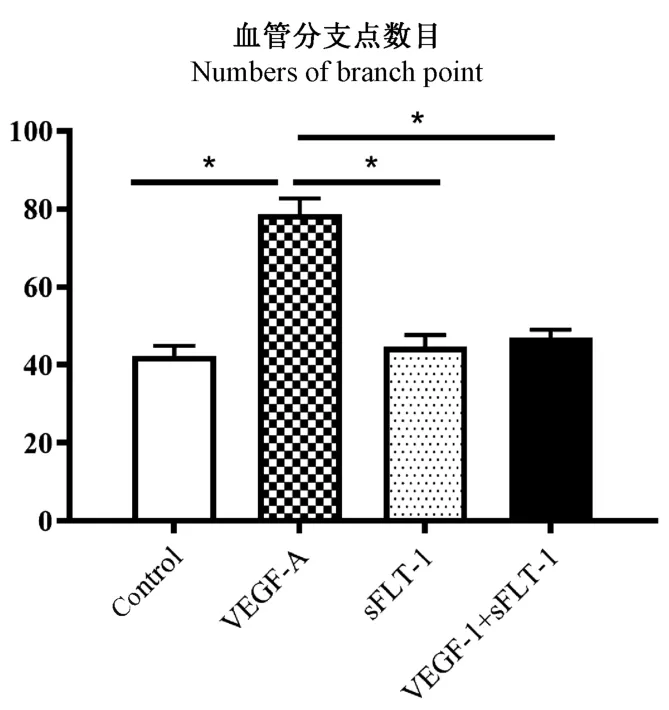
图2 体外孵育sFLT-1可抑制VEGF诱导的微血管形成Note.Number of vascular branching points was counted after incubation of human umbilical vein endothelial cells in medium supplemented with VEGF-A(10 ng/mL)or sFLT-1.Compared with control group,*P<0.05,n=5.Figure 2 Incubation of sFLT-1 in vitro inhibits VEGF-induced microvessel formation
2.2 转染sFlt质粒后能明显缓解糖尿病小鼠的肾损伤
测定糖尿病建模5周后小鼠肾损伤情况,发现:糖尿病组小鼠肾小球系膜基质扩张的两个标志物--IV型胶原和纤维连接蛋白的蛋白表达水平均高于对照组(P<0.001)(图3A)。糖尿病模型组小鼠会表现出明显的蛋白尿,白蛋白/肌酐比值(ACR)为(8.53±2.59)mg/mmol,显著高于对照组(3.06±0.98)mg/mmol,P<0.001。并且糖尿病模型组小鼠出现肾小球肥大(P<0.001)(图3B)。糖尿病小鼠和对照组小鼠的足细胞数量没有差异。
确认小鼠在5周内出现肾损伤后,我们在第6周进行sFLT-1转染,并在转染后9周对小鼠进行分析(即糖尿病建模后15周)。发现:sFLT-1可以显著降低了糖尿病小鼠肾损害的所有指标,包括蛋白尿、肾小球肥大和系膜基质扩张(P<0.05)(图3)。与对照组相比,转染sFLT-1后的糖尿病小鼠足细胞明显减少(P<0.05)。并且与第5周的糖尿病小鼠相比,尿蛋白水平和IV型胶原表达水平显著降低(P<0.05),证实转染sFLT-1可以逆转肾功能的损害。
2.3 转染sFLT-1可降低糖尿病小鼠的内皮激活和炎症反应
与对照组相比,糖尿病小鼠肾小球内皮细胞活化明显增强,表现为VCAM-1,ICAM-1和PECAM-1表达水平升高(P<0.05)(图4)。并且TNF-α水平增加(P<0.05),肾小球巨噬细胞数增加(P<0.05)。在第15周,糖尿病组小鼠肾小球内皮细胞激活的三个标记物仍然增加明显(P<0.05)。15周时,糖尿病组肾小球巨噬细胞浸润增多,肾小球TNF-α水平升高,与对照组比较差异有统计学意义(P<0.05)。转染能显著降低了糖尿病小鼠肾小球内皮细胞激活和炎症相关指标(P<0.05)。与第5周糖尿病小鼠相比,第15周转染sFLT-1的糖尿病小鼠ICAM-1和PECAM-1水平显著降低(P<0.05)。
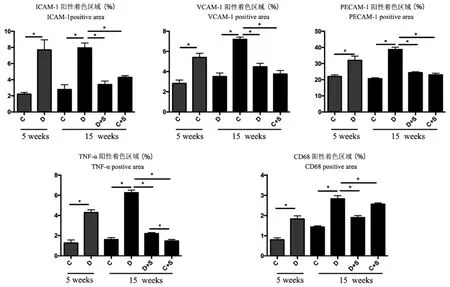
图4 sFLT-1可降低糖尿病小鼠肾小球内皮细胞活化、肾小球巨噬细胞数和肾小球炎症Note.Vascular cell adhesion molecule-1,intercellular adhesion molecule-1,vascular endothelial cell adhesion molecule-1,tumor necrosis factor-α,and glomerular macrophage count at weeks 5 and 15 after diabetic modeling.Compared with control group,*P<0.05,n=5.Figure 4 sFLT-1 reduces glomerular endothelial cell activation,glomerular macrophage count,and glomerular inflammation in diabetic mice
2.4 sFLT-1以剂量依赖的方式降低血管内皮生长因子-A诱导的内皮细胞激活
我们进一步在体外实验中研究lllt-1对VEGFA诱导的内皮细胞活化的影响。人脐静脉内皮细胞与20 ng/mL的VEGF-A共孵育后,E-选择素(SELE)和VCAM-1编码基因的表达显著增加,SELEE和VCAM-1的RNA水平分别在刺激后6 h和4 h达到峰值(图5)。同时,我们发现不同浓度的sFLT-1对血管内皮细胞活化的影响,发现sFLT-1以剂量依赖的方式显著降低了VEGF-A诱导的VCAM-1的上调(P<0.001),但对VEGF-A诱导的SELE上调无明显影响。
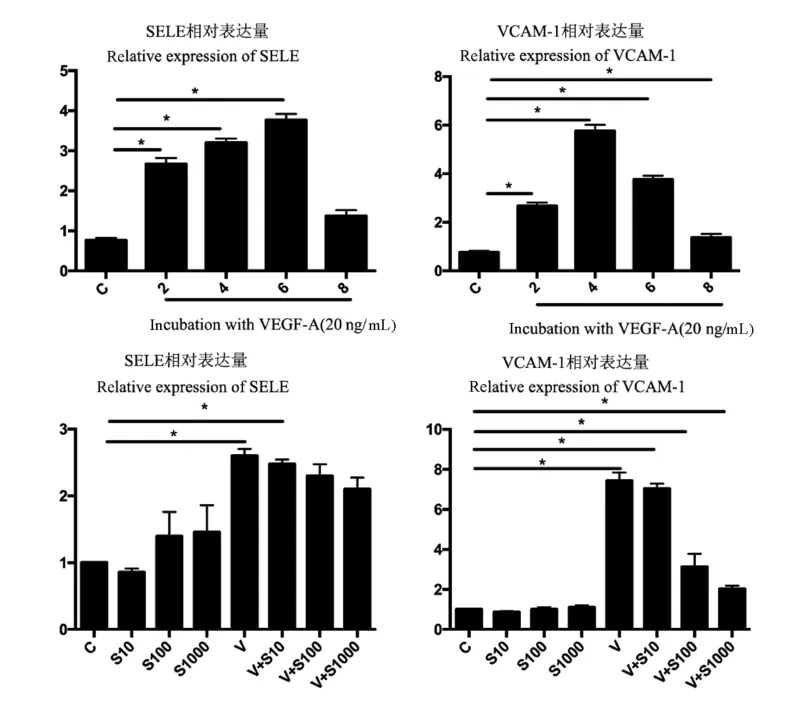
图5 体外实验中sFLT-1以剂量依赖的方式降低VEGF-A诱导的内皮细胞活化Note.Expression of SELE and VCAM-1 genes at the mRNA level was determined.HUVECs cells were simultaneously incubated with VEGF-A at a concentration of 20 ng/ml and sFLT-1 at concentrations of 10,100,and 1000 ng/mL for 4 h.SELEE and VCAM-1 expression at the mRNA level was measured.C,Cells untreated with VEGF-A or sFlt-1.V,Cells stimulated with VEGF-A but not sFlt-1-treated cells.Compared with control group,*P<0.05,n=5.Figure 5 In vitro experiments in which sFLT-1 reduced VEGFA-induced endothelial cell activation in a dose-dependent manner
3 讨论
在本研究中,我们证实在糖尿病小鼠中转染sFLT-1质粒能够显著改善肾功能及蛋白尿、肌酐水平和系膜基质含量来逆转高血糖造成的肾损害。同时sFLT-1可以降低肾小球内皮细胞中TNF-α蛋白水平,抑制炎症反应和VEGF-A诱导的血管内皮细胞的激活。
糖尿病肾病动物模型肾小球VEGF-A水平升高,在糖尿病动物模型中抑制VEGF-A可以预防蛋白尿、肾小球肥大和足细胞丢失[5-6]。有研究报道,在足细胞中过表达sFLT-1可以减少糖尿病小鼠的系膜扩张和肾小球基底膜增厚,但该项研究没有阐明全身性应用sFLT-1对糖尿病肾病的治疗效果[5-6]。相反,其他研究发现:抗VEGF-A治疗对早期肾病理没有作用[7-8],但糖尿病小鼠足细胞特异性VEGF-A基因缺失会导致蛋白尿增加和肾损伤[9]。此外,另一项研究报道用sFLT-1治疗糖尿病小鼠可以减少蛋白尿,但它并没有减少肾小球基质沉积,并导致肾小管损伤增加[10]。这些相互矛盾的结果可能是多种因素造成的,包括开始治疗的时间,以及使用的抗VEGF-A治疗的剂量和类型所导致的。并且以上研究集中于糖尿病引起的肾损害的预防而不是治疗,因此,很难估计这些治疗对已经出现肾损害的糖尿病患者的效果。因此,我们研究了VEGF-A抑制剂sFLT-1对糖尿病小鼠肾损害(包括蛋白尿和系膜基质堆积)的治疗效果。发现,尽管转染sFLT-1不能使糖尿病小鼠的血糖水平恢复正常,但可以逆转肾损害,体现为蛋白尿和系膜基质沉积减少了。
此外,我们还发现与VEGF-A共同孵育HUVECs可增加内皮细胞的激活,而用sFLT-1处理HUVECs可逆转这一作用。并且转染sFLT-1可以使糖尿病小鼠肾小球巨噬细胞数量和肿瘤坏死因子-α水平正常化。综上所述,这些发现提示VEGFA抑制剂sFLT-1减少了内皮激活和随后的巨噬细胞浸润。据报道,使用sFLT-1也可以应用于其他炎症相关疾病的治疗,包括关节炎、血管疾病、脓毒症和牛皮癣,表现为sFLT-1可以减少巨噬细胞的浸润和数量[11-14]。因此目前的结果表明,sFLT-1可能是治疗糖尿病肾病以及炎症疾病的一种有价值的治疗方法。
综上所述,我们研究证实:以sFLT-1作为干预药物拮抗糖尿病小鼠体内VEGF-A水平的异常升高,可以减少内皮激活、肾小球巨噬细胞浸润和肾小球炎症,从而逆转肾损害,可能成为未来糖尿病肾病患者的可行方案。

