Gluc-Lys([Al18F]NOTA)-KE108的制备及初步生物学评价
高 菲 董瑞林 宋志浩 张蕴瀚 陈孟毅 邱珊珊 王成龙 许 林 成伟华
(原子高科股份有限公司 北京102413)
神经内分泌肿瘤(Neuroendocrine Tumors,NETs)是一类起源于不同神经内分泌器官的一组异质性肿瘤,主要以胃、肠和胰神经内分泌肿瘤多见,发病率约为十万分之七[1-3]。NETs的罕见性和无症状的临床过程使得漏诊和误诊率高,近60%的患者在初诊时发现已处于晚期[4]。生长抑素受体(Somatostatin Receptor,SSTR)为七螺旋G蛋白偶联糖蛋白跨膜受体,有5种不同的分子亚型[5],研究表明高达94%的NETs细胞表面有SSTR的高表达,甚至一些低分化的肿瘤细胞中也有SSTR的表达。SSTR成为诊断和治疗NETs并进行治疗的重要靶点。
从20世纪80年代至今,已经报道并评估了许多放射性标记的SSTR靶向分子探针[6-9]。其中奥曲肽作为一种人工合成的生长抑素类似物,因其理想的代谢半衰期,使得放射性核素标记的奥曲肽及其类似物的研究成为热点。例如,采用治疗核素放射性标记的SSTR激动剂(如90Y-或177Lu-DOTATOC和177Lu-DOTATATE),可进行肽受体放射性核素治疗(Peptide Receptor Radionuclide Therapy,PRRT)[10],以及用于正电子发射断层显像(Positron Emission Tomography,PET)的68Ga标记的SSTR激动 剂68Ga-DOTATOC[11]、68Ga-DOTANOC和68Ga-DOTATATE[12],可对神经内分泌肿瘤进行显像定位。SSTR-PET/CT在检测原发性肿瘤、未知原发性肿瘤、分期、再灌注和评估NETs患者的治疗反应等方面发挥着重要作用,18F标记的多肽类似物也成为热门的研究方向。
与其他放射性核素相比,18F核素产生的正电子能量较低,最高只有0.635 MeV,平均为0.25 MeV,其在组织中湮灭距离短(约2.4 mm),具有合适的半衰期(t1/2=109.8 min),可以得到高分辨率的图像,因此成为临床应用最广泛、最理想的PET显像核素。Schottelius等[13]报 道 的Cel-S-Dpr([18F]FBOA)TOCA展现出良好的药代动力学和较高的肿瘤与背景比值,并且首次在患者研究中证实了PET成像潜力,然而较低标记效率限制18F-肽标记在临床上的应用。之后,Wester等[14]报道18F-FP-Gluc-TOCA展现出较高的肿瘤特异性和较好的对比度,成为SSTR阳性肿瘤PET成像示踪剂,并应用于临床,但由于标记过程繁琐,很大程度上影响临床使用。William、江大卫、李葆元等[15-18]发表的Al18F复合物偶联双功能螯合剂(NOTA、DOTA等)标记方法的应用很大程度上推动18F标记多肽类正电子药物的进展,该方法标记简单、快速,可在水环境中实现18F核素的标记。温凯、郭飞虎等[19-20]研究糖基化奥曲肽衍生物18FTa-Gluc-TOCA以 及n-Gluc-Lys([Al18F]NOTA)-TOCA探针,水溶性好,体内外稳定。通过生物分布实验发现,在生长抑素受体高表达的胰腺中有一定的摄取,其中18F-Ta-Gluc-TOCA在肿瘤内保留时间较长,有望用于生长抑素受体阳性肿瘤PET显像剂。近期,美国国立卫生研究院生物医学影像与生物工程研究所陈小元教授实验室联合厦门大学分子影像暨转化医学中心以RGD2为靶向分子、PEG4为连接基团偶联NOTA后,通过Al18F标记,先后开发出氟[18F]阿法和18F-阿法肽(18F-AlfatideⅡ)。与世界同类产品相比,氟[18F]阿法肽不仅有亲和力高、非靶本底清除速度较快,而且稳定性好、标记过程简单易于操作[21]。2018年,中国国家药品监督管理局授予18F-AlfatideⅡ临床试验批件,成为国内首个获批的正电子放射性一类新药。这进一步表明Al18F标记方法标记多肽是具有良好应用前景。
KE108多肽作为生长抑素类似物,具有和奥曲肽相似的化学结构,并且在对5种不同亚型受体都具有较高的亲和力(表1),对于SSTR阳性肿瘤具有广谱性[23]。研究发现,奥曲肽的糖基化可降低多肽的亲脂性和肝胆代谢,优化体内代谢动力学[24]。2016年,张健等采用99Tcm间接标记的方法,利用双功能螯合剂(Hydrazinonicotinamide,HYNIC),分别以Tricine[三(羟甲基)甲基甘氨酸]和乙二胺-N,N-二乙酸为协同配体对多肽KE108进行标记99Tcm[25]。优化之后的标记率90%以上,标记物99Tcm-HYNICKE108在肿瘤组织中有较好摄取率,并且给药后1 h内肿瘤显像较为清晰,说明KE108多肽对生长抑素受体具有一定的靶向性和亲和力。

表1 生长抑素及其类似物对SSTR不同亚型的亲和力(IC50/nmol·L-1)Table 1 Binding affinity of somatostatin and its analogues to all sst subtypes(IC50/nmol·L-1)
本研究通过对KE108多肽进行化学修饰,设计并制备了一种新型通过偶联双功能螯合剂NOTA的糖基化生长抑素类似物,通过标记18F核素得到Gluc-Lys([Al18F]NOTA)-KE108以靶向SSTR阳性肿瘤,分别在体内外进行生物学评价,评估其用于SSTR阳性肿瘤早期诊断的可行性。
1 材料与方法
1.1 仪器与试剂
ECLIPSE HP型回旋加速器(德国Siemens公司);PET/CT(比利时Molecube公司);自动γ计数仪(Perkinelmer Wallac公司);ESI-MS质谱仪(美国Capintec公司);MH-2800加热模块;活度计CRC-15;CBN-20A高效液相仪(日本Shimadzu公司);色谱柱Agilent ZORBAX XDB-C18,5μm,4.6 mm×250 mm;GABI型放射性检测器(德国Raytest公司)。
Fmoc-Phe-CTC Resin、O-苯并三氮唑-四甲基脲六 氟 磷 酸 盐(O-Benzotriazole-N,N,N',N'-tetramethyl-uronium-hexafluorophosphate,HBTU)、N-甲基吗啉(4-Methylmorpholine,NMM)、1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(1-Ethyl-3-(3-dimethylaminopropyl) carbodiimide hydrochloride,EDC·HCl)、Fmoc-Tyr(tBu)-OH、Glucose-Lys(Fmoc)-OH、NOTA(OtBu)、钯碳(Pd/C)、哌啶(Piperidine,Pip)、N,N-二甲基甲酰胺(N,N-Dimethylformamide,DMF)、六 氟 异 丙 醇(Hexafluoroisopropanol,HFIP)、二 氯 甲 烷(Dichloromethane,DCM)、甲 醇、乙 二 硫 醇(Ethanedithiol,EDT)、冰 乙 醚、三 氟 乙 酸(Trifluoroacetic acid,TFA)、1-羟基苯并三唑(NHydroxybenzotrizole,HOBT)、乙腈、六水合三氯化铝(百灵威科技有限公司);H218O(江苏华益科技有限公司);龙胆酸(阿拉丁)。
1.2 多肽合成
Gluc-Lys(NOTA)-KE108结构及其合成路线见图1和图2。称量0.3 mmol·g-1的Fmoc-Phe-CTC Resin 5 g,20%Pip/DMF脱保护30 min,之后按当量比例(AA:HBTU:NMM=3:2.85:6)投入原料,加入适量DMF,鼓氮气反应30 min,通过茚三酮检测反应完全,用DMF、DCM、甲醇依次洗涤;重复上述步骤,得 到Fmoc-Dab-Arg(NO2)-Phe-Phe-Trp(Boc)-Lys-Thr(tBu)-Phe-CTC Resin(树脂肽)。将树脂肽置于30%HFIP/DCM中,摇床控温1 h,抽滤收集滤液,旋蒸浓缩得到粗品Fmoc-Dab-Arg(NO2)-Phe-Phe-Trp(Boc)-Lys-Thr(tBu)-Phe-OH(1)。

图1 Gluc-Lys(NOTA)-KE108的化学结构Fig.1 Chemical structure of Gluc-Lys(NOTA)-KE108
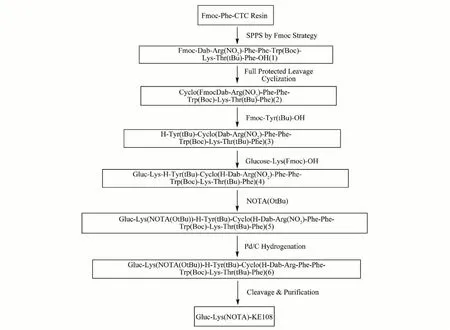
图2 Gluc-Lys(NOTA)-KE108的合成路线Fig.2 Synthetic route of Gluc-Lys(NOTA)-KE108
将1溶解于DCM中,分别加入EDC·HCl、HOBT(1.2当量)和NMM(2当量),搅拌反应过夜,旋蒸浓缩得到环化后的粗品Cyclo(Fmoc-Dab-Arg(NO2)-Phe-Phe-Trp(Boc)-Lys-Thr(tBu)-Phe)(2)。
将2溶解于20%Pip/DMF中,搅拌反应1 h,浓缩,然后依次加入1.1当量的Fmoc-Tyr(tBu)-OH溶解于DMF中,之后添加EDC·HCl、HOBT(1.2当量)和NMM(2当量),之后用20%Pip/DMF处理1 h,浓缩后得到粗品Tyr(tBu)-Cyclo(H-Dab-Arg(NO2)-Phe-Phe-Trp(Boc)-Lys-Thr(tBu)-Phe)(3)。
重复上述步骤,连接Glucose-Lys(Fmoc)-OH得到粗产品Gluc-Lys-H-Tyr(tBu)-Cyclo(H-Dab-Arg(NO2)-Phe-Phe-Trp(Boc)-LysThr(tBu)-Phe)(4)。
重复上述步骤,继续连接NOTA(OtBu)得到粗品Gluc-Lys-(NOTA(OtBu))-H-Tyr(tBu)-Cyclo(HDab-Arg(NO2)-Phe-Phe-Trp(Boc)-Lys-Thr(tBu)-Phe)(5)。
将5溶解于甲醇中,加入Pd/C氢化后得到粗品Gluc-Lys(NOTA(OtBu))-H-Tyr(tBu)-Cyclo(H-Dab-Arg-Phe-Phe-Trp(Boc)-Lys-Thr(tBu)-Phe)(6)。
将6溶解于TFA/EDT/H2O=95/2.5/2.5切割液,摇床控温3 h,抽滤,收集滤液后加入6倍体积冰乙醚,离心沉淀收集固体,将沉淀的粗品用乙醚洗三遍,干燥后用反相高效液相色谱(High Performance Liquid Chromatography,HPLC)纯化,得到最终的产品Gluc-Lys(NOTA)-KE108。
1.3 Gluc-Lys([Al18F]NOTA)-KE108制备
向西林瓶中依次加入0.1 mol·L-1醋酸缓冲液(100μL,pH=4.0),AlCl3的0.1 mol·L-1醋酸缓冲液(3μL,2 mmol·L-1),10μL 1 mg·mL-1的龙胆酸,100μL[18F]F-生理盐水溶液,200μL无水乙腈,加入Gluc-Lys(NOTA)-KE108(50μL,1 mg·mL-1),95℃反应10 min,冷却至常温。用1 mL去离子水稀释,取其中20μL用HPLC测定标记率。然后标记物缓慢上Sep-pak C-18 light柱(预先活化,用10 mL无水乙醇、10 mL纯化水活化后吹干),用5 mL纯化水洗去未反应的18F氟离子等水溶性杂质,用1 mL的75%乙醇淋洗下产品,通过氮吹除去乙醇,并加入适量生理盐水稀释。
利用高效液相色谱仪对标记产物进行标记率、比活度、放射性化学纯度的测定,液相条件如表2所示。

表2 Gluc-Lys([Al18F]NOTA)-KE108高效液相色谱条件Table 2 HPLC conditions of Gluc-Lys([Al18F]NOTA)-KE108
1.4 理化性质研究
1.4.1 脂水分配系数
取500μL正辛醇、400μL磷酸盐缓冲液(Phosphate Buffer Saline,PBS)溶液置于2 mL离心管内,之后加入100μL Gluc-Lys([Al18F]NOTA)-KE108注射液。将混合液剧烈旋涡充分混合1 min,并以10 000 min-1的速度离心5 min。从上述溶液中提取100μL有机相,添加到含有400μL正辛醇和500μL PBS的新离心管中,重复上述步骤三次。分别取100μL有机相和水相(n=5)溶液,使用自动γ计数仪测定,计算脂水分配系数(lgP值)。
1.4.2 体外稳定性
在体外分别进行标记物在生理盐水和10%小牛血清中的稳定性测定。检测在生理盐水中的稳定性:将37 MBq Gluc-Lys([Al18F]NOTA)-KE108溶于生理盐水中,在室温下放置2 h,通过HPLC测定标记物在0.5 h、1 h和2 h的放射性化学纯度。检测在血清中的稳定性:将37 MBq Gluc-Lys([18F]NOTA)-KE108溶于1 mL小牛血清中,37℃孵育,分别在0.5 h、1 h和2 h取300μL上述血清,加入相同体积的乙腈涡旋、离心,取上清液通过0.22μm过滤器,用HPLC进行检测。
1.5 细胞摄取实验
1.5.1 细胞培养及荷瘤鼠构建
所有细胞株均培养于中国医学科学院医药生物技术研究所,SSTR阳性肿瘤AR42J和BON1细胞株用DMEM培养基在37℃、5%CO2细胞培养箱中常规培养。将AR42J细胞种于BALB/c小鼠(20 g左右)右上肢腋下(肿瘤直径为0.5~1.0 cm)进行实验。所有动物实验均符合动物伦理委员会标准。
1.5.2 细胞饱和实验
将生长状态良好的AR42J和BON1细胞分别铺于24孔板,细胞数量约为1×105,培养24 h。向每孔内加入Gluc-Lys([Al18F]NOTA)-KE108(放射性浓度范围1~250 nmol·L-1),抑制组加入Gluc-Lys(NOTA)-KE108(每孔10μL,100μg·mL-1)阻断细胞摄取,在37℃孵育1 h。然后用1 mL PBS(pH=7.4)洗涤两次细胞,最后使用1 mL NaOH(1 mol·L-1)消化5 min裂解细胞。采用自动γ计数仪测量收集的放射性活度。采用GraphPad Prism 5.0软件计算Bmax和Kd值。
1.5.3 细胞摄取实验
向生长状态良好的每孔AR42J和BON1细胞内加 入37 kBq Gluc-Lys([Al18F]NOTA)-KE108在37℃培养15 min、0.5 h、1 h、2 h后,抑制组加入Gluc-Lys(NOTA)-KE108(每孔10μL,100μg·mL-1)阻断细胞摄取,之后用1 mL PBS(pH=7.4)洗涤两次细胞,使用1 mL NaOH(1 mol·L-1)消化5 min裂解细胞,最后计算不同时间点细胞的摄取率。摄取率=细胞中的放射性计数/总放射性计数×100%。
1.6 PET显像研究
取AR42J荷瘤鼠,正常组经尾静脉给药(3.7 MBq(100μL·只)),分别在给药后0.5 h、1 h、2 h和3 h进行PET显像,小鼠呈俯卧位,使用异氟烷和氧气混合全身麻醉下扫描。抑制组在Gluc-Lys([Al18F]NOTA)-KE108给药前0.5 h注射Gluc-Lys(NOTA)-KE108前体(100μg/125μL),使用异氟烷和氧气混合全身麻醉下扫描小鼠。所有数据均进行衰减校正。勾画肿瘤感兴趣区(Region of interest,ROI),记录ROI内的平均计数[(%ID·g-1,-x±s)]。使用Prism软件计算各主要部位的Gluc-Lys([Al18F]NOTA)-KE108富集以及靶与非靶比值。
1.7 生物分布研究
取8只AR42J荷瘤鼠随机分为两组,每组4只。正 常 组 静 脉 注 射0.18 MBq Gluc-Lys([Al18F]NOTA)-KE108后,观察探针在AR42J荷瘤鼠体内的分布情况。抑制组将Gluc-Lys(NOTA)-KE108(100μg)和Gluc-Lys([Al18F]NOTA)-KE108共注射(n=4),小鼠在注射后1 h处死并解剖,取心、肝、脾、肺、骨、肿瘤等组织和脏器,称取重量,用自动γ计数仪计算放射性计数,计算各组织%ID·g-1。
2 结果与讨论
2.1 多肽合成
采用Fmoc固相合成法,通过氨基酸缩合,树脂上多肽的切除,多肽的环化,反相HPLC分离纯化,得到最终的产品Gluc-Lys(NOTA)-KE108。由质谱图(图3)可知,ESI-MS(+)m/z:1 852.8,说明制备得到的多肽分子量与Gluc-Lys(NOTA)-KE108理论分子量(1 852.1)相符合。通过HPLC分析(图4)可知,其纯度大于95%,保留时间为9.09 min。

图3 Gluc-Lys(NOTA)-KE108多肽质谱图Fig.3 Mass spectra of Gluc-Lys(NOTA)-KE108
2.2 Gluc-Lys([Al18F]NOTA)-KE108制备
通过HPLC分析,Gluc-Lys([Al18F]NOTA)-KE108保留时间为9.69 min(图4),与Gluc-Lys(NOTA)-KE108多肽的HPLC保留一致(9.09 min),由此确定标记化合物制备完成。Gluc-Lys([Al18F]NOTA)-KE108标记率为(30±5)%(n=6),放射化产率为(20±5)%(n=6),经HPLC检测放射性纯度大于95%,比活度大于1.37 GBq·μmol-1。

图4 Gluc-Lys(NOTA)-KE108与Gluc-Lys([Al18F]NOTA)-KE108的HPLC分析图谱Fig.4 HPLC analysis of Gluc-Lys([Al18F]NOTA)-KE108 and non-radioactive compound Gluc-Lys(NOTA)-KE108
2.3 理化性质研究
测得Gluc-Lys([Al18F]NOTA)-KE108在正辛醇和PBS中的脂水分配系数lgP=-2.172±0.03(n=3),说明该探针呈水溶性,利于肾脏代谢。通过HPLC分析可知,Gluc-Lys([Al18F]NOTA)-KE108在生理盐水和小牛血清中都很稳定(图5),放置2 h放化纯均大于95%。

图5 Gluc-Lys([Al18F]NOTA)-KE108在生理盐水(a)和血清中(b)的体外稳定性分析图谱Fig.5 In vitro stability of Gluc-Lys([Al18F]NOTA)-KE108 in saline(a)and serum(b)
2.4 细胞摄取实验
2.4.1 细胞饱和结合实验
Gluc-Lys([Al18F]NOTA)-KE108在AR42J和BON1细胞中的饱和结合实验结果如图6所示。在AR42J细胞中Kd值为(152.3±49.1)nmol·L-1(n=4),Bmax为7.8×104min-1/105细胞。在BON1细胞中的Kd值 为(45.5±13.6)nmol·L-1(n=4),Bmax为1.9×104min-1/105细胞。Gluc-Lys([Al18F]NOTA)-KE108展现了较高的SSTR靶向能力。
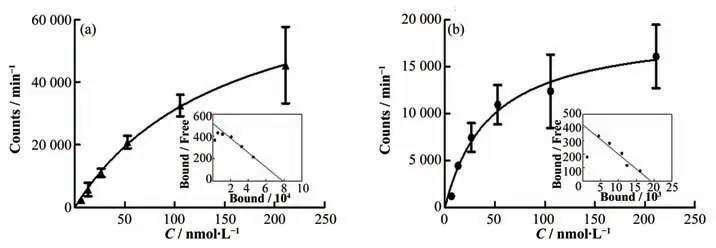
图6 Gluc-Lys([Al18F]NOTA)-KE108在AR42J(a)和BON1(b)细胞中饱和结合实验Fig.6 Saturation binding experimental results of Gluc-Lys([Al18F]NOTA)-KE108 in AR42J(a)and BON1(b)cells
2.4.2 细胞摄取实验
Gluc-Lys([Al18F]NOTA)-KE108在AR42J和BON1细胞中摄取实验结果如图7所示。Gluc-Lys([Al18F]NOTA)-KE108在AR42J细胞中摄取率随时间延长不断增加,在1.5 h达最大值为(5.31±0.37)%,明显高于抑制组(2.84±0.09)%。在BON1细胞中摄取率在30 min达最大,为(4.83±0.53)%,同样探针能够被特异性抑制((2.12±0.53)%)。

图7 Gluc-Lys([Al18F]NOTA)-KE108在AR42J(a)和BON1(b)细胞不同时间点的摄取Fig.7 Uptake of Gluc-Lys([Al18F]NOTA)-KE108 in AR42J(a)and BON1(b)cells at the indicated time points
2.5 PET显像研究
Gluc-Lys([Al18F]NOTA)-KE108在AR42J和BON1肿瘤细胞均具有良好的细胞亲和力和特异性,我们选择在AR42J肿瘤鼠中进行PET显像。结果显示:Gluc-Lys([Al18F]NOTA)-KE108在肝脏和肾脏摄取值高,说明可通过肾脏和肝胆进行清除,AR42J肿瘤摄取在注射后0.5 h达到峰值((2.25±0.44)%ID·g-1),之后稍微降低并逐渐趋于平稳(图8(a)),但由于周围器官摄取值较高,对比度较低(图8(b)),注射后1~2 h为显像最佳时间。

图8 Gluc-Lys([Al18F]NOTA)-KE108在AR42J荷瘤鼠中不同时间点的PET显像(a)及定量分析(b)Fig.8 PET imaging(a)and quantitative analysis(b)of Gluc-Lys([Al18F]NOTA)-KE108 in AR42J tumor-bearing mice at the indicated time points
采用Gluc-Lys(NOTA)-KE108进行阻断实验,评价Gluc-Lys([Al18F]NOTA)-KE108在AR42J肿瘤中的结合特异性和选择性(图9)。将Gluc-Lys([Al18F]NOTA)-KE108与Gluc-Lys(NOTA)-KE108共注射后1 h进行PET显像。结果显示:肿瘤部位的放射性摄取显著降低,摄取值(1.65±0.33)%ID·g-1和(0.82±0.17)%ID·g-1。其肿瘤部位的摄取与肌肉摄取基本一致,显示Gluc-Lys([Al18F]NOTA)-KE108的摄取机制是以SSTR介导。

图9 有无添加抑制剂注射Gluc-Lys([Al18F]NOTA)-KE108 1 h后AR42J荷瘤鼠体内的PET显像(a)及定量分析(b)Fig.9 PET imaging(a)and quantitative analysis(b)of Gluc-Lys([Al18F]NOTA)-KE108 in AR42J tumor-bearing mice with or without adding inhibitor after 1-h injection
2.6 生物分布研究
Gluc-Lys([Al18F]NOTA)-KE108在AR42J荷瘤鼠中生物分布数据如表3所示。由表3可知,在给药后1 h,探针在肾脏的放射性摄取最高,同时肝脏对该探针的摄取也相对较高。当然,Gluc-Lys([Al18F]NOTA)-KE108在骨中也有少量的摄取,说明探针在体内未发生明显的分解,在血液中的摄取较低,说明探针可以快速地分布在组织器官中,在SSTR表达较多的肾上腺中具有一定的摄取,表明其与SSTR具有亲和力。在肿瘤中放射性摄取值为(2.04±0.40)%ID·g-1,并且加入Gluc-Lys(NOTA)-KE108以被明显抑制,摄取值为(1.15±0.08)%ID·g-1,同样的在肾上腺组织也表现出相同的放射性摄取抑制,表明探针具有SSTR靶向性和特异性。

表3 Gluc-Lys([Al18F]NOTA)-KE108在AR42J荷瘤鼠中注射后1 h生物分布(n=4)Table 3 Biodistribution results of Gluc-Lys([Al18F]NOTA)-KE108 in SSTR-positive AR42J tumor-bearing mice for 1 h(n=4)
3 讨论与结论
本研究采用Fmoc固相合成法,合成得到Gluc-Lys(NOTA)-KE108生长抑素类似物。Al18F复合物和Gluc-Lys(NOTA)-KE108通过螯合反应制备了Gluc-Lys([Al18F]NOTA)-KE108,经过Sep-pak C-18 light柱纯化之后放化纯大于95%,总合成时间为20 min。水溶性较好,在生理盐水和小牛血清中放置2 h后,放化纯大于95%,体现出良好的体外稳定性。而采用协同配体进行间接标记的99Tcm-HYNICKE108[25],两步法标记工艺复杂,耗费时间。多个协同配体的加入给产物的纯化也带来了一定的困难。Al18F标记方法虽然标记率较低,但是制备工艺简单易于操作,并且稳定可靠重复性高。而且Gluc-Lys([Al18F]NOTA)-KE108采用了糖基化修饰的KE108多肽作为标记前体,可增加在肿瘤部位的摄取。与18F-Ta-Gluc-TOCA[19]相比,肿瘤的摄取相当。通过细胞摄取实验,发现该探针在PET显像中展现了良好的SSTR靶向性和特异性,在AR42J和BON1细胞上的受体表现出较高的结合亲和力和特异性。但是,在生物分布实验中,Gluc-Lys([Al18F]NOTA)-KE108少量的骨摄取,表明探针在体内具有轻微的不稳定性,下一步将准备添加稳定剂进行进一步探索。

