单核细胞增生性李斯特菌化学发光免疫检测法的建立及验证
栗克文,鲁倩茹,黄凤玲,邢珂慧,邵佩兰
1.宁夏大学农学院,宁夏 银川 750021;2.河南美凯生物科技有限公司,河南 漯河 462001
食品安全关系着国民身体健康,近年来,食品安全事件频发,成为全世界共同关注的话题之一[1-3]。食品检测作为保障食品安全的有效途径,对于民生的保障发挥着巨大的作用。在食源性疾病中,大肠埃希菌、金黄色葡萄球菌、沙门菌及单核细胞增生性李斯特菌(简称单增李斯特菌)4种致病菌的常规检测方法需进行增菌、分离、初筛及鉴定,耗时常达72 h以上[4],同时,现阶段的监测体系过于依赖仪器设备,操作复杂、耗时长,且设备价格昂贵,对于基层市场监管及食品流通的控制具有一定难度。因此,对于食源性病原菌而言,开发快速、高效、简便的检测方法具有较强的现实意义。
单增李斯特菌是一种不形成芽胞、不产生荚膜的革兰阳性短杆菌,作为一种人畜共患病致病原,在污水、土壤、动物粪便等介质中广泛存在。单增李斯特菌感染分为侵袭性及非侵袭性,侵袭性感染多感染妊娠期妇女,表现为流产、早产、甚至死产,胎儿则表现为新生儿败血症及新生儿脑膜炎,具有较高的死亡率。非侵袭性感染是由于该菌能在4℃环境繁殖,成为冰箱冷藏食品如冰激凌、蔬菜、水果、肉类等的主要致病菌,当大量误食该菌污染的食品会引起感染,出现发热、呕吐、腹泻、胃肠炎等症状,而这种类型感染易被人忽视。因此,WHO食品安全工作计划将该菌作为重点检测的食源性病原菌之一,我国食品安全风险监测网也将该菌列为常规监测的致病菌项目之一[5],多个国家就致病菌限量标准进行了规定,其中熟肉制品及发酵肉制品中为不得检出[6]。北京、河南、海南等多个地区进行李斯特菌调查发现,食品、刀具、砧板、冰箱等均存在不同程度的污染[7-13]。目前,单增李斯特菌的检验仍以培养方法为主,不能实现快速筛检及批量样本检测。
本研究制备单增李斯特菌鼠源单抗及兔血清多抗,采用包被兔血清多抗-检测单增李斯特菌-鼠源单抗-催化底物显色双抗体夹心反应体系,建立优化检测单增李斯特菌的化学发光免疫法,以期为食品安全检测提供参考依据。
1 材料与方法
1.1 菌株及细胞 单增李斯特菌(Listeria monocytogenes)ATCC19115、英诺克李斯特菌(Listeria innocua)ATCC33090购自上海复祥生物科技有限公司;单增李斯特菌CMCC54003及CMCC54004购自上海索宝生物科技有限公司;金黄色葡萄球菌(Staphylococcus aureus)ATCC25923、大肠埃希菌(Escherichia coli)ATCC25922及沙门菌(Salmonella)ATCC-14028均购自河南美凯生物科技有限公司;SP/20骨髓瘤细胞购自郑州恒德堂生物科技有限公司。
1.2 实验动物 普通级健康新西兰大白兔[4只,雄性,体重(2.3±0.3)kg,6周龄]及清洁级BALB/c小鼠[8只,雌雄各半,体重(17±2)g,4周龄]购自河北省实验动物中心,合格证编号:1709035。
1.3 主要试剂及仪器 DMEM、RPMI1640及TSAYE平板培养基均购自美国Gibco公司;角鲨烯、斯盘85、吐温-80、PEG-6000、鲁米诺及牛血清白蛋白(BSA)均购自美国Sigma公司;羊抗鼠抗体-HRP购自北京中杉金桥生物技术有限公司;化学发光板购自深圳金灿华实业有限公司;Simplicity型超纯水发生器购自美国密理博公司;Smartline型化学发光仪购自德国拜耳托德公司;MS3 Digital型混匀器购自德国艾卡仪器公司。
1.4 抗体制备
1.4.1 免疫原制备 将单增李斯特菌ATCC19115接种至100 mL TSA-YE培养基中,37℃,150 r/min摇床培养24 h;将菌液装入离心管,1 816×g离心20 min,弃上清,收集沉淀菌体。用无菌生理盐水悬浮,1 816×g离心20 min,弃上清,以上操作重复2次,收集沉淀菌体,加入100 mL含0.35%甲醛的无菌生理盐水,37℃灭活24 h,1 816×g离心20 min,弃上清,收集菌体。用50 mL无菌生理盐水重悬菌体,采用麦氏比浊法计数,5 mL/管分装,-20℃保存备用。使用前取1管免疫原用无菌生理盐水稀释至1×109CFU/mL,取5.0 mL稀释菌液加入5.0 mL MF59佐剂[14-15],充分混匀,制成免疫原,4℃保存备用。
1.4.2 兔血清多抗的制备 新西兰大白兔4只,经背部5个注射点皮下注射免疫原,每点0.2 mL,1 mL/只。首免后每隔14 d加强免疫1次,每点0.1 mL,0.5 mL/只,共加强免疫3次。第2次加强免疫7 d后耳缘静脉采血,分离血清,检测抗体效价。选择抗体效价最高的1只白兔,于末次免疫第7天进行颈动脉取血,分离血清,采用饱和硫酸铵两步法纯化抗体,纯化后按1∶1加入甘油,于-20℃保存。
1.4.3 鼠源单抗的制备 BALB/c小鼠8只,经脊柱两侧皮下免疫,免疫方法及周期同1.4.2项,初免剂量为0.2 mL/只,加强免疫剂量为0.1 mL/只。挑选抗体效价最高的小鼠,于末次免疫第3天进行脾细胞融合,单抗制备方法参考文献[16-17]。将收集的腹水,用辛酸-硫酸铵方法进行纯化,纯化后按1∶1加入甘油,于-20℃保存。
1.5 方法的建立 将不同浓度兔血清多抗分别加入化学发光板进行包被,洗板,封闭后,依次加入1×105CFU/mL单增李斯特菌ATCC19115菌液50μL及鼠源单抗(1∶200稀释)50μL,37℃反应不同时间;PBST洗涤5次,加入0.02 mol/mL磷酸盐缓冲液(pH 7.2)稀释1 000倍的羊抗鼠抗体-HRP 100μL,37℃孵育60 min;PBST洗涤5次,加入含0.1 mg/mL鲁米诺及0.01 mg/mL过氧化脲的磷酸盐溶液(pH 8.0)100μL,室温反应5 min;用化学发仪检测化学发光强度值(RLU)。
1.6 方法的优化
1.6.1 包被抗体浓度的优化 将0.015 mol/L碳酸盐缓冲液(pH 9.5)稀释的1.0、0.5、0.1、0.05、0.01、0.005、0.001、0.000 5 mg/mL兔血清多抗分别加入化学发光板,进行包被,其余操作按1.5项。
1.6.2 样本反应时间的优化 用0.05 mg/mL兔血清多抗包被化学发光板,依次加入1×105CFU/mL单增李斯特菌ATCC19115菌液50μL及鼠源单抗(1∶200稀释)50μL,于37℃分别孵育30、35、40、45、50、55、60 min,其余操作按1.5项。
1.7 方法的验证
1.7.1 检测范围及灵敏度 用0.05 mg/mL兔血清多抗包被化学发光板,分别加入浓度为1×100、1×101、1×102、1×103、1×104、1×105、1×106、1×107、1×108CFU/mL单增李斯特菌50μL,其余操作按1.5项。
1.7.2 特异性 用0.05 mg/mL兔血清多抗包被化学发光板,分别加入1×104CFU/mL的单增李斯特菌ATCC19115、CMCC54003、CMCC54004、英诺克李斯特菌ATCC33090、金黄色葡萄球菌ATCC25923、大肠埃希菌ATCC25922及沙门菌ATCC14028各50μL,其余操作按1.5项。
1.7.3 准确性 在无菌环境下,将切碎的火腿肠及冰激凌各10 g分别置研钵中,加入90 mL无菌生理盐水研磨成浆,4 650×g离心5 min,收集上清液;10 mL牛奶加入90 mL无菌生理盐水充分混匀,4 650×g离心5 min,收集上清液。分别取3种样本上清液各0.9 mL,加入1×105CFU/mL单增李斯特菌菌悬液0.1 mL,作为载体添加溶液;取生理盐水0.9 mL,加入1×105CFU/mL单增李斯特菌菌悬液0.1 mL,作为阳性对照,同时以生理盐水为阴性对照,以无菌的火腿肠、牛奶、冰激凌提取液作为空白对照。用0.05 mg/mL兔血清多抗包被化学发光板,分别加入阳性及阴性对照及3种载体添加溶液及其空白对照各50μL,其余操作按1.5项。按下式计算不同介质中单增李斯特菌的回收率。
回收率(%)=样本检测值/阳性对照值×100%
1.7.4 稳定性 用0.1 mg/mL多抗包被化学发光板,用铝箔袋封装并热封闭,37℃分别放置7、14、21、28 d后取出,分别加入1×104CFU/mL单增李斯特菌菌悬液50μL,其余操作按1.5项。
2 结果
2.1 抗体效价 兔血清多抗效价为1∶256 000,鼠源单抗效价为1∶128 000。
2.2 方法的优化
2.2.1 兔血清多抗包被浓度 结果显示,随着兔血清多抗包被浓度的增加,单增李斯特菌发光值也增高,当包被浓度>0.1 mg/mL时,单增李斯特菌发光值增加减缓,见图1。选择兔血清多抗包被浓度为0.05 mg/mL。
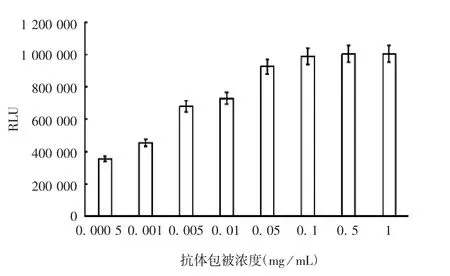
图1 抗体不同包被浓度对单增李斯特菌发光值的影响Fig.1 Effect of antibody concentration for coating on chemiluminescence value of L.monocytogenes
2.2.2 反应时间 结果显示,反应30~40 min,单增李斯特菌发光值较低,反应40 min后进入平台期,见图2。根据时间最短操作最优的原则,选择40 min为最适反应时间。
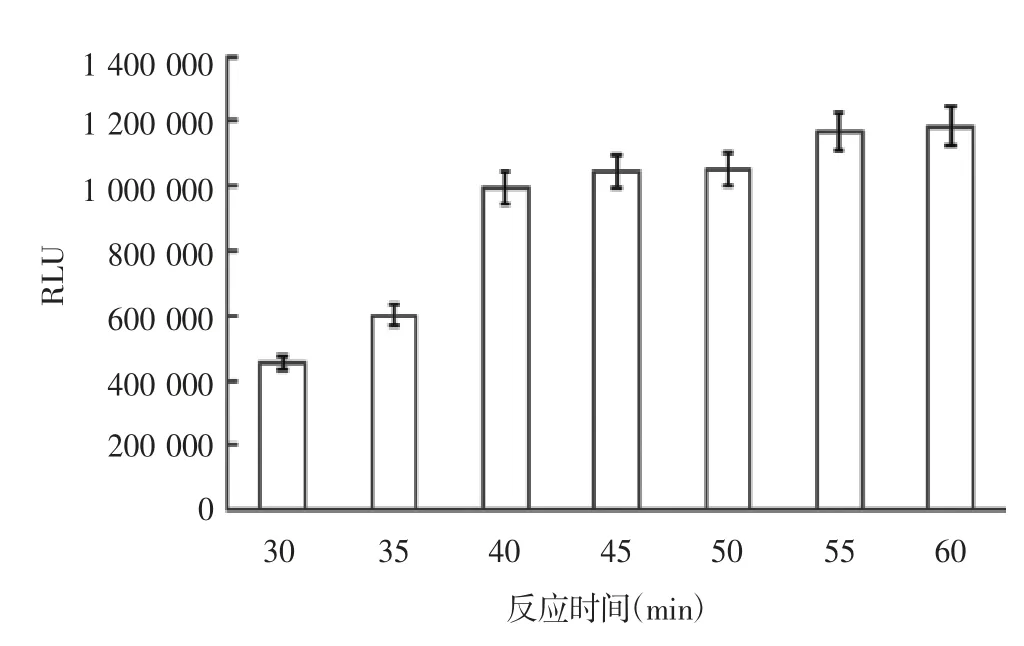
图2 不同反应时间对单增李斯特菌发光值的影响Fig.2 Effect of reaction time on chemiluminescence value of L.monocytogenes
2.3 方法的验证
2.3.1 检测范围及灵敏度 结果显示,随着单增李斯特菌浓度增加,其发光值逐渐增高,当单增李斯特菌数浓度为1×106CFU/mL时,其发光值增加缓慢,大于1×107CFU/mL时,发光值进入平台期,见图3。该方法检测单增李斯特菌浓度范围为1×101~1×107CFU/mL,灵敏度小于10 CFU/mL。
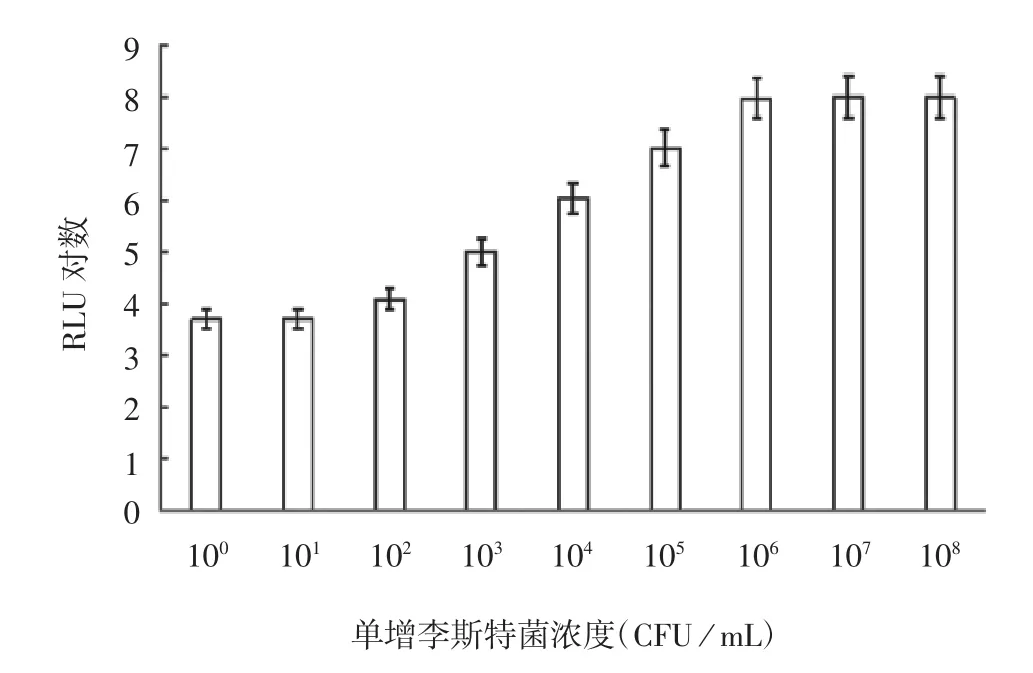
图3 不同浓度单增李斯特菌对发光值的影响Fig.3 Effect of L.monocytogenes concentration on chemiluminescence value
2.3.2 特异性 结果显示,除单增李斯特菌ATCC-19115外,单增李斯特菌CMCC54003、CMCC54004、英诺克李斯特菌也可检测到,而金黄色葡萄球菌、大肠埃希菌及沙门菌检测不到,见图4。表明该方法除单增李斯特菌外,对英诺克李斯特菌有部分交叉反应,对其他菌无交叉反应。
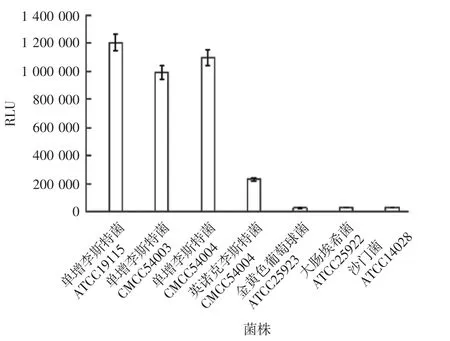
图4 不同菌株的发光值Fig.4 Chemiluminescence valuesof various bacterial strains
2.3.3 准确性 结果显示,添加菌液的冰激凌、火腿肠、牛奶均检出单增李斯特菌,回收率分别为96.3%、90.3%和101.6%,阴性及空白对照均未检出,见图5。
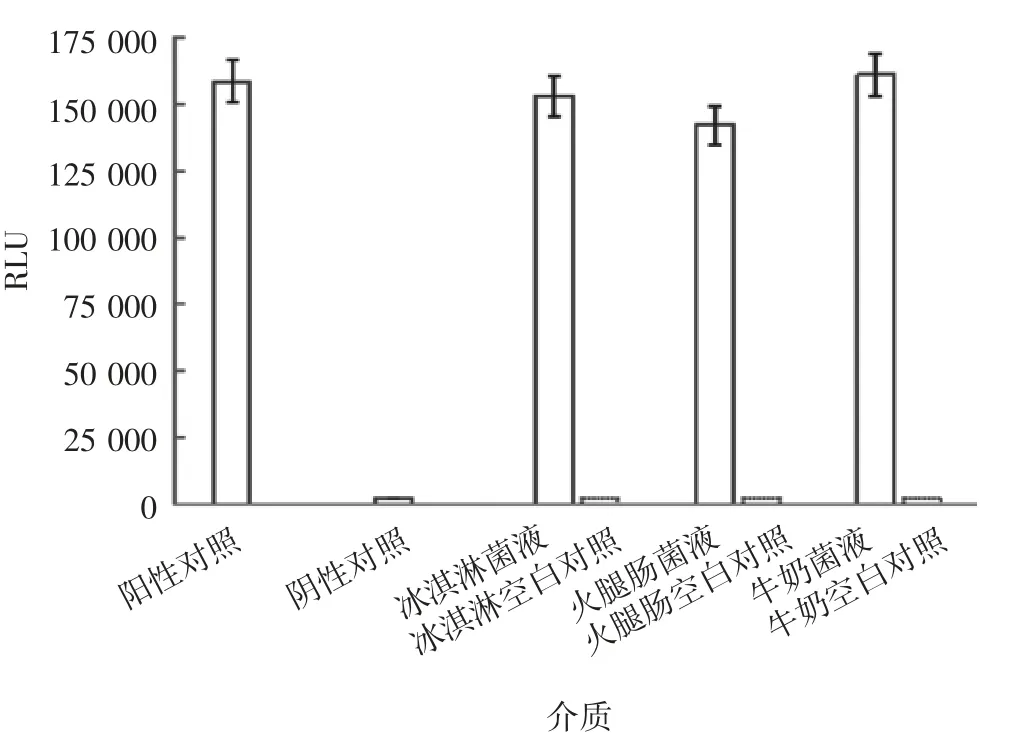
图5 不同介质对单增李斯特菌发光值的影响Fig.5 Effect of media on chemiluminescence value of L.monocytogenes
2.3.4 稳定性 结果显示,随放置时间增加,单增李斯特菌发光值逐渐降低,14 d后降速较缓,28 d发光值为初始包被值的75.3%,见图6。方法的稳定性良好。
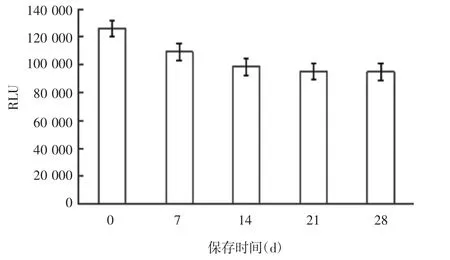
图6 不同保存时间对单增李斯特菌发光值的影响Fig.6 Effect of time for storage on chemiluminescence value of L.monocytogenes
3 讨论
免疫学检测方法具有良好的特异性及重复性,可同时对多个样品进行检测,实现检测自动化,而单一免疫学检测法稳定性较差。化学发光免疫分析方法是将高特异性的免疫分析法与高灵敏度的化学发光分析法结合后形成的一种新的测定方法,该方法可提高检测的灵敏度及特异性。
本研究以单增李斯特菌为抗原制备鼠源单抗和兔血清多抗,构建“兔血清多抗载体-单增李斯特菌-鼠源单抗”双抗体夹心反应体系,采用鲁米诺作为发光底物,建立检测单增李斯特菌化学发光免疫法,通过优化抗体包被浓度、样本反应时间,该方法的检测范围达1×101~1×107CFU/mL,较传统免疫学方法有显著优势[18-19];通对化学发光板的稳定试验,为理论货架期提供了依据;除单增李斯特菌外,对英诺克李斯特菌有部分交叉反应,对其他菌无交叉反应,关于同菌属的英诺克李斯特菌,可结合分子生物学方法作进一步的种属筛查。
本研究成功建立了检测单增李斯特菌化学发光免疫法,该方法特异性高、操作简单、反应时间短、可批量检测,能满足普通的食品单增李斯特菌的快速检测要求[20-21],为开展食品风险评估,进行风险预警,促进食品安全检测提供参考依据。

