ABCA1:调控胆固醇逆向转运与炎症激活之间关系的研究新进展
李佳珊 关秀茹,2
(1.哈尔滨医科大学附属第一医院,黑龙江 哈尔滨 150001; 2.哈尔滨医科大学附属第一医院检验科,黑龙江 哈尔滨 150001)
动脉粥样硬化(atherosclerosis,AS)是一种以脂质沉积和炎症反应为特点的慢性炎症性疾病。临床研究指出高密度脂蛋白(high density lipoprotein,HDL)血清含量与AS发病率呈负相关[1]。HDL的主要功能是将胆固醇从外周组织运输到肝脏,这一过程被称为“反向胆固醇转运”(reverse cholesterol transport,RCT),它可清除动脉血管中多余的胆固醇,从而减少脂质沉积,阻止泡沫细胞的形成并预防AS的发生。为了启动RCT,三磷酸腺苷结合盒转运体(ATP-binding cassette transporter,ABC)A1运输磷脂和胆固醇,随后将其装载到载脂蛋白A-I(ApoA-I)形成HDL前体[2]。ABC转运蛋白是一类整合膜蛋白家族,能够利用ATP的水解作用,穿过细胞膜的磷脂双分子层化学转运不同的底物。目前已知有49种不同的基因编码人类的ABC转运蛋白,这些转运蛋白广泛参与细胞过程,能转运大量不同的疏水化合物穿越细胞边界。由于某些基因在转录的过程中被交替剪接,因此这49个基因中的每个基因不只编码一种蛋白质,而是编码多种ABC蛋白变体。基于基因结构的相似性以及核苷酸结合域和跨膜域的序列同源性,ABC转运蛋白又分为7个亚科,被命名为ABCA~G。ABCA亚家族有12个成员,其中就包括ABCA1,其主要参与脂质分子穿越细胞膜的运动[3]。但目前的研究认为ABCA1不仅能逆向转运细胞内的胆固醇,减少泡沫细胞的形成,而且在AS的慢性炎症反应过程中扮演着重要作用。ABCA1贯穿AS形成的整个过程,靶向ABCA1既可减少脂质沉积又可减弱炎症反应,可作为治疗和预防AS的关键靶点。根据最近的研究报道,以ABCA1为药物靶点的治疗已在动物实验中取得很好的效果[4],而相关药物是否可用于临床上治疗人类心血管疾病还有待进一步研究。现对ABCA1调控的胆固醇代谢与炎症反应之间关系的最新进展进行综述。
1 ABCA1的结构与功能
ABC转运蛋白家族主要由四个核心结构域组成,即两个跨膜结构域和两个核苷酸结合结构域。ABCA1是一个结构完整的转运蛋白,而这四个结构域是由一条包含2 261个残基的多肽链构成。ABCA转运蛋白亚型,特别是ABCA1具有两个糖基化修饰的胞外结构域,并含有一定数量的二硫键。这些附属结构域可调节蛋白与蛋白之间的相互作用。近年研究发现ABCA1在HDL的生物合成和维持胆固醇稳态方面具有重要作用[5]。
ABCA1基因突变可导致常染色体隐性遗传病:HDL缺乏症,以血清中较低的HDL含量以及组织巨噬细胞内胆固醇沉积为特点,可引发AS的形成[6]。转运蛋白可调控磷脂和游离胆固醇从细胞质膜释放并与细胞外基质中的ApoA-I结合,从而产生HDL前体颗粒。ABCA1和其他ABC转运蛋白的作用则是促进细胞内游离胆固醇外流并结合ApoA-I,增强胆固醇从巨噬细胞逆向转运到肝脏进行代谢,从而预防心血管疾病的发生[7]。
2 在AS中的ABCA1依赖性胆固醇转运和炎症反应
胆固醇代谢阻碍和炎症反应是促进AS发展的两个重要过程。近年,一些研究报道了在AS形成的两个过程的病理性改变。椴树素是一种典型的黄酮成分,研究表明它可通过下调巨噬细胞和平滑肌细胞内的肿瘤坏死因子(TNF)-α/核因子(NF)-κB通路抑制炎症反应发生。此外椴树素下调SR-A1 mRNA,阻止巨噬细胞样泡沫细胞形成,同时上调B类清道夫受体和ABCA1基因的表达,进而增强RCT代谢过程[8]。有关RCT和炎症反应的病理变化在动物体内实验中也有相似的文献报道。Ou等[9]发现在ApoE-/-小鼠体内,血管生成素-1(Ang-1)调控Tie2/TFE3/LXRα通路,进而下调ABCA1和ABCG1的表达,引起小鼠RCT下降,同时血清中HDL胆固醇含量显著减少。Ang-1增加TNF-α、白介素(IL)-6和IL-1β炎症因子的表达,促进脂质在斑块细胞内的积累,同时促进炎症性M1亚型巨噬细胞生成,这些作用加速了炎症反应并加重了AS的发生。Zhang等[10]探究了Wnt5a/Ror2通路在致心血管疾病方面的作用机制,在ApoE-/-小鼠中Wnt5a高表达,敲除Wnt5a发现细胞内胆固醇积累与炎症反应下降,而过表达Wnt5a能抑制ABCA1的合成与表达,同时促进NF-κB和促炎细胞因子的表达,敲除Ror2可逆转过表达Wnt5a的作用。此外抑制ABCA1后胆固醇积累和炎症反应也相应增多。上述研究提示Wnt5a/Ror2通路对胆固醇转运和炎症反应的重要作用。胆固醇受阻导致的脂质沉积和炎症反应是AS早期的主要病理特征,进一步探索二者之间的关系将为预防和治疗AS提供新思路。
3 ABCA1调节细胞内的炎症信号
3.1 ABCA1对内皮细胞炎症反应的调控作用
清除内皮内膜下过量的脂质沉积可有效地减少AS的发生。基因治疗是一种新方法,通过增加血管壁ApoA-I和ABCA1基因的表达,促进RCT,可有效地预防或逆转AS。之前研究报道了利用辅助病毒依赖型腺病毒载体在高脂喂养兔子的内皮细胞中表达ApoA-I,结果发现表达ApoA-I的内皮细胞胆固醇流出能力增强,同时斑块面积明显缩小,脂质以及炎症细胞积累也相应减少[11-12]。然而由于ApoA-I调控的胆固醇代谢依赖于ABCA1的表达,治疗效果有局限性。其他研究者尝试在内皮细胞中过表达ABCA1,结果表明大动脉中AS的发生显著减少。与此同时,血清中HDL胆固醇升高40%,排除了内皮细胞中ABCA1过表达对减少AS的局部作用[13]。最近一项新的研究报道了在内皮细胞中同时过表达ApoA-I和ABCA1,胆固醇外流增强,炎症标志物表达减少。但单独ABCA1过表达处理对内皮细胞增殖、迁移、代谢以及炎症标志物表达的影响很小,只有ApoA-I和ABCA1共同过表达的条件下,效果才比较显著[14]。ABCA1促进ApoA-I转运至内皮内膜下,加速细胞内胆固醇的转运和清除,因此ApoA-I/ABCA1可能作为治疗AS新的靶点。
3.2 巨噬细胞内炎症反应的调控与ABCA1
ABCA1能将过量的脂质从细胞内转运到ApoA-I,并参与HDL的合成。最近研究表明ABCA1与ApoA-I相互作用,通过激活Janus激酶2,进而激活信号转守和转录激活因子3(STAT3),可显著减少巨噬细胞内促炎细胞因子的表达。随后的研究表明在缺乏胆固醇外流能力的情况下,ApoA-I与ABCA1共同作用激活STAT3,可显著减少巨噬细胞内促炎细胞因子的表达,证明ApoA-I/ABCA1/STAT3通路具有明显的抑炎作用。在另一组对照实验中,ApoA-I/ABCA1调控胆固醇外流正常但缺乏STAT3激活的能力,发现巨噬细胞内炎症反应也减少。以上研究表明ApoA-I/ABCA1激活胆固醇外流和此通路,进一步激活STAT3,二者以协同的方式抑制巨噬细胞炎症反应的发生[15],另一项研究也证明ABCA1对炎症反应的调控作用。巨噬细胞浸润在肺气肿和AS中都很常见,香烟烟雾可下调巨噬细胞内胆固醇转运子ABCA1的表达,导致巨噬细胞来源的泡沫细胞形成。在体内和体外研究中,暴露于香烟烟雾的巨噬细胞都表现出对ABCA1依赖性RCT产生不利的影响,同时增强Toll样受体4(TLR4)/髓系分化初级反应基因88信号,并导致基质金属蛋白酶上调和炎症加重。LXR激动剂可恢复短期烟雾导致的ABCA1表达异常,并明显减少炎症反应,但LXR激动剂不能减弱ABCA1敲除的巨噬细胞以及小鼠体内的炎症反应,证明LXR激动剂减弱巨噬细胞炎症反应依赖于ABCA1的作用机制[16]。Zhang等[17]探究参红通络配方对心血管保护作用的机制,参红通络处理氧化修饰低密度脂蛋白诱导的巨噬细胞,可减少巨噬细胞内活性氧积累,减少炎症因子TNF-α和IL-6的表达,同时巨噬细胞内脂质蓄积减少。进一步研究发现PPARγ/LXR-α/ABCA1信号通路作为参红通络的靶点,抑制下游炎症信号以及细胞内脂质蓄积,对心血管具有保护作用。综上所述,ABCA1转运子对于巨噬细胞内脂质蓄积以及炎症因子的释放具有重要作用,靶向巨噬细胞内的ABCA1可能有助于减少泡沫细胞形成,缓解血管炎症环境,起到抑制AS发展的作用。
3.3 平滑肌细胞中ABCA1对炎症激活的调控作用
平滑肌细胞(smooth muscle cell,SMC)内胆固醇积累可诱导细胞分化为泡沫细胞表型。细胞内沉积的胆固醇下调SMC标志物ACTA2和钙调蛋白的表达,增加炎症相关基因Mac-2、CD11b和MHCⅡ的表达。HDL3与ABCA1相互作用调节下游miR-153/145,恢复SMC标志物的表达,减少炎症反应,可有效地阻止SMC分化为泡沫细胞表型,抑制AS的发生[18]。靶向ABCA1可减少泡沫细胞形成,可能作为抑制SMC表型转化的新靶点。
4 炎症刺激对ABCA1介导胆固醇转运的作用
最近一项研究报道了慢性温和刺激(chronic unpredicted mild stress,CUMS)通过激活TLR4对AS发展的作用机制。AopE-/-小鼠给予CUMS,结果发现HMGB1、TLR4以及促炎细胞因子IL-1β和TNF-α表达均增高,而PPARγ、LXRα和ABCA1蛋白表达下调。进一步的分析表明在CUMS作用下,上调的HMGB1/TLR4炎症信号通过抑制PPARγ/LXRα/ABCA1信号通路加速泡沫细胞形成以及AS的发展[19]。托法替尼可减少类风湿关节炎患者的关节滑膜炎症。报道称托法替尼通过抑制JAK/STAT信号,增加细胞LXRα和ABCA1的表达,RCT增强,加速细胞内脂质释放[20]。以上研究表明LXRα/ABCA1通路在炎症损害RCT方面扮演着十分重要的作用。D’Amore等[21]的研究表明NF-κB靶向miR-9-5p可抑制ABCA1的表达,阻碍RCT。而在2019年的一项体外试验研究中,利用TNF预处理两种肺上皮细胞系(BEAS-2B和A549),模拟炎症环境,研究发现只有在BEAS-2B细胞中ABCA1表达上调,说明两种细胞系应对炎症环境的反应有差异性[22]。这些研究为炎症反应与ABCA1调控的胆固醇转运之间的关系提供了新的靶点通路和视角,ABCA1作为炎症反应的下游靶点,对于以慢性炎症为特点的AS的发展具有至关重要的作用。
5 ABCA1调节的RCT与炎症小体
CANTOS(Canakinumab Antiinflammatory Thrombosis Outcome Study)试验证明拮抗IL-1β可减少既往患有心肌梗死和系统性炎症疾病患者的冠心病风险,这说明诱导IL-1β分泌的通路可能增加心血管疾病的患病风险。胆固醇在细胞内不断积累可刺激骨髓细胞内NLRP3炎症小体激活,促进IL-1β和IL-18的成熟与分泌。但目前NLRP3炎症小体的致动脉粥样硬化形成的机制还不清楚。研究表明,骨髓细胞ABCA1/G1缺失诱导IL-1β和IL-18大量分泌,再同时抑制NLRP3或caspase-1/11表达,即可恢复IL-1β和IL-18的表达水平。同样,在ABCA1/G1缺陷的LDLR-/-小鼠中,敲除NLRP3或caspase-1/11基因即可减少斑块面积[23]。以上结果证明ABCA1/G1基因缺陷能通过上调NLRP3/caspase-1通路促进AS斑块的形成,而抑制NLRP3/caspase-1通路可有效缓解AS的发生和发展。但NLRP3/caspase-1通路促进AS斑块形成的机制还不明了。接下来的研究表明骨髓细胞ABCA1/G1基因缺失不仅可增加单核细胞和巨噬细胞内caspase-1的裂解成熟,对中性粒细胞也会产生相同作用。研究表明炎症小体激活可导致斑块内中性粒细胞的招募聚集以及中性粒细胞胞外陷阱的形成,引起斑块内中性粒细胞激活和积累。近些年的研究表明中性粒细胞胞外陷阱的形成过程能加快小鼠AS斑块的发展[24],并且与人类AS斑块的不稳定和侵蚀性有关[25-26]。家族性HDL缺乏症患者,骨髓细胞内胆固醇内容物增加,同时炎症小体相关标志物也相应增加[23,27],暗示了胆固醇积累诱导炎症小体形成的人类相似性,有待进一步研究。
6 展望
动脉粥样硬化性血管疾病的一个标志是脂质和胆固醇在血管内皮下间隙和内膜的泡沫细胞内不断地累积。目前已识别了几种ABC转运蛋白在外排和运输细胞内脂质以及胆固醇方面具有重要作用,而某种ABC转运蛋白的缺失可能加重AS的发展。研究表明ABCA1、ABCA5、ABCG1、ABCG5、ABCG8和ABCB4都能通过作用于RCT,进而对心血管疾病的发展产生影响[28]。此外,内皮细胞功能失调以及复杂的不稳定斑块可诱导血管紧张性收缩,管腔变窄,引起急性血栓并发症如心肌梗死和卒中的发生,而血小板是决定血栓事件的关键效应细胞。研究报道了ABC转运蛋白如ABCB6、ABCC4或ABCG4参与了血小板的分化和功能,与心血管疾病的发病机制相关。同时大量研究表明在ABC转运蛋白家族中,特别是ABCC亚科对于内皮细胞功能和心肌细胞生理活动的调控具有重要作用[28]。ABCA1作为ABC转运蛋白家族中的一员,在HDL的形成以及血管内皮细胞和巨噬细胞内胆固醇以及脂质的外排中起关键作用。ABCA1调控细胞内RCT,同时也激活炎症反应的发生。本文综述了ABCA1与炎症信号的交互作用机制以及ABCA1激活炎症小体的致AS机制(见图1),通过对最新进展的分析发现,ABCA1在泡沫细胞形成以及炎症反应激活方面均扮演着重要角色,同时ABCA1通过激活炎症小体从而诱导的中性粒细胞胞外陷阱形成对于斑块的发展与稳定具有重要意义。AS形成的两个主要病理过程为脂质沉积和炎症反应,但目前对于二者的相关性研究很少。而靶向调控ABCA1基因可同时调节胆固醇转运以及炎症反应两个过程,因此以ABCA1为切入点,可能对于临床治疗冠心病具有开创性的意义。
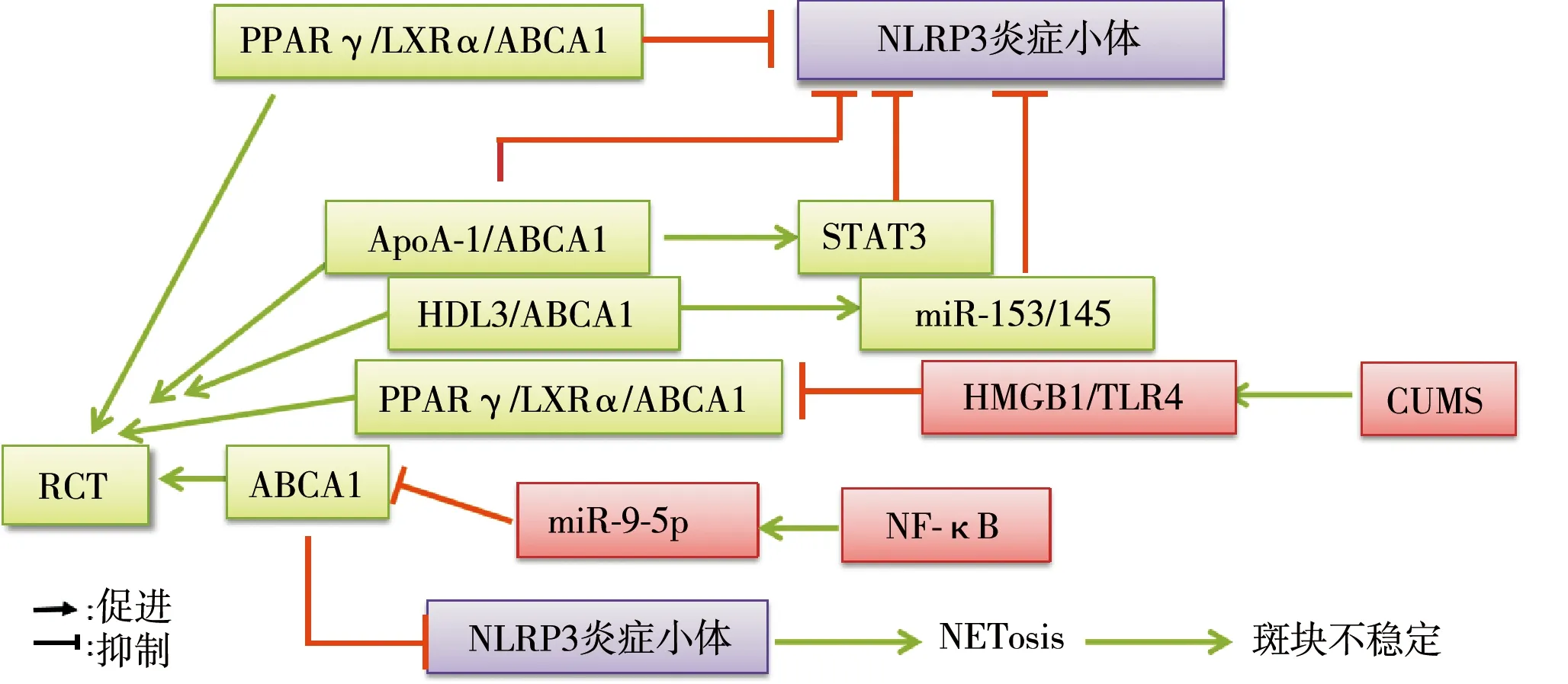
注:NETosis:中性粒细胞的尖性细胞死亡方式。