耐辐射奇球菌急性毒性研究*
许 琴 宋来阳 张 蕾 李佳佳 马 娜 江俊峰 刘爱中 蒲凤萍 邓 培 刘江伟 王 玮
(1. 中国人民解放军新疆军区总医院,新疆特殊环境医学重点实验室,乌鲁木齐 830000)(2. 中国人民解放军陆军第九四八医院,乌苏 833000)(3. 新疆农业大学科学技术学院,乌鲁木齐 830091)(4. 新疆特殊环境微生物重点实验室,新疆农业科学院微生物应用研究所,乌鲁木齐 830091)
耐辐射奇球菌(Deinococcusradiodurans,DR)是1956年由Anderson等[1]在辐射灭菌后仍然变质的肉类罐头中分离出来的一种微小球菌。该菌在培养基上形成红色菌落、不形成芽孢、无致病性、革兰氏染色阳性、严格好氧、菌体形态较大,常形成四聚体。耐辐射奇球菌属异常球菌科(Deinococcaceae)异常球菌属(Deinococcus),该菌对电离辐射的存活最高剂量约15 kGy,抗性是普通真核生物的100倍,对紫外线、干燥、强氧化剂和某些化学诱变剂显示超乎寻常的抗性[2]。陈立等[3]首次从耐辐射奇球菌代谢产物中分离得到5个化合物腺嘌呤、胸腺嘧啶、尿嘧啶、腺苷、 L-丙氨酸,前4种代谢产物是核酸及脱氧核酸合成的底物。DR的强抗辐射性,其基本机制是有高效的 DNA 修复系统,体内存在超氧化物酶(SOD)和过氧化氢酶(CAT)等抗氧化保护酶系相关基因的高水平表达[4]。
杨桥等[5]对DR中的类胡萝卜素——Deinoxanthin 进行了大量研究,研究结果表明DR中的类胡萝卜素具有很强的清除活性氧自由基的功能。DR的pprⅠ基因及PprM蛋白能够在细胞或小鼠或体内稳定转染,并发挥抗氧化与抑制肿瘤生长的作用[6-7]。我们推测DR在生命科学研究领域中有着广阔的应用前景。近年来科研人员对其环境修复、基因修复等方面研究较多,动物实验及药理学研究相对较少。据所查文献资料,未见DR活菌及其菌体破碎物相关的急性毒性实验报道,我们就此进行了研究,以期为DR作为肠道益生菌的推广应用提供实验依据。
1 材料和方法
1.1 材料和试剂
DR活菌培养物由新疆农业科学院应用微生物研究所提供;SPF级KM小鼠60只,雌雄各半,18~22 g,购自新疆医科大学实验动物中心,实验动物生产许可证号:SCXK(新)2018-0002,实验动物使用许可证号:SYXK(军)2017-0050;全自动生化分析仪BS-180(深圳迈瑞生物医疗电子股份有限公司);台式低速离心机TDZ5(湖南赫西仪器装备有限公司);全自动血细胞分析仪BC-2800vet(深圳迈瑞动物医疗电子股份有限公司);-80 ℃冰箱(三洋);超声破碎仪SK3310LHC(上海科导超声仪器有限公司);SW-CJ-2FD双人单面洁净工作台(苏州苏洁净设备有限公司);分析天平TP-214(丹佛仪器北京有限公司);ACS-1.5A型电子计重秤(上海友声衡器有限公司)。
1.2 方法
1.2.1DR浓度的确定:DR培养至对数生长期后,测定其OD值,OD值达到1.9~2.0,细菌增殖基本停止,根据其生长曲线,此时的DR菌液浓度为1×109/mL。将此作为高浓度灌胃菌液,高浓度DR菌液用空白培养基稀释100倍后(1×107/mL)作为低浓度灌胃菌液。
1.2.2DR破碎物的制备:分别将高、低浓度的活菌于-80 ℃冰箱及超声破碎仪中(37 ℃、50 kHz、30 min)反复冻融5~7次,得到高、低浓度的DR菌体破碎物。
1.2.3实验分组:按照DR菌液小鼠灌胃给药的浓度分为高浓度活菌组(1×109/mL)、低浓度活菌组(1×107/mL)、高浓度细菌破碎物组(1×109/mL)、低浓度细菌破碎物组(1×107/mL)和灌胃相同体积的胰蛋白胨葡萄糖酵母琼脂培养基(tryptone glucose yeast agar medium,TGY)的TGY培养基组。
1.2.4预实验:SPF级KM小鼠10只,雌雄各半,实验前12 h禁食不禁水,高浓度活菌(1×109/mL)以最大灌胃体积0.4 mL/10 g灌胃,24 h内,每隔6 h灌胃1次,连续灌胃3次,参照王艳秀等[8]的急性毒性小鼠行为学观察指标,记录异常症状小鼠的数量、症状开始时间、结束时间、死亡时间等,观察48 h,计算DR的半数致死量LD50。对48 h后未死亡的小鼠,一侧眼球眶静脉取血于EDTA-k2抗凝管中,左右颠倒充分抗凝,立即进行血常规检测(白细胞、淋巴细胞、红细胞、血红蛋白、红细胞压积、平均红细胞体积、血小板)以及生化指标,血常规检测结束后的抗凝全血,3 000 r/min离心15 min获取血浆用于生化指标的检测(谷丙转氨酶、谷草转氨酶、总蛋白、肌酐、肌酸激酶、镁、磷、肌酸激酶型同工酶、乳酸脱氢酶)。解剖小鼠,肉眼观察小鼠主要脏器(心、肝、脾、肺、肾、脑及胸腺)有无病理改变,称体质量,根据每只小鼠体质量计算小鼠脏器质量分数。
1.2.5急性毒性实验:取KM小鼠50只随机分为5组,雌雄对半。灌胃前12 h内禁食不禁水,第2天以最大灌胃体积0.4 mL/10 g灌胃菌液2次,间隔8 h,常规饲养观察14 d。记录小鼠异常行为学反应、死亡数量及时间,并记录灌胃后1 d、3 d、5 d、7 d、10 d及14 d的体质量。14 d后,按照预实验的方法,检测血常规及血浆生化指标,测定脏器系数,进行毒理学分析。
脏器系数计算依据下式进行:脏器系数=脏器质量(g)/动物体质量(g)×100%
1.3 统计学分析
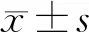
2 结果
2.1 DR急性毒性预实验结果
小鼠在灌胃后0.5 h内有趴窝、安静不动及扎堆现象,0.5 h后恢复正常,之后未见受试小鼠瞳孔改变、眼球凸出、眼睑下垂,未见小鼠分泌物、大小便、呼吸异常及皮肤颜色改变,无小鼠死亡,无法计算出LD50,解剖后肉眼观察主要脏器无明显病理变化,血常规与血液生化指标均在SPF级KM小鼠正常参考指标范围内[9]。
2.2 DR急性毒性正式实验结果
2.2.1DR及其破碎物对小鼠体质量增加的影响:灌胃14 d,与TGY培养基组比较,不同浓度组的小鼠体质量增加,差异不显著(P>0.05),表明DR对小鼠体质量增长无不良影响(图1)。
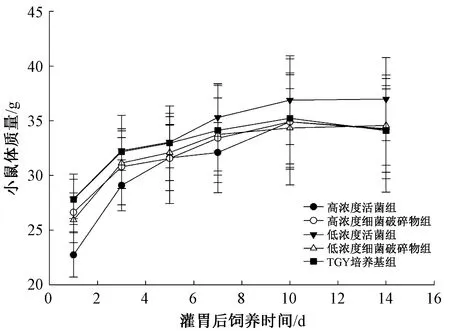
图1 DR及其破碎物灌胃小鼠体质量的变化
2.2.2DR活菌及其破碎物对小鼠血常规指标的
影响:灌胃14 d后,与TGY培养基组比较,不同浓度组的小鼠血常规指标差异均不显著(P>0.05),表明DR对小鼠白细胞、淋巴细胞、红细胞、血红蛋白、红细胞压积、平均红细胞体积、血小板等未产生异常影响(表1)。
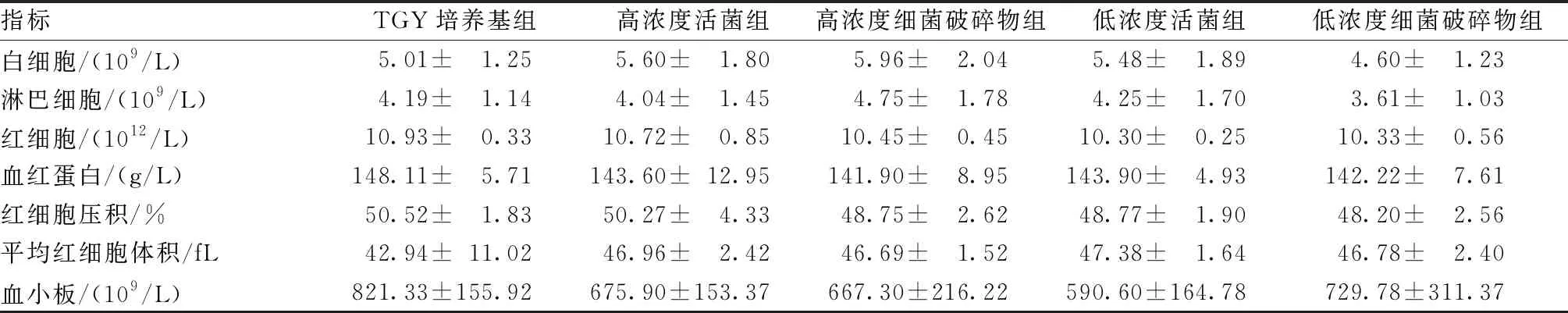
表1 DR及其菌体破碎物灌胃后小鼠血常规的测定值
2.2.3DR及其破碎物对小鼠血生化指标的影响:灌胃14 d后,与TGY培养基组比较,不同浓度组的小鼠生化指标差异均不显著(P>0.05),表明DR对小鼠肝、肾、心等主要脏器功能及镁、磷离子浓度无不良影响(表2)。

表2 DR及其破碎物灌胃后小鼠的血浆生化指标测定值
2.2.4DR及其破碎物对小鼠脏器系数的影响:灌胃14 d后,不同浓度组小鼠主要脏器系数与TGY培养基组比较,除低浓度细菌破碎物组脾脏较其他组有显著增大(P<0.05)外,其他脏器差异均不显著(P>0.05)(表3)。
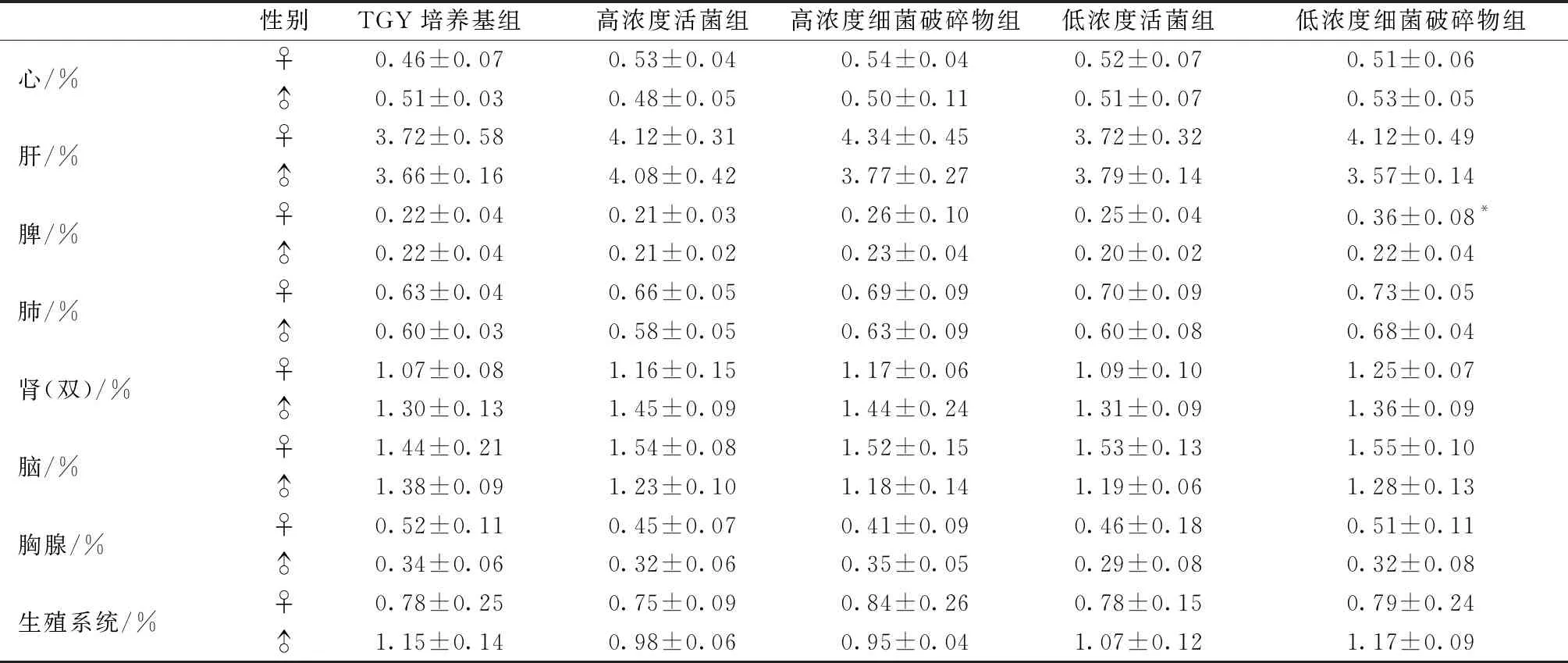
表3 DR及其破碎物灌胃后小鼠的脏器系数
2.2.5DR及其破碎物灌胃小鼠脾脏器病理学变化:脏器系数比较,发现低浓度细菌破碎物组脾脏系数增大,研究组对DR急性毒性实验组补充了脾脏的组织病理,镜检发现:TGY培养基组小鼠脾脏红白髓细胞排列规则,细胞种类未见明显改变,红白髓比例未见明显变化,红髓脾窦内未见红细胞数量增多(图2A1),红白髓边缘区近红髓部细胞种类未见改变(图2A2)。DR灌胃小鼠,低浓度组脾脏未见明显病变,红白髓比例未见明显变化(图2B1、图2C1),红髓脾窦内红细胞数量轻度增加,偶见红髓内静脉轻微扩张(图2B2),白髓中央动脉周围T细胞数量轻微减少,中央动脉周围淋巴鞘细胞数量轻微减少(图2C2);高浓度组偶见红白髓比例发生改变,红髓面积扩大,白髓细胞数量有减少趋势(图2D1、图2E1),局部红髓脾窦内红细胞数量轻微增加,局部红髓内静脉扩张、脾窦轻微水肿(图2D2、图2E2),白髓中央动脉淋巴鞘细胞数量减少(图2D3、图2E3)。DR及其破碎物灌胃组小鼠脾脏红髓的脾窦、脾索,白髓中的动脉周围淋巴鞘、脾小结,白髓周边向红髓移行的边缘区未见实质性病理变化。
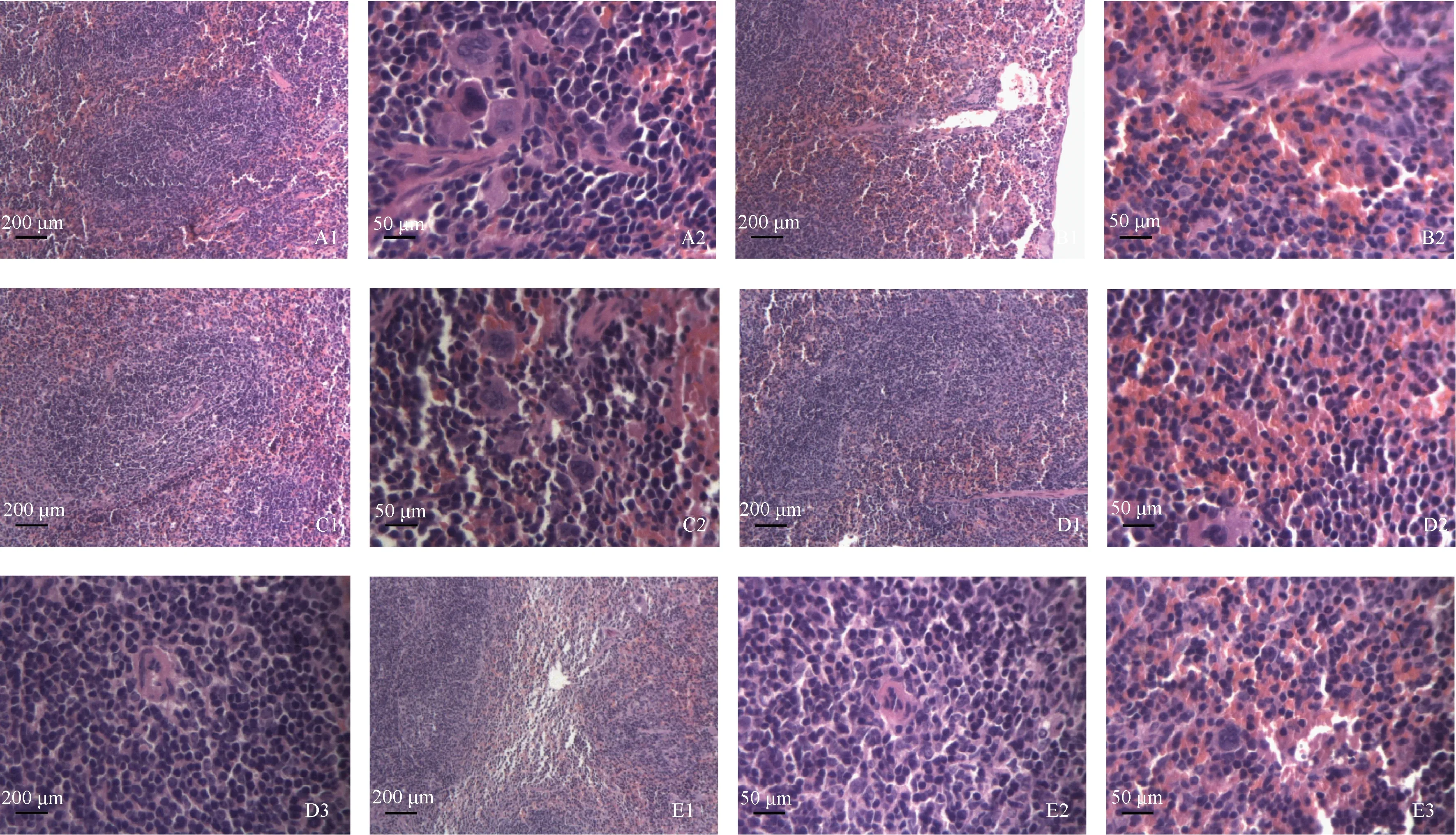
图2 DR活菌及其破碎物灌胃小鼠脾脏病理(HE染色)
3 讨论
急性毒性实验是确定中毒作用方式和中毒反应,为亚急性和慢性毒性实验观察指标及剂量分组提供参考的重要依据,也是新药生物安全评价的重要指标[10]。脏器系数可作为内脏器官损伤的评价标准之一,当脏器系数数值升高,器官出现水肿或充血,脏器系数数值降低,器官出现萎缩或退化[11]。本研究中,DR对小鼠增加体质量及各脏器系数无显著影响,表明DR对小鼠生长影响不大。小鼠血常规及血液生化指标的检测结果,提示DR及其菌体破碎物对小鼠无病理生理上的不良反应。封琼[12]研究表明,在奇球菌属中,DR和D.radiopugnans的类胡萝卜素提取物表现出了最强的抗氧化作用,DR类胡萝卜素可以增加免疫系统中B细胞活力并消灭外源入侵的病原菌,可以提高淋巴T辅助细胞的活力,协助B细胞产生抗体并提高其他免疫组分活性,还可以增加自然杀伤细胞数目,以消除机体内那些被感染的细胞或者癌细胞[13]。本研究结果表明,DR对小鼠增加体质量、脏器系数、血常规及主要脏器相关酶活性及离子浓度无显著影响,低浓度表现出脾脏脏器系数增大,但没有器质性损伤,表现出其潜在的免疫系统促进作用,从而证实了DR为实际无毒菌种。该研究结果与江汉湖等[14]的报道相一致。虽有研究表明益生菌能抑制癌症、肿瘤等的发生,提高机体免疫力,但由于对其作用机理及安全性的研究还不够透彻,所以其作为药品,市场上种类还很少,其主要应用于食品和保健品行业[15]。本研究为推广DR在食品医药卫生上的广泛应用,用小鼠急性毒性实验方法初步验证了DR对于生物体的安全性。

