四氯化碳致大鼠肝纤维化动物模型的文献再评价*
李高辉 吕文良 闫 暾 李娟梅 武庆娟 赵 婷
(1.中国中医科学院广安门医院感染疾病科,北京 100053)(2.北京中医药大学,北京 100029)
肝纤维化是肝脏修复过程中出现的生理病理过程,但是长期致病因素刺激或相关细胞因子缺乏会引起纤维增生而降解相对或绝对不足而导致细胞外基质不断沉积,最终发展成为肝硬化。因此,阻止肝纤维化的进展对慢性肝疾病的治疗至关重要。Popper[1]曾强调指出谁能阻止或延缓肝纤维化的发生,谁就能治愈大多数慢性肝病。随着近年来学科交叉的不断研究深入,肝纤维化过程可以被终止甚至得到逆转[2]的结论不断得到证实。
动物实验能帮助人们了解疾病的发生、发展、转归、预后及指导临床治疗。目前,实验室诱导鼠类肝纤维化模型的主要方法[3-6]有四氯化碳法、硫代乙酰胺法、二甲基亚硝胺法和二乙基亚硝胺法、胆总管结扎法、D-半乳糖胺法、免疫法、乙醇法、营养法、血吸虫法、慢性病毒感染法、复合法等。四氯化碳诱导的肝纤维化动物模型在形态学及病理生理学的某些方面与人肝纤维化相似,如两者均有肝细胞坏死后的再生,实验动物表现的体征及肝功能异常与人慢性肝病进展为肝硬化过程相似[7]。只是在实际的实验过程中,因为缺乏统一的造模标准,造成了模型诱导过程中出现造模不及或太过导致肝硬化,动物过多死亡等问题,影响后续实验的科学性。本文采取文献数据分析的方法对四氯化碳诱导大鼠肝纤维化模型进行分析和再评价。
1 方法
1.1 文献搜集
计算机检索数据库“中国知网、万方数据知识服务平台、维普网”以“四氯化碳”“CCl4”“肝纤维化”“动物模型”为关键字进行文献检索,对文献下方相关参考文献也进行检索,文献发表时间为2015年1月1日—2020年12月31日。
1.2 文献阅读和数据摘录
阅读文献了解实验思路和造模过程,选取相关数据录入Excel表格以备筛选。临床上,肝组织穿刺活检仍是诊断肝纤维化的标准方法[8],因此,在评价造模是否成功时,参考2019年《肝纤维化诊断及治疗共识》,以实验中的肝脏病理切片为主要评价依据,动物最终的肝脏病理组织形成假小叶为重要参考。近年来, 无创伤性的血清学检查方法得到普及,甚至有作者提出肝纤维化血清学检测在特定的条件下可以代替肝组织活检[9]。目前,诊断肝纤维化常用的生化指标有谷丙转氨酶(ALT)、谷草转氨酶(AST)、Ⅲ型前胶原(PCIII)、透明质酸酶(HA)、层黏连蛋白(LN)、Ⅳ型胶原(Ⅳ-C)等。参与肝纤维化的细胞外基质成分,包括胶原蛋白、蛋白多糖及黏连蛋白三大类,PC-Ⅲ、HA、LN分别是这三种细胞外基质成分的代表[10]。因此,摘录文献中有关肝纤维化血清学检测空白对照组和模型组的指标数据。
1.3 排除标准
①排除没有病理切片辅证的文献。②排除四氯化碳与其他方法混合诱导肝脏损伤的文献。③排除动物为非SPF级Wistar或SD大鼠的文献。④排除造模后应用药物干预前没有相关检测数据判断其肝纤维化程度的文献。⑤排除数据用线图表示,不能进行数据挖掘分析的文献。⑥排除综述类文献。
2 检索文献结果
中国知网共检索到文献180篇,万方数据知识服务平台数据库检索到99篇,维普网数据库检索到32篇。去除重复文献,总文献数为141篇。按照“排除标准”排除46篇。
3 数据摘录与处理
文献数据摘录时发现,对肝纤维化判断除病理结果之外,血清学指标差异较大,所以选取检测率高的ALT和AST为血清学评价指标,最终纳入评价范围的文献数量为60篇。应用Excel表格记录文献题目、动物品系、性别、药物作用途径、四氯化碳浓度及剂量、用药频率、动物死亡率、病理检查结果及血清学ALT和AST检验结果。
对病理检查结果依“Ishak”纤维化评分进行打分。分值为1打1分,分值为6打6分。血清血指标计算其“升高率”,对“升高率”进行划档打分,AST升高率:小于1时记2分,在1~2记3分,在2~4记4分,大于4记5分。ALT升高率:小于2记2分,在2~4记3分,在4~6记4分,大于6时记5分。各指标以其在模型评价中的决定程度分别×不同百分比:纤维化评分×40%,AST评分×30%,ALT评分×30%,三个结果之和为该文献模型的最终评分。
4 统计分析
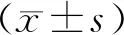

表1 四氯化碳诱导大鼠肝纤维化模型文献统计表
5 结果
5.1 四氯化碳导致肝毒的机制
四氯化碳进入机体后,经肝脏细胞色素P450激活,生成三氯甲基自由基(—CCl3)和三氯甲基过氧自由基(—OOCCl3), 后者可直接损伤质膜,启动脂质过氧化作用,破坏肝细胞的膜性结构等,造成肝细胞变性坏死。国外从20世纪30年代开始使用四氯化碳诱导动物模型,以其操作简便,经济节约,周期较短等优点至今仍作为经典的诱导方法,被科研人员采用。
5.2 动物品系
本文重点搜索Wistar大鼠和SD大鼠诱导模型的文献。纳入评价的文献中采用Wistar大鼠作为模型动物数量为11篇,采用SD大鼠作为模型动物数量为49篇。对雄性Wistar和SD大鼠限定其药物作用途径为“皮下注射”和“腹腔注射”,当“皮下注射”时Wistar大鼠为(3.02±0.48)分,SD大鼠为(3.68±0.66)分(P<0.05),具有统计学意义,平均造模时间为Wistar大鼠6.8周,SD大鼠8.5周。当“腹腔注射”时Wistar大鼠为(4.33±0.58)分,SD大鼠为(3.38±0.50)分(P<0.05),具有统计学意义。平均造模时间为Wistar大鼠6.3周,SD大鼠6.9周,可见Wistar与SD对四氯化碳的敏感性并不相同,Wistar大鼠对于腹腔注射的反应性更加灵敏,而SD大鼠对皮下注射的反应性更好(图1)。
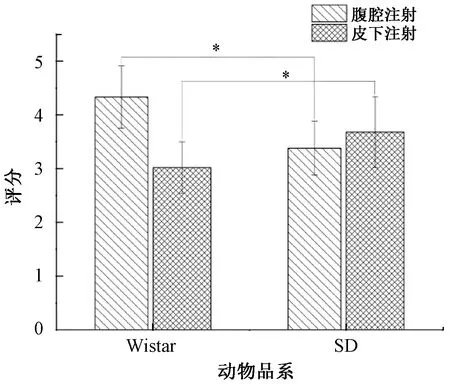
图1 不同品系大鼠对不同注射方式的纤维化评分比较
5.3 药物作用途径
纳入的文献中,诱导方式为腹腔注射的有19例,皮下注射的有32例,灌胃的有7例,灌肠的有1例,另有1例诱导方式不明。比较同类大鼠,对不同的作用途径的差异,限定其性别为“雄性”,四氯化碳浓度为“50%”,选取品系为“SD”,比较“皮下注射”“腹腔注射”“灌胃”之间的差异性。“皮下注射”与“腹腔注射”以及“灌胃”两两比较的结果,均无统计学差异(P>0.05)。其中,“皮下注射”(3.70±0.70)分,造模周期10.5周;“腹腔注射”(3.50±0.50)分,平均周期8.3周;“灌胃”(3.56±0.56)分,造模周期8.8周(图2)。

图2 50%四氯化碳不同用药方式对雄性SD大鼠的造模评分
对于使用高浓度的四氯化碳油剂进行模型诱导时,多采取低剂量、长周期的方式以提高模型诱导的成功率,但是这意味着实验效率会受到一定影响。
5.4 四氯化碳浓度
文献中使用的四氯化碳浓度有20%、40%、50%和60%,限定比较条件为雄性SD大鼠,皮下注射40%四氯化碳油剂,比较40%、50%和60%四氯化碳诱导模型的差异。40%与50%以及60%两两相比(P>0.05),均无统计学差异(图3)。其中,40%(3.71±0.61)分,平均周期8周,50%(3.70±0.92)分,平均周期10.5周,60% 4.00分,平均周期10周。相比40%与50%四氯化碳,二者打分相近,而40%的平均造模时间更短。虽然60%浓度的得分更高,但是相应的耗时也更长。
在实际操作中,当选择不同物种进行肝纤维化模型诱导时,应当首先考虑到物种的差异,并且不能将某一方案死板的套用在不同动物上。当确定实验动物后,然后确定药物作用途径。经过统计计算,各种作用途径之间评分虽然没有明显的差异,但是在实验平均用时方面可以看到不同途径之间的差别。确定作用途径后,选择的四氯化碳浓度则可根据物种和作用途径来决定,用量和周期之间具有相关性,用量越大,相应周期越短。
综合以上数据,对造模周期进行分析,筛选出以下四种四氯化碳诱导大鼠肝纤维化的实验方案:当实验对性别无要求时,推荐选择雄性大鼠作为造模对象,当需要选择不同的品系进行实验,或者对用药途径有要求时可参考表2。
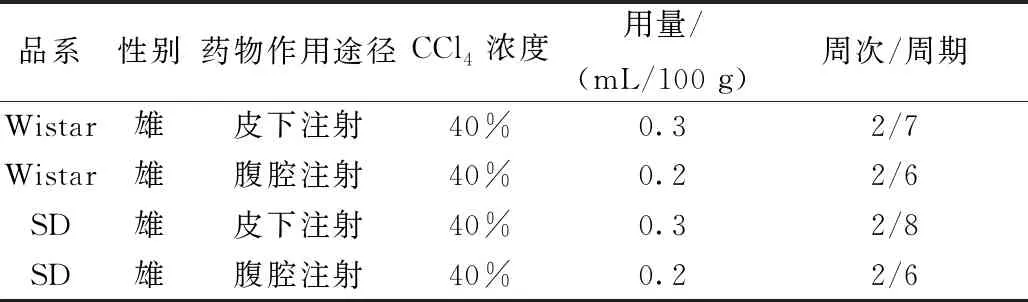
表2 四氯化碳诱导大鼠肝纤维化的最佳实验方案
6 讨论
6.1 一般情况
在模型诱导期间,模型组均会表现出不同程度的毛色无光、饮食量减少、精神萎靡、行动迟缓、尿黄、大便变稀及体质量增长减慢,甚至出现腹水和急性死亡,所以应该严密注意大鼠的行为表现,结合我们在实际进行大鼠肝纤维化模型诱导中的经验,当发现大鼠体质量短期内发生较大变化时,应该予以重视,可能出现急性肝损伤,导致大鼠食欲降低,造模后期同时应该考虑腹水的发生,应对方案为停止对大鼠的继续药物损伤,进一步观察。皮下注射诱导模型时,应该采取轮流注射的方式并注意注射部位的无菌保护,否则容易出现皮毛脱落甚至皮肤溃烂的现象,尤其在夏、冬两季进行实验,更需要保证大鼠环境的无菌和干燥,将饲养环境温度、相对湿度控制在合理范围,避免实验外部因素造成的大鼠死亡。
6.2 动物品系
不同动物对实验因素的敏感性不同,因此,对品系的恰当选择有利于实验设计和结果输出。用于诱导肝纤维化模型的品系有SD大鼠、Wistar 大鼠、C57[71]小鼠、昆明小鼠、ICR[72]小鼠等,而大鼠具有体型大易于操作和观察,采血量多且敏感性高,性格温顺等优点被大多数实验者接受并采用。
6.3 性别因素
目前,研究者多采取雄性大鼠进行模型诱导实验。刘清华等[73]采用皮下注射40%四氯化碳诱导肝纤维化模型,并观察在完整雌性小鼠与切除卵巢的去势小鼠皮下注射0.002% β-Est(17β-雌二醇)产生的影响,检测得到去势+四氯化碳组各项生化指标数据远高于去势组+四氯化碳+雌激素组和对照组;许君望等[74]通过皮下注射400 mL/L 四氯化碳诱导大鼠肝纤维化动物模型,观察雌激素(苯甲酸雌二醇)对大鼠α大平滑肌肌动蛋白表达和对肝脏胶原含量的影响,实验组大鼠肝脏α滑肌肌动表达明显高于对照组和四氯化碳+雌激素组,同时肝组织出炎症、坏死、胶原沉积及假小叶形成,说明雌激素对肝纤维化过程有延缓作用。流行病学数据也显示肝硬化及其并发症在男性中的发病率高于女性,其发病率之比为2.3∶1~2.6∶1[75]。因此,造模过程中应避免雌激素对实验结果的影响而采用雄性实验动物。
6.4 用药途径
目前,采取的四氯化碳用药途径主要有腹腔注射、皮下注射、灌胃及四氯化碳吸入[76-77]。四氯化碳是一种选择性肝毒性物质,能直接损害肝细胞,破坏细胞的各种成份[78]。国内采用四氯化碳吸入造模的报道较少,有国外学者采用此法,10周后仅形成脂肪变性及极少量的肝细胞坏死,且个体差异较大。腹腔注射是采用将四氯化碳油剂直接注射到胃肠到浆膜层以外,经腹膜直接吸收进入门静效率高,皮下注射通常采用的部位是背部皮下和后腿内侧皮肤,皮下注射通过微血管吸收,相比腹腔注射吸收速率慢,因此在注射相同浓度的四氯化碳油剂时,腹腔注射组死亡率更高,但周期更短。灌胃是使用灌胃器直接将四氯化碳灌注到胃里,药液经过门静脉系统吸收,直接进入肝脏,叶霖财等[72]通过实验发现灌胃和腹腔注射的方式均能获得理想的实验结果,其中灌胃死亡率小于10%,而腹腔注射死亡率大于80%,说明灌胃动物耐受性更好;药物注射是实验过程的中心环节,有资料[79]显示腹腔注射的小鼠会出现腹膜、肠壁和腹腔脏器粘连现象,以及因为刺破膀胱,肠道引发感染导致死亡,皮下注射出现皮肤溃烂引发感染,灌胃时因误入气管而导致老鼠死亡,实验中的人为操作因素对实验结果影响较大,这对实验者的操作熟练程度也提出了一定要求。
6.5 四氯化碳用量
大鼠的用药浓度为20%~60%,单次用量0.1~0.3 mL/100 g,频率多为2次/周,造模周期为4~12周。郑君等[80]指出四氯化碳进入体内15 min即可引起肝损伤,48 h达到高峰,随后肝脏进入修复阶段。史智勇等[81]提出采用低剂量、间歇皮下注射的方法以提高动物生存率。张海燕等[82]在比较实验中发现当50%四氯化碳剂量超过2.5 mL/kg时,动物死亡率会升高。我们提出的方案中,考虑到品系的差异性和对不同注射方式的敏感程度,推荐根据研究目的选择实验动物,根据实验操作的熟练程度选择注射方式和用量。
6.6 实验操作
根据以往造模经验,我们总结出四氯化碳诱导肝纤维化的注意事项并建议:①较长的造模周期,大鼠体型不断增大,使大鼠的抓取注射难度增加,我们推荐使用气体麻醉机,这有助于减轻因大鼠挣扎导致的针尖对其脏器的损伤,减轻大鼠痛苦,符合动物伦理学要求。②为了注射计量的准确,通常采用1 mL注射器,但1 mL注射器针头太细易造成油剂阻塞,因此建议采用4.5-5号针头,为了避免交叉感染,应一鼠一针,或者针头用75%乙醇消毒后再用。③采取腹腔注射时,当针头刺入肠道时,回抽会见到黄色浑浊液体进入针管,而造模后期可能出现肝硬化腹水的情况,因此在注射器回抽时见到黄色液体时,应退出注射器,换另一侧注射,若仍然抽出液体,排除因操作不当刺入肠道外,应考虑大鼠肝硬化腹水的发生。④为了避免刺伤肠道,还可以将大鼠皮毛提起,沿提起的皮下与肌肉成30度角进针,感觉落空感,回抽为负压后,再进行注射。⑤皮下注射时,应该采取轮流更换位置的方法,避免对同一区域的重复针刺,并且保证一定的针刺深度,否则四氯化碳油剂容易漏出,影响造模效果。注射完成后可用手按压皮下包块,帮助皮下快速吸收。
6.7 存在问题
在文献的阅读过程中发现,不乏有研究者实验步骤描述不清、使用动物与参考造模文献有差异、诊断肝纤维化描述模糊等问题,均影响到文献的可信度。
理想的肝纤维化病理模型应具有以下优点:①与人类肝纤维化疾病的基本病变特征相似。②病变有一定发展过程,病程发展存在一个可逆与不可逆的阶段性演进过程。③形成率高、病死率低和重复性好。④方法简便易行。⑤动物易获得,经济实用。四氯化碳诱导的动物模型在形态学和病理生理学方面与人类肝纤维化多有相似,有自然恢复的特点。合理规范的运用四氯化碳诱导肝纤维化对科学研究无比重要,希望我们的工作可以为此提供有价值的参考。

