氢吗啡酮对炎性痛大鼠脊髓ERK1/2信号通路的影响*
石晓玲 贾 伟
(湖北省黄石市中心医院普爱院区麻醉科,黄石 435001)
炎性疼痛是一种慢性病理性疼痛,可能通过外伤、手术、肿瘤等引起局部组织炎症损伤,造成病理性疼痛[1]。细胞外调节蛋白激酶(extracellular regulated protein,ERK),包括ERK1和ERK2,统称为ERK1/2,是MAPKs家族主要成员之一,参与细胞编码相关基因和细胞信号转导,在神经系统中的激活与各种疼痛的诱发以及维持都密切相关[2-3]。有研究发现,甲醛注射后脊髓组织神经元中ERK1/2磷酸化水平升高,减少ERK1/2磷酸化水平可对甲醛诱导的炎症性疼痛起一定的抑制作用[4]。氢吗啡酮(hydromorphine,HM)是一种半合成的阿片受体激动药,具有起效快、镇痛作用强、不良反应少等特点[5]。本研究探讨炎性痛大鼠脊髓ERK1/2信号通路的变化及HM的镇痛作用。
1 材料和方法
1.1 材料
1.1.1实验动物:SPF级雄性大鼠30只,8~12周龄,体质量180~240 g,购自斯贝福(北京)实验动物科技有限公司,实验动物生产许可证号:SCXK(京)2016-0002。
1.1.2主要试剂:HM(宜昌人福药业有限责任公司);von Frey纤维毛(IITC);弗氏完全佐剂(CFA)(Sigma);DAB显色试剂盒(上海碧云天生物技术有限公司);TRIzol(Invitrogen);ERK1/2、GAPDH普通PCR上下游引物[生工生物工程(上海)股份有限公司];抗ERK1/2、p-ERK1/2抗体、山羊抗兔二抗(LI-COR);TNF-α、IL-6和IL-10 ELISA试剂盒(南京建成生物工程研究所)。
1.2 建立动物模型及分组
将SPF级雄性大鼠30只,随机分为3组,正常组、模型组和HM组。取20只大鼠,将大鼠麻醉后固定,于右侧足底皮下注射CFA(0.1 mL/只),建立炎性痛大鼠模型。正常组将大鼠麻醉后,于右侧足底皮下注射等量生理盐水。模型组大鼠注射足出现缩足、红肿、舔爪等自发痛行为表示建模成功。模型建立后随机分为两组,HM组:在造模1 d后,腹腔注射0.3 μmol/L HM;模型组:注射等量的生理盐水,连续注射7 d。
1.3 观察指标
1.3.1各组大鼠热痛阈和机械痛阈测定:根据参考文献[6],热痛阈测定:测定大鼠足底部的热痛反应潜伏期,以此表示热痛阈。机械痛阈测定:采用不同标号的von Frey纤维毛测定大鼠反应阈值,von Frey纤维毛垂直刺激后爪足底部,弯曲至近似90°持续5 s。躲避反应包括大鼠后足抬起、延迟放落、抖动及舔食后足或逃避,均被认为阳性。
1.3.2血清及脊髓取材:在注射0.3 μmol/L HM后对全部大鼠进行取材,1%戊巴比妥钠麻醉后,腹主动脉取血,4 000 r/min 离心15 min,取上层血清。取血后暴露心脏,插管灌流固定,先以0.9%氯化钠溶液灌流,再以4%多聚甲醛灌流至四肢僵硬,暴露脊髓后,取出L4~L6损伤侧组织。
1.3.3各组大鼠血清中TNF-α、IL-6和IL-10的含量:ELISA试剂盒方法测定各组大鼠血清中TNF-α、IL-6和IL-10的含量。
1.3.4Western blot检测各组大鼠脊髓中ERK1/2和p-ERK1/2蛋白表达水平:取脊髓组织加入RIPA裂解液裂解后提取总蛋白,行SDS-PAGE凝胶电泳分离,转膜至PVDF膜上,5%脱脂奶粉封闭 1 h,TBST洗膜后加入一抗(1∶1 000稀释),4 ℃孵育过夜,TBST洗膜后再加入辣根过氧化物酶标记的山羊抗兔二抗(1∶2 000稀释),室温孵育1 h后,使用ECL化学发光法检测,于暗室成像拍照,以β-actin为内参,使用Image J分析软件计算各组大鼠中ERK1/2和p-ERK1/2蛋白相对表达水平。
1.3.5qRT-PCR法检测各组大鼠脊髓中ERK1/2 mRNA表达水平:TRIzol法提取脊髓总RNA,酶标仪检测其浓度后将总RNA逆转录获得cDNA,采用实时荧光定量PCR检测各组大鼠脊髓中ERK1/2基因的表达水平。引物设计如下:ERK1/2上游5′-CTCAAGCCTTCCAACCTC-3′,下游5′-TTCCACGGCA CCTTATTT-3′;GAPDH上游5′-GGTGAAGGTCGG TGTCAACGGATT-3′,下游5′-GATGCCAAAGTTGTC ATGGATGACC-3’。反应条件:95 ℃预变性3 min;95 ℃变性30 s,62 ℃退火30 s,72 ℃延伸30 s,共40个循环,最后72 ℃延伸10 min。每组ERK1/2基因的相对表达量按公式(2-△△Ct法)计算,每个样本重复检测3次。
1.4 统计学方法
2 结果
2.1 各组大鼠一般情况
在模型建立时,模型组和HM组大鼠各死亡1只。模型组大鼠注射部位皮肤发生炎症反应,出现红色斑点及肿胀,右后爪收缩抬高;注射HM后,大鼠注射部位皮肤炎症反应减轻,红色斑点及肿胀减少。
2.2 各组大鼠热痛阈和机械痛阈测定
与正常组相比,模型组大鼠右后肢热痛阈显著缩短、机械痛域明显降低(P<0.05),差异均具有统计学意义;与模型组相比,HM组热痛阈显著延长、机械痛域明显升高(P<0.05)。见表1所列。
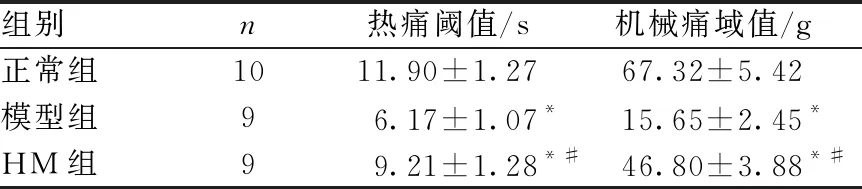
表1 各组大鼠热痛阈和机械痛阈比较
2.3 血清中TNF-α、IL-6和IL-10含量比较
ELISA结果表明,与正常组相比,模型组大鼠血清炎症细胞因子TNF-α和IL-6含量明显增高,IL-10含量明显降低,差异均有统计学意义(P<0.05)。注射HM后,大鼠血清TNF-α和IL-6含量显著降低而IL-10含量显著升高,与模型组比较差异有统计学意义(P<0.05),见表2所列。

表2 各组大鼠血清中TNF-α、IL-6和IL-10含量(μg/L)
2.4 脊髓中ERK1/2和p-ERK1/2蛋白表达水平
与正常组相比,模型组大鼠脊髓中ERK1/2和p-ERK1/2蛋白表达水平显著升高,差异均具有统计学意义(P<0.05);与模型组相比,HM组ERK1/2和p-ERK1/2蛋白表达水平明显降低(P<0.05)。如图1所示。

图1 各组大鼠脊髓中ERK1/2和p-ERK1/2蛋白表达水平
2.5 脊髓中ERK1/2 mRNA表达水平
与正常组相比,模型组大鼠脊髓中ERK1/2 mRNA表达水平显著升高,差异具有统计学意义(P<0.05);与模型组相比,HM组ERK1/2 mRNA表达水平明显降低(P<0.05)。如图2所示。
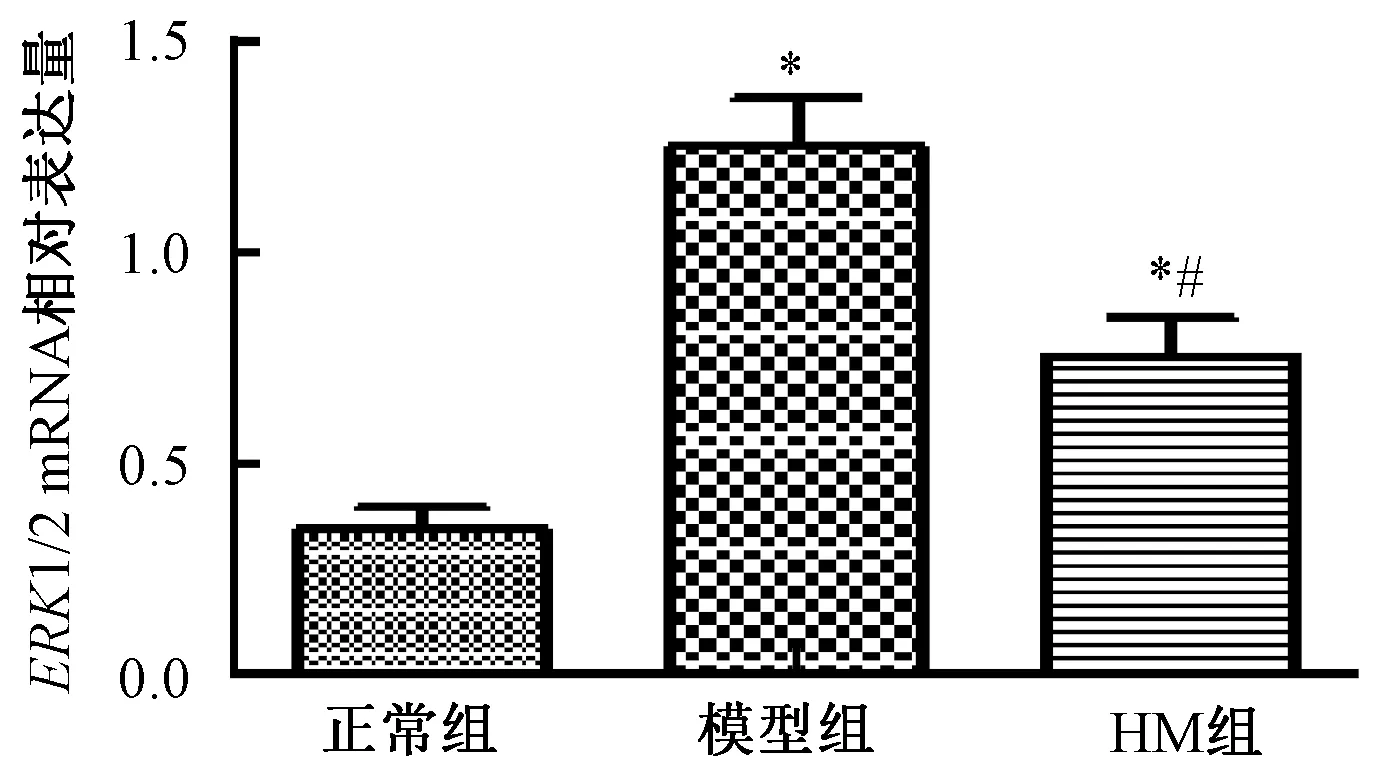
图2 各组大鼠脊髓中ERK1/2 mRNA表达水平
3 讨论
炎性痛广泛存在于各种急慢性疾病进程中,临床主要表现为感觉异常和痛觉过敏,严重影响患者生活质量[7]。当炎性疼痛产生时,伤害性刺激可引起外周组织分泌多种细胞因子,炎性细胞因子在病理性疼痛中起着非常重要的作用,可产生痛觉敏感[8]。眭明红等[9]研究发现,CFA所致的炎性痛动物模型可简单重复并能准确反映炎性痛的临床症状。本研究通过足底注射CFA构建炎性痛模型,发现模型组大鼠注射部位皮肤发生炎症反应,出现红色斑点及肿胀,右后爪收缩抬高;与正常组相比,模型组大鼠术侧后肢热痛阈显著缩短、机械痛域明显降低。ELISA结果显示模型组大鼠血清炎症细胞因子TNF-α和IL-6含量明显增高,提示CFA可明显刺激机体炎性细胞因子的分泌,诱导大鼠建模侧后足热痛敏和机械痛敏。
ERK1/2信号通路的激活会导致疼痛的形成,磷酸化后的ERK可将胞外信号传到核内[10]。有研究发现,ERK信号通路参与了多种疼痛模型(辣椒素或完全弗氏佐剂致炎、内脏痛、电刺激等)[11-12]。在大鼠神经病理性疼痛模型中,脊髓背角和背根神经节ERK1/2磷酸化水平升高,参与坐骨神经慢性压迫模型大鼠的痛敏调节[13]。本研究结果发现,模型组大鼠脊髓中ERK1/2 mRNA表达水平及ERK1/2和p-ERK1/2蛋白表达水平均显著升高,提示炎性痛大鼠ERK1/2信号通路被激活。
氢吗啡酮是一种比吗啡更有效的阿片受体激动剂,已经广泛用于急慢性疼痛的治疗[14]。牛富国等[15]研究发现,HM能够减少剖宫产术后产妇血清中疼痛物质、炎性因子和应激激素的释放,从而发挥镇痛作用。本研究在造模1 d后腹腔注射HM,结果显示大鼠注射部位皮肤炎症反应减轻,红色斑点及肿胀减少;与模型组相比,HM组大鼠血清TNF-α和IL-6含量显著降低而IL-10含量显著升高,且热痛阈显著延长及机械痛域明显升高;注射HM后,大鼠脊髓中ERK1/2 mRNA表达水平及ERK1/2和p-ERK1/2蛋白表达水平均显著降低,提示HM可有效地抑制大鼠机体炎症水平,降低痛觉敏感强度,并能够降低ERK1/2蛋白磷酸化水平,从而抑制ERK1/2信号通路的活化,可能是其改善大鼠炎症痛的作用机制。
综上所述,HM可有效改善CFA诱导的大鼠炎性疼痛,其抗炎镇痛机制与降低大鼠机体炎性因子的产生并抑制ERK1/2信号通路的活化有关。

