二乙基亚硝胺诱导小鼠肝纤维化动态模型的建立及病理机制初探*
王明亮 彭蕴茹
(南京中医药大学附属中西医结合医院,江苏省中医药研究院,南京 210028)
脏器在纤维化进程中易出现组织重塑现象,常导致脏器功能异常,发病率较高,且与疾病死亡率高相关[1]。据统计,在发展中国家,与脏器纤维化相关的死亡高达45%[2]。其中,肝纤维化也是一个重要的全球健康问题,该因素导致的死亡人数每年达100多万[3-4]。肝组织损伤后,在组织修复过程中大量细胞外基质(extracellular matrix,ECM)的异常累积,能够引起桥接性肝纤维化、肝硬化甚至肝癌,导致患者存活率显著下降。基础临床研究发现肝纤维化具有可逆性,但目前肝纤维化的临床治疗药物十分有限,且疗效不理想。因此,临床迫切地需要疗效明确的抗肝纤维化治疗药物[3,5-6]。要克服这一挑战的潜在策略是研发针对肝纤维化疾病共有的核心病理生理学相关性的机制或核心通路的药物,提高早期肝纤维化诊断的准确性,进而降低治疗的难度与花费。本研究希望通过构建啮齿动物肝纤维化动态模型,探索肝纤维化发生发展的特点及内在发病机制,为进一步研发肝纤维治疗药物及提高肝纤维化早期诊断提供参考。
肝纤维化的发病机制是一个多因素诱导、多细胞参与、多靶点共同作用的复杂生理过程,涉及炎症、氧化应激、糖脂代谢等复杂的体内过程。慢性肝病发展为纤维化多与慢性炎症诱导产生的瘢痕组织相关,因此,研究炎症和纤维化发病机制的内在联系对肝纤维化的治疗至关重要。近期临床研究发现肝硬化患者体内内毒素水平显著上升,且即使在生理条件下,肝脏也始终暴露于来自食物、化学物质、药物和肠道微生物群的外源蛋白[7]。肝硬化与由内毒素脂多糖(lipopolysaccharide,LPS)激活的炎症通路Toll样受体4(Toll-like receptor 4,TLR4)信号通路的相关性也丞待深入探索。传统研究中采用四氯化碳(CCl4)或胆管结扎(bile duct ligature,BDL)诱导建立肝纤维化模型,其中CCl4诱导的肝硬化在很大程度上反映了氧化应激引起的脂质过氧化和质膜损伤[8]。啮齿动物进行BDL手术可导致急性胆汁淤积和管道反应,炎症和促纤维化信号上调,故而BDL更加适用于研究术后急性胆汁淤积或肝损伤[9-10]。DEN是一种致癌剂,且具有明显的肝靶向性,其所诱发肝病与临床患者肝纤维化的病理表现、基因表型十分相似[11-12]。此外,由于生理性的雌性激素也能对炎症有一定的抑制作用,而雄性更易于发生与免疫相关的并发症,诱发炎症损伤[13]。因此,为方便探究肝纤维化的发生发展进程及发病机制,本研究采用DEN诱导雄性小鼠肝纤维化,并通过动态观察,研究肝纤维化不同发展阶段的变化,从而进一步探究DEN诱导肝纤维化的发病机制与TLR4/MyD88/NF-κB信号通路的相关性。
1 材料和方法
1.1 实验动物
SPF级雄性C57BL/6小鼠,体质量18~22 g,35只,购自上海斯莱克实验动物有限公司,实验动物生产许可证号:SCXK(沪)2017-0005,实验动物合格证号:20170005011477。本研究获得江苏省中医药研究院动物实验伦理委员会批准,审批号:AEWC-20180712-37,饲养于江苏省中医药研究院动物中心,实验动物使用许可证号:SYXK(苏)2016-0018。饲养条件:每笼5只小鼠,自由饮水饮食[饲料由仪征安立卯生物科技有限公司提供,苏饲证(2019)10033],于恒定的环境温度20~25 ℃和相对湿度50%~60%下饲养,光照周期为12 h/12 h。适应性饲养一周后开展实验。
1.2 主要试剂及仪器
1.2.1试剂:DEN,分子式:C4H10N2O,相对分子质量:102.14,含量0.95 g/mL,产品编号:O49K1613V,购自Sigma;羟脯氨酸试剂盒(20190927),购自南京建成生物工程研究所:一抗TGF-β(ab92486)、MyD88(ab2064)和Lamin B(ab133741),购自Abcam;α-SMA (19245)、NF-κB p65(8242)和 GAPDH(2118),购自Cell Signaling;TLR4(GTX75742,GeneTex);BCA 蛋白含量检测试剂盒(KGPBCA),购自江苏凯基生物技术股份有限公司;广谱蛋白Marker(MAN0011772),购自Thermo;山羊抗兔IgG(BL003A)和山羊抗鼠IgG(BL001A)购自Biosharp;Western一抗稀释液(P0023A)、特超敏ECL化学发光试剂盒(P0018A)和细胞核蛋白与细细胞质蛋白抽提试剂盒(070219200429)均购自上海碧云天生物技术有限公司。
1.2.2仪器: 全自动生化分析仪(C8000 Roche, Hoffmann-La Roche Inc);DMi8倒置光学显微镜(Leica);高速低温离心机(Beckman);BT125D电子分析天平(sartorius);高速低温离心机(Beckman);蛋白电泳与转移仪(Bio-rad);天能5200凝胶成像系统(Tanon)。
1.3 方法
1.3.1实验设计:根据体质量将35只小鼠,随机分为模型组(25只)和对照组(10只)。模型组小鼠,连续8周,每周2次腹腔注射(i.p)DEN,梯度给药:30 mg/kg(1~2周)、35 mg/kg(3~4周)、40 mg/kg(5~6周)和42.5 mg/kg(7~8周)。对照组处理方法与模型组相同,取等容积0.9%生理盐水代替DEN。每周记录小鼠体质量,实验进度安排如图1所示。为监测肝脏纤维化形成过程,每2周处死并收集5只模型组小鼠血清和肝脏,进行动态肝功能检测、肝脏羟脯氨酸含量测定及肝组织病理学检查。全部给药结束后第2天处死所有存活小鼠(模型组10只,对照组10只),取肝组织称质量,部分固定于4%多聚甲醛中,进行组织病理学检查。其余部分储存在-80 ℃中,进行后续的肝脏羟脯氨酸含量检测(hydroxyproline,Hyp)、Western blot检测纤维化相关蛋白及TLR4信号通路相关蛋白。
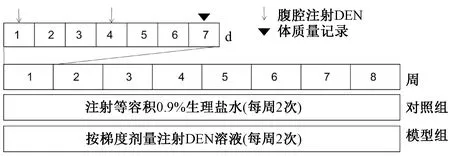
图1 实验安排
1.3.2检测肝功能相关血清生化指标:采用异氟烷麻醉动物后,通过摘眼球采血,静置2.5 h左右,以4 ℃、3 000 r/min离心15 min,获得血清。使用全自动生化分析仪检测血清中丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,ALP)、总胆红素(total bilirubin,T-BIL)、乳酸脱氢酶(lactic dehydrogenase,LDH)、总胆固醇(total cholesterol,T-CHO)、甘油三酯(triglyceride,TG)、白蛋白(albumin,ALB)和球蛋白(globulin,GLO)水平。
1.3.3脏器指数和肝组织羟脯氨酸含量检测:处死小鼠后,取肝脏称质量,计算脏器指数,观察小鼠脏器质量的变化:脏器指数=(肝脏质量/体质量)×100%。为考察小鼠肝脏胶原蛋白沉积的情况,通过检测肝脏胶原蛋白的主要成分羟脯氨酸来进行定量,称取肝脏50~80 mg,根据羟脯氨酸检测试剂盒说明书,采用碱水解法测定肝组织中羟脯氨酸的含量。
1.3.4HE和Masson染色观察肝组织病理变化:将固定在4%多聚甲醛的肝组织进行脱水-透明-包埋-切片-脱蜡-复水-染色的步骤,对切片组织采用苏木素-伊红染色(HE)和Masson染色后,在显微镜下观察肝组织结构变化。由两名病理专家对肝炎症及损伤程度(HE染色根据组织结构完整性、炎症浸润及细胞坏死程度按照I0~3等级)以及肝纤维化水平(Masson染色根据METAVIR评分标准按照F0~4等级)按照量化表进行评分。
1.3.5Western blot检测肝脏中TGF-β、α-SMA 及TLR4/MyD88/NF-κB信号通路相关蛋白:按照1 mg肝组织加10 μL RIPA裂解缓冲液(含有1 mmol/L PMSF)在冰水上对肝组织进行匀浆,在4 ℃、12 000 r/min离心5 min后,取上清液。使用BCA试剂盒对上清液中蛋白进行定量。通过8%或10% SDS-PAGE电泳分离等量(40 μg)蛋白,并转移至PVDF膜上,以5%脱脂牛奶封闭1 h,4 ℃下与一抗TGF-β(1∶1 000)、α-SMA(1∶1 000)、TLR4(1∶500)、MyD88(1∶1 000)及NF-κB(1∶1 000)孵育过夜,洗膜三遍再与相应二抗[山羊抗兔 IgG(1∶4 000)或山羊抗小鼠 IgG(1∶4 000)],室温孵育1 h。使用ECL显影液及成像仪获得蛋白条带用Tanon-5200 Annlyzer软件定量每个蛋白条带的灰度值,与相应的内参蛋白:GAPDH或Lamin B对比,表示目的蛋白的相对表达量。
1.4 统计学处理
2 结果
2.1 一般观察
在梯度注射8周DEN后,未出现小鼠死亡。造模组小鼠,第3周出现烦躁易怒,第5周反应迟钝,第7周精神萎靡。在8周内,除初始体质量外,模型组小鼠体质量始终低于对照组小鼠(第1周,P<0.05;第2~8周,P<0.01),这与临床患者患病时,出现暴瘦相似。各组小鼠8周内平均体质量变化,如图2所示。
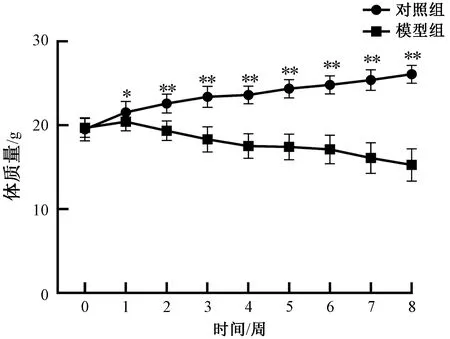
图2 小鼠生长曲线变化
2.2 血清生化指标监测
模型组小鼠血清转氨酶水平(ALT及AST)分别在第4周及第6周显著高于对照组(P<0.01),转氨酶水平升高是临床上无症状肝病最常见的表现之一,表明DEN处理后小鼠肝组织出现损伤。模型组小鼠血清中T-BIL于第4周开始显著高于对照组(P<0.01),模型组ALP水平则于第2周开始显著高于对照组(P<0.01),表明模型组小鼠肝功能第4周后受损明显,且与临床上肝病初期表现为胆红素与ALP显著升高相似(临床症状为胆汁淤积伴随黄疸/瘙痒)。LDH于第6周显著高于对照组(P<0.01),表明小鼠在第6周时有进入肝硬化的风险。T-CHO显著降低(P<0.01)表明肝脏可能位于肝炎或肝硬化阶段,导致胆汁分泌减少,进而引起脂肪吸收减少,出现一定营养不良诱发小鼠体质量显著下降,最终导致血清中甘油三酯水平下降。ALB在肝脏中合成,肝功能受损严重时,白蛋白合成减少,球蛋白则由于免疫反应有所升高,这是A/G显著下降的原因(P<0.01),也表明肝功能显著受损。由血清中生化指标可以看出模型组小鼠在DEN处理4周后出现明显肝损伤,可能于第6周出现明显肝纤维化特征,如图3A~图3G所示。
2.3 肝脏脏器指数及羟脯氨酸含量监测
模型组小鼠肝脏脏器指数(图4A)从第4周开始显著低于对照组,可能由于小鼠体质量显著下降,有一定程度的营养不良,导致肝脏指数显著下降。羟脯氨酸是胶原蛋白中含量最高的成分,也是组织纤维化时沉积的细胞外基质主要成分之一,模型组小鼠肝组织中羟脯氨酸含量于第4周显著高于对照组(P<0.01),表明造模小鼠从第4周开始肝脏出现明显的胶原沉积,如图4所示。

图4 DEN对肝脏的影响
2.4 组织病理学检测
在显微镜下观察发现,对照组肝窦结构正常,肝细胞形态正常、排列整齐,呈现正常完整肝小叶结构。第2周时,造模小鼠肝组织出现少量炎症细胞浸润;第4周时,肝组织出现少量胶原沉积;第6周时,炎症细胞浸润明显,胶原沉积明显,肝小叶结构紊乱;第8周时,模型小鼠肝组织出现大量纤维组织增生及穿插,将肝组织分割为大小不等的假小叶,胶原主要沉积于淋巴管周围,纤维化周围出现出血性坏死,伴随淋巴细胞浸润,病理结果如图5所示。DEN注射后,肝脏炎症损伤评分见表1 所列,纤维化评分见表2所列;与对照组相比,差异均极显著(P<0.01)。病理检查结果表明,DEN造模小鼠的肝纤维化发病进程最初表现为少量炎症细胞浸润,进而造成炎症损伤导致胶原分泌增加,出现假小叶结构,最终造成肝硬化。
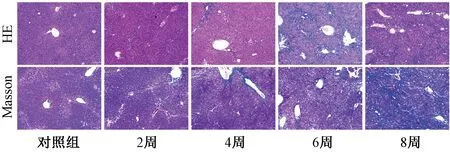
图5 DEN对小鼠肝组织病理变化的影响(×100)

表1 通过METAVIR评分系统统计分析DEN诱导的小鼠肝脏炎症分期
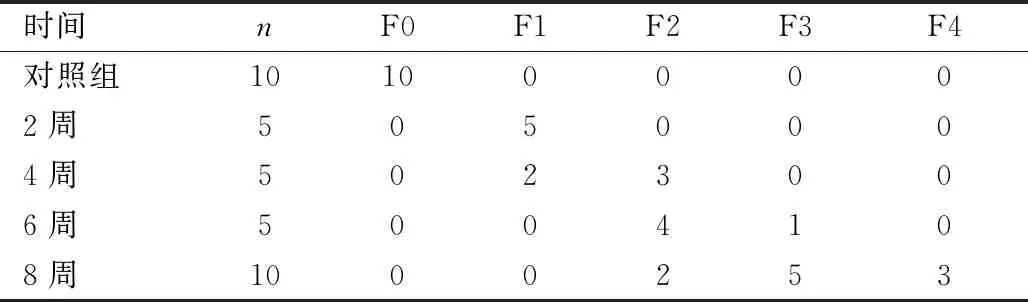
表2 通过METAVIR评分系统统计分析DEN诱导的小鼠肝脏纤维化分期
2.5 肝组织TGF-β1及α-SMA表达
TGF-β1作为一个促进纤维化因子,在肝组织的炎症及纤维化阶段扮演着十分重要的角色,具有促进成纤维细胞生长、刺激胶原生成并抑制ECM降解的作用。肝星状细胞(hepatic stellate cell,HSC)的激活是肝纤维化的关键环节,HSC在肝损伤后被激活并转化为肌成纤维细胞的标志则是α-SMA的显著上调。在注射DEN后,模型小鼠肝组织中TGF-β1与α-SMA的表达均显著上调(图6),表明HSC被激活。结果表明,DEN可激活小鼠肝组织中HSC,转化为肌成纤维细胞,并在TGF-β1的作用下进一步增殖、分泌ECM(图4B),最终促进肝脏纤维化的发展。

图6 DEN诱导小鼠肝纤维化模型对TGF-β1 和 α-SMA的影响
2.6 TLR4/MyD88/NF-κB信号通路检测
Western blot检测发现,与对照组相比,模型组小鼠肝组织中TLR4及其下游通路蛋白MyD88和TRAF6表达量均有所上升,且NF-κB p65在细胞质中表达下调,而在细胞核中的表达水平上调(图7A、图7B)。结果表明,DEN诱导的小鼠肝损伤与TLR4信号通路激活密切相关,且通过TLRs的配体MyD88进一步诱使NF-κB p65进入细胞核激活炎症反应。

图7 DEN诱导小鼠肝纤维化对TLR4信号通路表达的影响
3 讨论
本研究建立了实验性小鼠肝纤维化动态模型,复制了慢性病患者纤维化进展的特征。研究发现DEN诱导肝纤维化可能与激活TLR4/NF-κB信号通路后炎症因子、趋化因子及炎症介质等表达上调相关。由炎症信号诱发肝脏炎症导致肝细胞损伤,进而激活HSC,促进纤维化的发展,表明TLR4信号通路可能与DEN诱导小鼠肝纤维化相关(图8)。
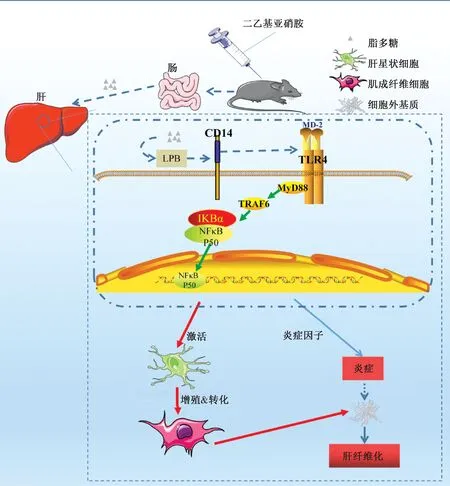
图8 二乙基亚硝胺诱导肝纤维化的分子机制
目前,大部分学术观点认为肝纤维化是可逆的,但临床上肝纤维化治疗方法和疗效有限[14-15]。临床上肝硬化常通过肝活检确诊,而肝活检是侵入性的、昂贵的检测方法,且可能由于取样错误而造成误诊并造成严重内出血导致死亡(发生率:1.1%~1.6%)[16-17]。此外,组织病理学分期是描述性的半定量分类,用于评估肝结构和肝纤维化,但不提供肝纤维化的定量评估。分配到组织学阶段的数字与它们之间没有定量关系,即METAVIR纤维化阶段2并不意味着两倍的纤维化阶段1[17]。因此,非侵入性纤维化标志物和定量评估纤维化,可能是理想的开发和验证方向。通过血清标志物诊断纤维化高风险患者,或提高以血清指标进行诊断的准确性,以及进一步确立纤维化评分标准等均是利于肝纤维化的早期诊断、干预及防治。本研究通过动态监测血清生化指标并对肝纤维化阶段进行相应的推断,也是对肝纤维化诊断方法的优化(表3);而单一生化指标的变化仅能提示相关纤维化风险,而不能对纤维化阶段进行准确评估,结合多项生化指标对中晚期肝纤维化的预测具有一定可行性。其中,AST、ALT、T-BIL、ALB、A/G等已有研究报道其对酒精性肝病、非酒精性脂肪肝以及糖尿病诱发的肝病的检测作用[17]。此外,进入肝硬化阶段需警惕肝硬化相关并发症,如肝硬化并发急性肾损伤等[5]。虽然血清检测尚未被证明能准确反映治疗后纤维化的变化,这限制了它们在疾病监测中的作用。近期研究表明,脂质体、蛋白质组和肠道微生物组谱以及micro RNA标记等技术在纤维化评估中具有巨大的潜力[5, 18-19]。小鼠血样少,可检测指标相对较少,需要进一步实验以对生化指标进行更充足的监测及充分利用以分析纤维化阶段,血清中肝纤维化标志物也是进一步研究的重点所在。目前,转基因小鼠较易获得,小鼠疾病模型的建立有助于进行基因敲除治疗,这是小鼠的优势所在。本研究建立了小鼠肝纤维化动态模型,为进一步对研究肝纤维化的发生发展机制,以及治疗药物筛选等提供了数据基础。

表3 血清生化指标与肝纤维化的相关性
肝纤维化是由多因素诱导、多细胞参与的过程:由病毒性肝炎、酒精性肝病、非酒精性脂肪肝、代谢性疾病、肝外科手术或肝移植、药物毒性、致癌试剂等因素引起的肝组织细胞坏死、缺氧、免疫应答、氧化应激等反应造成长期的肝脏损伤,进而激活HSC、枯否细胞、树突状细胞引起炎症诱发肝纤维化[20-23]。伍振辉等[24]研究结果表明,肝纤维化过程中的关键角色HSC是通过激活TLR4/NF-κB信号通路激活HSC,促进TGF-β1的分泌也能激活HSC转化为肌成纤维细胞并促进其增殖。TLR4受体使细胞识别革兰氏阴性细菌产生的内毒素,从而启动病原相关分子模式(pathogen-associated molecular patterns,PAMP),而肝脏由于长期处于肠道菌群分泌的内毒素环境中易产生免疫耐受,本研究中TLR4在肝组织中表达显著上升也可能是肝病发展过程中打破肝脏免疫耐受的原因[25-26]。由于组织中持续损伤、炎症细胞浸润以及持续分泌TGF-β1,使得HSC的激活和ECM的沉积(导致组织重塑)成为一个慢性的、不可控的过程。ECM蛋白的不断沉积增加了组织的硬度并损害营养物质和氧的扩散,进一步促进细胞损伤和肌成纤维细胞活性,导致损伤的恶性循环,维持肝纤维化(特别是晚期肝纤维化)并促进其持续进展。由DEN梯度给药建立的小鼠动态模型可应用于炎症相关的肝纤维化研究。
综上所述,由DEN诱导肝纤维化模型,造模时间较短,纤维化结果稳定,且死亡率低,可动态监测纤维化发展,是值得研究的炎症相关肝纤维化模型。注射DEN后,通过检测肝损伤、炎症、肝纤维化相关指标,表明DEN诱导肝纤维化的发生,其机制可能是通过TLR4/MyD88/NF-κB信号通路激发炎症造成损伤,进一步诱导肝纤维化的发生。此外,可结合多项生化指标初步预测肝纤维化阶段。

