中性粒细胞胞外诱捕网增加糖尿病小鼠对侵袭性曲霉病的易感性
许向华 夏初 黄怡
侵袭性曲霉病是一种严重的真菌病,烟曲霉是最常见的病原体,肺部是最常见的感染部位[1-2]。侵袭性曲霉病常由多种因素诱发,造血干细胞移植、恶性血液病和粒细胞缺乏是其主要高危因素[3],近年来研究发现,无高危因素的侵袭性曲霉病逐渐增多[4]。2010年Gangneux等[5]报道30%~50%的侵袭性曲霉病发生于非粒细胞缺乏患者;2019年Chakrabarti等[2]发现超过60%的侵袭性曲霉病患者无高危因素,且预后不良,死亡率超过70%;表明非高危因素在侵袭性曲霉病中的作用也应受到重视。糖尿病是侵袭性曲霉病的非高危因素之一,高达28.9%~30.9%的侵袭性曲霉病患者患有糖尿病[1-2],其机制尚不清楚。中性粒细胞胞外诱捕网(NETs)是由中性粒细胞释放的覆盖着组蛋白和抗菌蛋白的DNA网状结构,中性粒细胞通过一个称为NETosis的过程来释放NETs。NETs既是中性粒细胞的一种杀菌工具,也是一种炎症介质,与多种疾病的发生发展相关[6]。烟曲霉感染时糖尿病患者中性粒细胞释放NETs情况及其作用目前尚不清楚,推测可能存在NETs释放异常,且这种异常可能与糖尿病患者对侵袭性曲霉病的易感性增加有关。因此,我们建立了2型糖尿病(T2DM)和侵袭性曲霉病小鼠模型,比较发生侵袭性曲霉病时糖尿病小鼠和无糖尿病对照小鼠的易感性和中性粒细胞释放NETs的情况,旨在探讨NETs在糖尿病患者发生侵袭性曲霉病时所起的作用,以期在糖尿病患者中预防侵袭性曲霉病的发生或改善侵袭性曲霉病的治疗效果。
材料与方法
1.材料
(1)动物:5周龄雄性C57BL/6小鼠,体质量为(18±2)g,购自斯莱克实验动物有限责任公司(上海),按照《实验动物的管理和使用指南(第八版)》[7]的标准饲养管理动物,在暴露前适应7天。采用随机数字法将48只小鼠分为糖尿病组和对照组,每组各24只。其中,真菌负荷实验中两组各处死15只;炎症因子检测时两组各处死3只;肺组织病理和NETs检测时两组各处死3只;中性粒细胞分离实验中两组各处死3只。
(2)烟曲霉菌株:表达绿色荧光蛋白的烟曲霉菌株(ATCC13703)由美国科罗拉多大学健康科学中心Nancy Madinger博士赠送。
(3)其他材料:高脂(提供60%的能量)饲料和低脂(提供10%的能量)饲料购自Research Diets公司(美国),链脲佐菌素(STZ)购自Sigma-Aldrich公司(美国),RPMI 1640培养基购自Gibco公司(美国),Sabouraud培养基、Sabouraud液体培养基和Tween-80购自Sigma-Aldrich公司(美国),小鼠外周血中性粒细胞分离液试剂盒购自Miltenyi Biotec公司(德国),小鼠肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β)酶联免疫吸附试验(ELISA)试剂盒购自R&D公司(美国),Anti-Ly6G抗体[RB6-8C5]异硫氰酸荧光素(FITC)和组蛋白3(H3)一抗Anti-Histone H3抗体购自Abcam公司(英国),H3二抗DyLight549 goat anti-rabbit IgG[H+L]购自联科生物(中国),二脒基苯基吲哚(DAPI)、二甲氧唑黄(XTT)和吩嗪硫酸甲酯(PMS)购自Sigma-Aldrich公司(美国),Triton X-100购自生工公司(中国)。本研究经我院伦理委员会审批通过。
2.方法
(1)T2DM小鼠模型建立:参考文献[8],用高脂饲料饲养糖尿病组小鼠4周后,每天腹腔注射40 mg/kg体重的STZ,连续5天。STZ注射结束1周后,测定非空腹血糖≥250 mg/dl诊断为糖尿病[9]。对照组小鼠喂食低脂饲料,以相同剂量的柠檬酸钠缓冲液代替STZ注射。两组在注射完成2周后进行烟曲霉感染。
(2)烟曲霉感染:烟曲霉孢子悬液的制备参考文献[10]并略加修改:孢子接种于Sabouraud培养基上培养,当菌苔铺满培养基时,用含0.1% Tween-80的磷酸盐缓冲液(PBS)冲洗,过滤去除菌丝,孢子重悬在PBS中,调整孢子悬液浓度为5×107/ml备用。菌丝悬液制备参考文献[11]并略加修改:在Sabouraud液体培养基中培养烟曲霉孢子(1×106cfu/ml)16~24小时,收集菌丝,PBS冲洗后用超声破碎法将菌丝打碎成10~100 μm碎片,配制的菌丝碎片浓度为1×106cfu/ml。采用滴鼻法感染烟曲霉孢子,参照文献[12]并加以修改:将小鼠用乙醚麻醉后保持直立状,用移液器吸取20 μl浓度为5×107/ml的烟曲霉孢子悬液,从鼻孔慢慢滴入。孢子悬液滴入2小时后,参照文献[11]的方法,通过口咽灌注法注入菌丝悬液,每只小鼠1×104cfu。
(3)组织学检查:参考文献[12]的方法解剖和固定小鼠肺组织,固定好的肺组织用石蜡包埋,组织切片,采用苏木素-伊红(HE)染色评估炎症反应。
(4)中性粒细胞分离和培养:采用心腔内穿刺法采集循环血[13]。以小鼠外周血中性粒细胞分离液试剂盒纯化中性粒细胞。用RPMI 1640培养基重悬细胞,于37 ℃、含5%CO2培养箱中进行培养。
(5)真菌负荷检测:无菌条件下取小鼠右肺上、中、下固定位置的组织20 mg,加入200 μl生理盐水研磨破碎,制成10倍稀释系列1×10、1×102和1×103稀释度悬液,从各稀释度悬液分别取100 μl接种于Sabouraud培养基上,每浓度3块平皿,置于霉菌培养箱中26.5 ℃培养7天。根据培养基上菌落数计算悬液中曲霉菌落数:菌落数/ml=(各稀释度3个平皿中菌落平均数×稀释倍数之和)/3。
(6)细胞因子检测:使用小鼠ELISA试剂盒测量组织裂解液中的TNF-α和IL-1β含量,按照说明书进行操作。
(7)NETs检测:采用免疫荧光染色激光共聚焦显微镜检测NETs。Anti-Ly6G抗体用于标记粒细胞;H3一抗和二抗用于标记H3;DAPI用于DNA染色。细胞外H3和DAPI共定位代表NETs,根据细胞外H3的阳性率比较NETs含量。NETs的检测参照文献[11]并略加修改。肺组织NETs检测方法:标本脱蜡,水化,抗原修复;封闭1小时;孵育Ly6G抗体和H3一抗,4 ℃过夜;孵育H3二抗2小时;DAPI染色;封片剂封片。中性粒细胞NETs检测:在灭菌的12孔板中铺上爬片,新鲜分离的中性粒细胞接种于爬片上(1×104个细胞/孔,每组3个孔),孵育1小时后加入菌丝(中性粒细胞与菌丝比例为10 ∶1),置于5%CO2培养箱中37 ℃培养6小时;PBS漂洗;4%多聚甲醛和0.5%Triton X-100处理;孵育Ly6G抗体和H3一抗,4 ℃过夜;孵育H3二抗2小时;DAPI染色;封片剂封片。激光共聚焦显微镜(Leica)下检查分析拍照。采用ImageJ软件进行图片灰度扫描,得出Ly6G及H3的阳性率。
(8)菌丝活力检测:参照文献[14]并略加修改,采用XTT还原法检测烟曲霉菌丝活力。菌丝和中性粒细胞共孵育于96孔板中。终止孵育前用H2O/NaOH(pH 11.0)裂解中性粒细胞。随后用20 μl的XTT/PMS孵育菌丝2小时。吸取上清液,用酶标仪(Thermo,中国)在450 nm处测光密度(OD)值。

结 果
1.两组小鼠真菌负荷比较:在烟曲霉感染后24小时、72小时、120小时,两组分别处死5只小鼠,检测肺组织真菌负荷,结果显示,对照组在感染后24小时[(1 722±184) cfu]、72小时[(2 814±269) cfu]呈高负荷状态,至120小时[(1 232±301)cfu]显著降低;糖尿病组小鼠在感染后真菌负荷逐渐增高,持续保持在高负荷状态[24小时:(1 770±161) cfu,72小时:(4 248±677) cfu;120小时:(5 089±710) cfu],72小时和120小时时均明显高于对照组同一时间(P<0.01)。在感染后第5天荧光显微镜下观察结果示,糖尿病组小鼠肺组织可见菌丝,而对照组小鼠罕见,见图1。
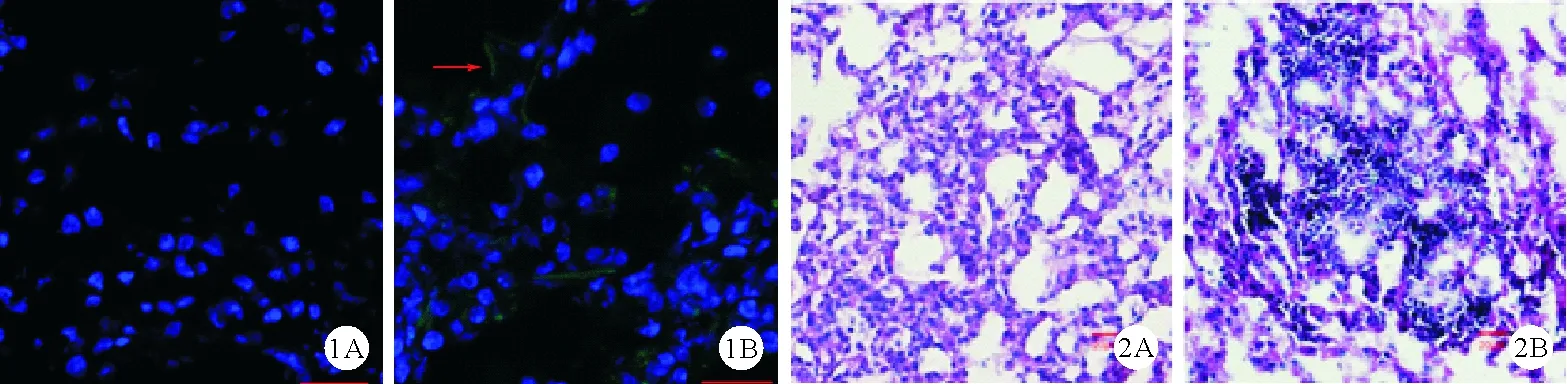
图1 两组小鼠感染烟曲霉后第5天肺组织荧光显微镜下观察结果:糖尿病组小鼠肺组织仍可见表达绿色荧光蛋白的菌丝(如箭头所示),而对照组小鼠罕见(A:对照组,B:糖尿病组;×200) 图2 两组小鼠感染后48小时肺组织病理检查结果(A:对照组,B:糖尿病组;HE染色,×200)
2.两组小鼠炎症病变程度比较:烟曲霉感染后24小时,糖尿病组小鼠IL-1β水平明显高于对照组[(52.32±5.94)pg/ml比(29.28±5.95)pg/ml,P<0.05],TNF-α水平与对照组比较差异无统计学意义[(130.37±12.91)pg/ml比(109.71±18.81)pg/ml,P>0.05]。感染后48小时,两组小鼠肺组织病理检查结果显示,对照组小鼠病变区域肺组织结构完整,肺泡间隔水肿增宽,有较多中性粒细胞和其他炎症细胞浸润;糖尿病小鼠病变区域有大量的中性粒细胞和其他炎症细胞浸润,肺泡间隔明显水肿增宽,肺泡腔明显缩小,见图2。
3.两组小鼠肺组织NETs比较:烟曲霉感染后48小时,肺组织经免疫荧光染色,在激光共聚焦显微镜下观察,可见糖尿病组小鼠肺组织中NETs更多,见图3。糖尿病组和对照组小鼠肺组织中Ly6G阳性率比较差异无统计学意义[(18.93±3.71)%比(12.55±3.13)%,P>0.05);糖尿病组小鼠肺组织中H3阳性率明显高于对照组[(15.73±1.70)%比(9.97±1.33)%,P<0.05)。
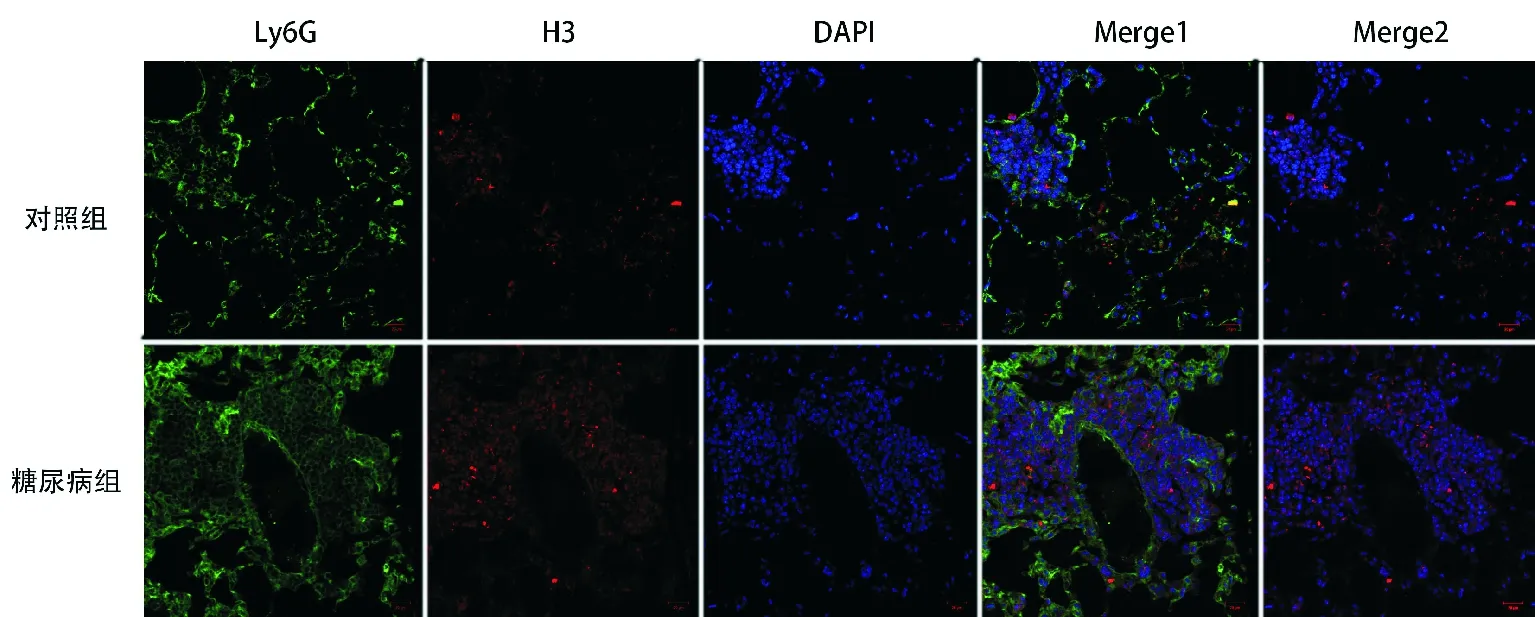
图3 两组小鼠肺组织NETs比较:红色:H3,绿色:Ly6G,蓝色:DAPI染色的DNA,Merge1:Ly6G、H3、DAPI叠加,Merge2:H3、DAPI叠加(免疫荧光染色,×200);细胞外H3和DAPI共定位代表NETs
4.两组小鼠中性粒细胞释放NETs能力及杀菌能力比较:糖尿病小鼠中性粒细胞H3的阳性率明显高于对照小鼠[(19.57±3.10)%比(10.60±1.15)%,P<0.05]。在加入菌丝前加入NADPH氧化酶抑制剂氯化二亚苯基碘(DPI,10 μmol/L)重复上述实验,镜下见两组小鼠中性粒细胞释放的NETs均明显减少(图4),两组小鼠中性粒细胞H3阳性率均下降,糖尿病小鼠H3阳性率与对照组小鼠比较差异无统计学意义[(8.30±0.85)%比(8.03±0.65)%,P>0.05]。共孵育24小时后进行菌丝活力检测结果显示,糖尿病组的菌丝活力明显高于对照组(0.82±0.04比0.65±0.05,P<0.05)。

图4 两组小鼠中性粒细胞释放的NETs和菌丝活力比较:红色:H3;绿色:Ly6G;蓝色:DAPI染色DNA;Merge:Ly6G、H3、DAPI叠加;细胞外H3和DAPI共定位代表NETs;DPI(-)表示不加DPI,DPI(+)表示加入DPI;对照组和糖尿病组箭头指向细胞外的NETs(免疫荧光染色,×400)
讨 论
非严重免疫缺陷的侵袭性曲霉病动物模型的制作目前存在困难,研究发现非严重免疫缺陷小鼠会很快清除经气道感染的曲霉孢子,难以诱导侵袭性曲霉病[12,15]。Rohm等[11]发现给免疫功能正常的小鼠感染菌丝可以模拟侵袭性肺曲霉病。然而这种单纯菌丝感染并不符合自然感染的过程,因此,我们先按照自然感染的方式予小鼠感染孢子,再感染菌丝以模拟侵袭性病变。我们发现,上述方法能较好地模拟侵袭性曲霉病。对照组小鼠感染后,能迅速将病原体清除;而糖尿病小鼠感染后,在观察期内肺部真菌负荷持续增加,表明糖尿病小鼠对烟曲霉的易感性高于对照组。
糖尿病患者中性粒细胞NETosis调节失衡,在非感染情况下NETs被过度释放[16],但在感染情况下NETs的变化比较复杂。Joshi等[17]发现在高糖环境下用脂多糖刺激中性粒细胞时NETs形成受损;Lee等[18]发现在肺炎克雷伯杆菌感染时糖尿病患者与非糖尿病患者中性粒细胞NETs形成相当;Cohen等[19]发现糖尿病小鼠在金黄色葡萄球菌感染时中性粒细胞释放NETs增多。以上结果均表明,糖尿病患者感染时NETs的改变可能与病原体种类或宿主免疫状态等因素有关。
关于NETs在曲霉感染中的作用,之前已有多项研究进行报道。Bianchi等[20]发现通过基因治疗恢复NETs能够有效控制慢性肉芽肿病患者的曲霉病;McCormick等[21]发现NETs能抑制烟曲霉生长;Bruns等[22]发现NETs对烟曲霉具有中等程度的杀伤。然而,也有研究得出不同甚至相反的结论,如Gazendam等[14]报道NETs对曲霉没有杀伤作用;Alflen等[23]报道NETs可阻止机体对曲霉的清除。这些研究结论的不同可能受实验条件影响,也可能表明NETs在曲霉感染中的作用比较复杂,还未被真正揭示。本研究发现,经烟曲霉感染后,糖尿病组小鼠中性粒细胞释放的NETs多于对照组小鼠,对烟曲霉菌丝的杀伤作用弱于对照组小鼠。由于中性粒细胞不能吞噬菌丝这样的大型微生物,其对菌丝的杀伤作用主要是依靠释放到细胞外的物质进行,因此本研究表明NETs对菌丝的杀伤能力很弱或没有杀伤作用,推测过多的NETs可能与更严重的肺部损伤相关。
NETs形成包括NADPH氧化酶依赖和非依赖两种方式[24]。我们发现,在小鼠肺曲霉感染时,NETs形成与NADPH氧化酶激活有关,NADPH氧化酶抑制剂DPI可以显著降低NETs释放,这种作用对糖尿病小鼠中性粒细胞更加显著,表明糖尿病小鼠中性粒细胞NETs过度释放与NADPH氧化酶异常激活有关。
综上所述,糖尿病小鼠中性粒细胞过度释放的NETs没有增强中性粒细胞对烟曲霉菌丝的杀伤,而且可能加重组织损伤。通过调节NADPH氧化酶来抑制过多的NETs形成可能对糖尿病患者预防或治疗曲霉感染有益。

