黑木耳寡糖的提取、结构表征及生物活性
胡皓程,李文利,张嘉宁,刘宇博
(大连理工大学生命科学与药学学院,盘锦 124221)
黑木耳(Auriculariaheimuer)作为我国重要的栽培真菌之一,已有1000多年栽培历史[1,2].除了具有重要的食用价值,黑木耳还具有清肠清肺、凉血活血及益气强身等多种药用功能[3].我国东北地区具有优质的黑木耳资源,对其中3个主要品种的测序研究结果显示,黑木耳基因组中存在可编码表达抗肿瘤及抗衰老产物的基因[4].进一步研究表明,多糖和黑色素等黑木耳成分具有抗肿瘤、抗炎症、抗凝血及免疫调节功能[5~10].虽然,黑木耳多糖具有较好的生物活性,但由于其黏度高[11]、分子量大、水溶性差[12],且化学结构和主要功能基团尚不明确[13],导致其应用受到了限制.研究表明,通过化学或物理方法降解多糖,获得低聚糖或寡糖,可明显增加其水溶性或生物活性[14].有关黑木耳来源多糖的相关研究较多,但聚合度在10以下的黑木耳寡糖鲜见报道.
本文以黑龙江地区的黑木耳为原料提取了黑木耳寡糖.采用热水浸提法,经热爆处理制备黑木耳发酵原浆,再提取黑木耳多糖;通过H2O2氧化降解和超声波物理降解,经离子交换层析和凝胶过滤层析分离纯化,获得黑木耳寡糖组分;采用质谱、红外光谱、核磁共振氢谱和高效液相色谱表征了其结构,并对其抗氧化和抗菌活性进行了评价,为黑木耳资源的开发利用提供依据.
1 实验部分
1.1 试剂与仪器
黑木耳,采自黑龙江伊春;大肠杆菌DH5α、金黄色葡萄球菌ATCC6538和带氨苄抗性的基因工程菌DH5α/pGEX-6P-1均为实验室保存;HepG2肝癌细胞购自中国科学院典型培养物保藏委员会细胞库(上海);弱阴离子琼脂糖凝胶(DEAE Sepharose Fast Flow)购自美国GE公司;Bio-Gel P6(Fine)凝胶购自美国Bio-Rad公司;2,2-联氮基双(3-乙基并噻唑啉-6-磺酸)二铵盐(ABTS)和氨苄西林(Ampicillin,AMP)购自北京Solarbio公司;1,1-二苯基-2-苦基肼(DPPH)购自日本TCI公司;单糖标准品甘露糖(Man)、葡萄糖胺(GlcN)、鼠李糖(Rha)、葡萄糖醛酸(GlcA)、半乳糖醛酸(GalA)、半乳糖胺(GalN)、葡萄糖(Glc)、半乳糖(Gal)、木糖(Xyl)和岩藻糖(Fuc)及1-苯基-3-甲基-5吡唑啉酮(PMP)购自美国Sigma公司;乙腈和醋酸铵(色谱纯)购自德国Merck公司;CCK-8试剂盒购自上海Beyotime公司;其它试剂均为分析纯.
Q-Exactive型四极杆轨道离子阱高分辨质谱仪(ESI-MS)和Nicolet iS50型傅里叶变换红外光谱仪(FTIR),美国Thermo Fisher Scientific公司;AVANCEⅢ400 MHz型核磁共振波谱仪(1H NMR),瑞士Bruker公司;Synergy H1型全功能荧光酶标仪,美国BioTek公司;Agilent 1260型LC UPLC系统,美国Agilent公司;AKTA Pure M蛋白纯化系统,美国GE公司.
1.2 实验过程
1.2.1 黑木耳发酵液原浆的制备及黑木耳多糖提取 参照文献[15]方法制备黑木耳发酵原浆.将黑木耳发酵原浆与蒸馏水按体积比1∶10在90℃恒温水浴中浸提2 h,以13000 r/min转速离心15 min,取出上清液;将沉淀重复提取3次后合并上清液,采用Sevage法除去粗蛋白;将上清液置于截留分子量为8000~14000的透析袋中透析2~3 d;将透析液浓缩冻干,得到黑木耳粗多糖(crudeAuricularia heimuerpolysaccharide,CAHP)冻干粉;分别用苯酚-硫酸法、3,5-二硝基水杨酸法和考马斯亮蓝G-250法对黑木耳发酵原浆和CAHP中的总糖、还原糖和蛋白质含量进行测定.
1.2.2 黑木耳多糖降解单因素实验 将0.04 g CAHP冻干粉复溶于10 mL蒸馏水中,加入一定体积和浓度的H2O2溶液反应不同时间(见表1);将反应液置于不同功率超声条件下进行物理降解;降解全程在冰浴中进行,维持反应体系温度为(25±0.5)℃[16];降解完成后使用蒸馏水透析去除H2O2.

Table 1 Single factor design for the degradation of Auricularia heimuer polysaccharides
参照文献[11]方法,以处理后的溶液黏度为评价指标,计算不同处理方法的CAHP降解率,以选择最佳降解条件.
1.2.3 黑木耳寡糖的分离纯化 将CAHP冻干粉加蒸馏水复溶,终浓度为4 g/L;用H2O2和超声协同处理,其中H2O2质量分数为0.6%,超声功率为60 W,处理时间为30 min;将处理后的CAHP溶液经DEAE Sepharose Fast Flow阴离子交换柱层析(ϕ1.25 cm×15 cm)纯化;采用0~1 mol/L的NaCl溶液进行线性梯度洗脱,使用苯酚-硫酸法对洗脱液进行总糖检测,合并洗脱液并浓缩,得到CAHP组分AHP1.
将组分AHP1采用Bio-Gel P6凝胶过滤柱层析(ϕ16 cm×100 cm)进一步分离;以蒸馏水为洗脱液,流速为0.4 mL/min,利用苯酚-硫酸法对洗脱液进行总糖检测;将洗脱组分置于截留分子量为100的透析袋中透析2~3 d,浓缩后冻干,得到黑木耳寡糖1(Auricularia heimueroligosaccharide 1,AHO1)组分.
1.2.4 AHO1的结构表征 参照文献[17]方法,采用三氟乙酸封管水解方法对AHO1进行降解;用1-苯基-3-甲基-5-吡唑啉酮(PMP)柱前衍生高效液相色谱法测定单糖组成;根据出峰时间及峰面积确定和计算样品的单糖组成及其摩尔比.
将1 mg AHO1溶于1 mL蒸馏水中,用0.22μm膜过滤除去杂质,使用四极杆轨道离子阱高分辨质谱仪进样检测;质谱分析由Qualitative Analysis of Mass Hunter Acquisition软件完成.
1.2.5 AHO1的抗氧化活性检测 采用ABTS和DPPH清除法检测AHO1的抗氧化活性;参照文献[18]方法,建立HepG2细胞氧化应激模型,通过CCK-8法检测AHO1对细胞的保护作用.
1.2.6 AHO1的抑菌活性检测 参照文献[19]方法,采用杯碟法测定AHO1的抑菌活性;参照文献[20]方法,测定AHO1的最小抑菌浓度(Minimal inhibit concentration,MIC).
2 结果与讨论
2.1 AHO1的提取分离流程
AHO1的提取分离工艺流程如图1(A)所示,黑木耳发酵原浆经热水浸提2 h后,离心得上清液;上清液经浓缩、脱蛋白、透析后冻干,得到CAHP冻干粉;CAHP经H2O2氧化与超声波物理联合水解条件下处理后,再将其用DEAE Sepharose FF阴离子交换柱脱蛋白[图1(B)];取产率较高的组分AHP1(产率80%)进行下一步研究,经Bio Gel P6凝胶过滤柱层析[图1(C)]后,得到AHO1(产率30%).

Fig.1 Preparation,separation and purification of oligosaccharides from Auricularia heimuer(A)Scheme of the procedure for extraction and isolation of oligosaccharide from Auriculariaheimuer;(B)elution graph of oligosaccharide on anion exchange chromatography;(C)elution graph of oligosaccharide on gel filtration chromatography.
进一步测定了黑木耳发酵原浆和CAHP溶液中总糖、还原糖和蛋白质的含量,以比较CAHP提取前后发酵原浆中的成分变化(图2).经多次重复提取与测定,测得黑木耳发酵原浆中的总糖、还原糖和蛋白质含量的平均值分别为5.326,4.911和5.669μg/mL,而CAHP冻干粉中的总糖、还原糖和蛋白质含量的平均值分别为4.845,4.710和0.453μg/mL.从黑木耳发酵原浆到CAHP冻干粉,总糖收率为91%,还原糖收率为96%,脱蛋白率为96%.以上结果表明,CAHP制备工艺的重复性良好,提取纯化步骤保留了大部分的多糖而去除了大部分的黑木耳蛋白杂质.
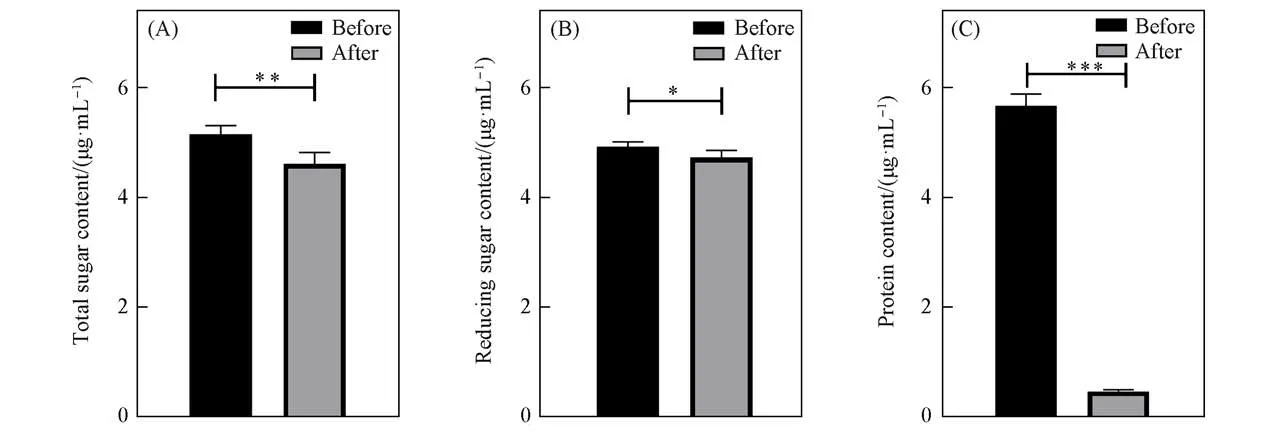
Fig.2 Changes in the composition of fermentation broth(A)Total sugar content;(B)reducing sugar content;(C)protein content.
2.2 CAHP降解条件的优化
使用热爆预处理方法将黑木耳原料制成黑木耳发酵原浆,再采用热水浸提法,从发酵原浆中提取CAHP.去除蛋白质后透析冻干(收率2.6%),便于后续CAHP降解条件的优化.
将CAHP复溶,采用H2O2氧化和超声波物理降解协同的方法降解CAHP.首先,探讨了H2O2质量分数对CAHP氧化降解效率的影响.无超声条件下处理15 min,梯度增加H2O2质量分数,CAHP的降解率随H2O2质量分数的增加而升高.当H2O2质量分数超过0.6%时,多糖降解率趋于平缓[图3(A)].推测适量H2O2可使CAHP的三螺旋结构解旋[21],有利于氧化降解反应的发生.当H2O2过量时,可能导致多糖羟基末端氧化,产生较多的副产物,因此选择质量分数0.6%作为H2O2最适用量.

Fig.3 Effects of H2O2 mass fraction(A),ultrasound power(B)and reaction time(C)on the degradation of Auricularia heimuer polysaccharide
进一步对CAHP超声降解功率进行了优化.无H2O2条件下处理15 min,以30 W梯度增加超声功率,结果表明随超声功率增大,CAHP的降解率升高.当功率超过60 W时,降解率开始趋于平缓[图3(B)].超声波的气穴效应和热效应导致多糖链间糖苷键发生断裂[22],过高的超声功率可能引起过热等副反应,因此选择60 W作为CAHP降解的超声最适功率.
最后,考察了联合H2O2氧化与超声波物理降解的反应时间对降解效率的影响.由图3(C)可见,在H2O2质量分数为0.6%及60 W超声条件下,随着反应时间的延长,CAHP的降解率逐渐升高.当降解时间达到25 min时,降解率可以达到90%,而25~30 min之间降解率趋于平缓.推测联合降解方法可能存在一定降解限度,因此最终选择25 min作为联合H2O2氧化与超声波物理降解CAHP的最适处理时间.
综上,选择质量分数0.6%的H2O2,60 W超声25 min作为黑木耳多糖降解的最适条件.
2.3 AHO1的结构表征
采用PMP柱前衍生高效液相色谱对CAHP和AHO1的单糖组成进行了分析[图4(A)].结果表明,CAHP和AHO1均主要由甘露糖、葡萄糖醛酸、葡萄糖和木糖组成,各单糖组成的摩尔分数见表2.

Table 2 Molar fraction(%)of the monosaccharides in CAHP and AHO1
采用ESI-MS对AHO1进行了高分辨质谱检测,其分子量及聚合度分布见图4(B).由单糖组成分析结果可知,AHO1由6种单糖组成,其分子量在300~2000之间,因此可以推断AHO1的聚合度为2~10.
进一步利用红外光谱分析了AHO1的官能团组成.由图4(C)可见,3429 cm-1附近宽而强的吸收峰是由O—H伸缩振动引起的糖类分子间氢键的典型吸收峰;2938 cm-1处为次甲基(—CH2)中C—H的伸缩振动峰;1730 cm-1处为羧基—COO的伸缩振动峰,1618 cm-1处为C=O的非对称伸缩振动峰,1424 cm-1处为C=O的对称伸缩振动峰,均为糖醛酸中质子化羧基特征峰,与AHO1的单糖组成结果相吻合;1378和1253 cm-1处的峰归属为C—H键的变角振动;在1059 cm-1处的典型吸收峰为吡喃糖环中C—O—C的伸缩振动峰;920和835 cm-1处的吸收峰表明AHO1中存在α-糖苷键;799 cm-1处的区域特征峰对应于D-吡喃葡萄糖的形式,与文献[23]报道的黑木耳多糖AAP-4的红外光谱结果类似[23].

Fig.4 HPLC(A),ESI-MS(B),FTIR(C)and 1H NMR(D)spectra of AHO1
图4(D)为AHO1的1H NMR谱图.1H NMR常被用于鉴定多糖结构中糖苷键构型及结构中氢的个数比,但由于非异头质子的化学位移相近,且有部分重叠现象,使多数质子信号较难解析,通常认为,4.00<δ<5.00时为β型异头质子,5.00<δ<6.00时为α型异头质子.AHO1的1H NMR谱图中存在δ5.06的吸收峰,表明存在α-糖苷构型异头氢.图4(D)中δ3.2~4.5之间的信号峰主要是糖残基上C2-H到C6-H的信号位移峰,δ2.12附近的信号峰表明AHO1中可能含有乙酰基.
通过以上单糖组成分析、高分辨质谱检测、红外光谱和核磁共振氢谱对AHO1进行了初步的结构表征,尚未对AHO1中端基碳与侧链羟基相连位点进行研究.许淑琴[24]发现,从黑木耳中提取出的杂多糖(wAF)由4种单糖组成,并含有少量的乙酰基,且wAF的主链为α-(1→3)-D-甘露聚糖,在C6和C2位置上连接的是D-葡萄糖,D-木糖和D-葡萄糖醛残基,与本文结果一致.本文研究结果表明,AHO1主要由甘露糖、葡萄糖醛酸、葡萄糖和木糖4种单糖组成,以甘露糖为主,各糖残基之间通过α-糖苷键连接,聚合度为2~10,推测AHO1与wAF的结构特征相似.
2.4 AHO1的抗氧化活性
为研究CAHP的生物活性,检测了其抗氧化和抑菌活性.图5示出了AHO1对ABTS和DPPH自由基的清除结果.阳性对照组维生素C(VC)在实验浓度为1.2 mg/mL时,对2种自由基的清除能力均约为80%.与阳性对照组相比,不同浓度的AHO1对ABTS和DPPH自由基均有较好的清除作用,且呈剂量依赖性.该结果与文献[25]报道的低分子量果胶的抗氧化活性结果相似.当AHO1浓度达到1.2 mg/mL时,ABTS和DPPH自由基清除率分别为24.61%和30.46%.
图6示出AHO1对H2O2诱导的HepG2细胞氧化应激损伤的保护作用.使用0~200μg/mL的AHO1干预HepG2细胞12 h,CCK-8法检测细胞存活率无显著变化[图6(A)].进一步选取AHO1的浓度为10,25和50μg/mL进行实验.使用H2O2处理HepG2细胞建立氧化损伤模型,随着H2O2浓度的升高,细胞存活率逐渐降低[图6(B)].H2O2对HepG2细胞的IC50值为665μmol/L,本文选择600μmol/L作为建模浓度.与未经600μmol/L H2O2处理的对照组相比,经H2O2处理过的细胞生存率显著降低(P<0.001),而经过10,25和50μg/mL 3个浓度的AHO1预处理HepG2细胞12 h后,细胞生存率显著增高[P<0.05,图6(C)].

Fig.5 Antioxidant activity determined by ABTs assays(A)and DPPH assays(B)

Fig.6 Protective effect of AHO1 on H2O2-induced oxidative stress damage in HepG2 cells(A)The effect of AHO1 on proliferation of HepG2 cells;(B)the effect of H2O2 on proliferation of HepG2 cells;(C)the effect of AHO1 on the proliferation of HepG2 cells induced by H2O2.
综上所述,AHO1对ABTS和DPPH自由基有一定的清除作用,对HepG2氧化应激损伤具有保护作用,证明AHO1具有良好的抗氧化性.研究表明,CAHP体外水解物的抗氧化性是通过提高过氧化氢酶及谷胱甘肽还原酶等抗氧化酶活性与谷胱甘肽水平实现的[26].本文推测AHO1的抗氧化作用具有类似的途径.
2.5 AHO1的抑菌活性
以大肠杆菌DH5α、金黄色葡萄球菌ATCC6538和带氨苄抗性的基因工程菌DH5α/pGEX-6P-1为抑菌对象,以AMP为阳性对照,采用杯碟法测试了AHO1的抑菌活性.图7(A)和(B)为大肠杆菌组的阴性对照图和实验处理图,图7(C)和(D)为金黄色葡萄球菌组的阴性对照图和实验处理图,图7(E)和(F)为带氨苄抗性的基因工程菌组的阴性对照图和实验处理图.实验处理图中,中间孔均为25 mg/mL的AMP阳性对照组,四周孔均为25,50,100和200 mg/mL的AHO1处理实验组.
实验结果表明,不同浓度的AHO1对大肠杆菌、金黄色葡萄球菌和带氨苄抗性的基因工程菌均有较强的抑制作用,且抑菌圈直径随着AHO1浓度的增加而增大(图7和表3).其中,AHO1对大肠杆菌的抑制作用最显著.当AHO1浓度为200 mg/mL时,抑菌圈直径达22.76 mm.可见,AHO1与AMP具有近似的大肠杆菌和金黄色葡萄球菌抑制活性.
AHO1对大肠杆菌DH5α、金黄色葡萄球菌ATCC6538和带氨苄抗性的基因工程菌DH5α/pGEX-6P-1的最小抑菌浓度列于表4.可见,AHO1对ATCC6538的MIC为2.5 mg/mL,对DH5α和DH5α/pGEX-6P-1的MIC均为1.25 mg/mL.

Fig.7 Antibacterial effects of AHO1 on DH5α,ATCC6538 and DH5α/pGEX-6P-1(A)DH5αcontrol group;(B)DH5αexperimental group;(C)ATCC6538 control group;(D)ATCC6538 experimental group;(E)DH5α/pGEX-6P-1 control group;(F)DH5α/pGEX-6P-1 experimental group.

Table 3 Inhibition areas of oligosaccharide with different concentrations

Table 4 MIC of AHO1 against bacteria
综合以上实验结果,AHO1对大肠杆菌DH5α、金黄色葡萄球菌ATCC6538及带氨苄抗性的基因工程菌DH5α/pGEX-6P-1均有良好的抑制作用,可作为天然抗菌剂.壳寡糖衍生物可以增加细菌细胞膜通透性和影响细菌细胞内部分子合成等途径使细胞功能异常,导致细菌细胞死亡[27].研究发现,AHO1对带氨苄抗性的基因工程菌具有较好的抑制活性,证明AHO1的抑菌机制与抗生素类药物不同,但其具体机制还需进一步分析.
3 结 论
采用热水浸提法,以热爆预处理的黑木耳发酵原浆为原料提取CAHP.进一步使用质量分数为0.6%的H2O2与60 W超声协同降解25 min,经阴离子交换柱层析和凝胶过滤柱层析分离纯化,得到AHO1.采用单糖组成分析、高分辨质谱、红外光谱和核磁共振氢谱表征了其结构,结果表明,AHO1是以甘露糖为主,由6种单糖组成,各糖残基通过α-糖苷键连接,分子量低于2000,聚合度为2~10的低聚糖.抗氧化活性研究表明,AHO1对ABTS和DPPH自由基具有较明显的清除效果.经AHO1预处理可有效减少H2O2对HepG2细胞的氧化应激损伤,证明AHO1具有良好的抗氧化活性.抑菌实验发现,AHO1对大肠杆菌、金黄色葡萄球菌和带氨苄抗性的基因工程菌均具有不同程度的抑制作用,抑制效果呈浓度依赖性.MIC实验表明,AHO1对金黄色葡萄球菌的MIC为2.5 mg/mL,大于对大肠杆菌和带氨苄抗性的基因工程菌的MIC(1.25 mg/mL).综上所述,本文获得了低聚合度黑木耳寡糖AHO1的制备方法,初步表征了其结构和生物活性,为低分子量黑木耳寡糖的研究和商业应用提供了新方法和实验基础.

