GYS2与p53抑制HBV相关肝癌的研究
赵新军,李 循,王书恒,李九智
(1.伊犁师范大学新疆凝聚态相变与微结构实验室,伊宁 835000;2.伊犁师范大学微纳电传感器技术与仿生器械实验室,伊宁 835000;3.新疆维吾尔自治区人民医院泌尿外科,乌鲁木齐 830000)
1 引 言
乙型肝炎病毒(HBV)或丙型肝炎病毒(HCV)常诱发肝癌(HCC),HBV或HCV感染后造成肝细胞基因改变,引起肝脏病变,诱导HCC的发生发展[1-3].流行病学调查表明[3],HCC的发生多半与乙肝病毒x蛋白(HBx)引发的炎症和代谢异常密切相关.新兴的证据也表明[4,5],葡萄糖代谢异常已经成为了癌症的重要标志之一.糖原是葡萄糖的支链聚合物,存储于肌肉和肝脏中,可在需要时用于能量供应[6,7].近来的研究发现[8-10],在人类肿瘤细胞中存在异常的糖原含量,例如,在低糖原组织(如乳房,卵巢,肾和肺)癌细胞中的糖原含量增加,而在HCC细胞中,糖原浓度与肝脏肿瘤生长呈负相关.另外,由于糖原解支酶AGL的丧失,导致的糖原减少,还会诱导膀胱癌的发生[11].
糖原合酶(GS)是糖原合成中的关键酶,GS在人体组织中有两种同工型,糖原合酶1(GYS1)和糖原合酶2(GYS2)[12].诸多的研究证据表明[13,14],GYS1通常在肌肉、心脏和肾脏中表达,而GYS2的表达则主要限于肝脏中.作为糖原生物合成的限速酶,GS催化将UDP葡萄糖添加到现有的葡萄糖分子上,以延长线性葡萄糖聚合物链.研究表明[15],在髓样白血病细胞增殖过程中,GYS1不仅可以降低糖酵解通量,而且增加了糖原反应性AMPK(AMP激酶)的激活,从而显著抑制白血病细胞生长.在肝脏糖原合成中,GYS2则起着重要的调控作用,研究发现[16-18],GYS2可以刺激肝脏中糖原合成,有助于将血糖水平维持在一定范围内,GYS2基因突变会引起糖原合酶缺乏症.最近,Chen等人[19]的研究发现,在HCV诱发HCC进程中,GYS2与p53协同限制HCC细胞生长和增殖,GYS2的敲减则会调低p53的表达,促进HCC细胞生长增殖.在HCV诱发的HCC进程中,GYS2被糖原合酶激酶3β(GSK3β)磷酸化和抑制,被6-磷酸葡萄糖(G6P)变构激活[20,21],并在肝糖原合成的昼夜节律中由CLOCK基因调控转录[22].
p53蛋白是细胞内最重要的肿瘤抑制因子之一[23],在响应应激信号的过程中,p53介导细胞对多种遗传毒性和生长胁迫作出反应,包括DNA损伤和致癌性侵害.激活的p53可以增加许多基因的表达,并引发细胞暂时的细胞分裂周期停滞,永久性细胞衰老和凋亡性细胞死亡,以防止受损或受压的细胞继续增殖.通常认为,逃避p53介导的检查点途径是大多数(不是全部)肿瘤类型发展的必要步骤[24,25].同样重要的是,在胶质母细胞瘤、乳腺癌和结肠癌细胞中,p53可以通过诱导糖原蓄积的方式,抑制细胞过早衰老和肿瘤生长[26].在HCV诱发HCC进程中,p53通过带有GYS2的负反馈回路,限制HBV相关的HCC细胞生长增殖[19].
深刻理解GYS2与p53协同作用,抑制HBV相关的HCC基因表达的信号通路,对于设计阻止HBV引起的HCC治疗方案是非常重要的.实验研究结果[19,26]为糖原代谢失调诱发的HCC临床治疗提供了新的治疗靶点.之前的理论[27-32]在激活基因通路研究方面已经取得了重要的成果,并定量揭示了肿瘤抑制的物理机制.在GYS2与p53协同作抑制HBV相关的HCC进程中,HBx、HDAC1与乙酰化的p53(p53AC)形成复合体,并抑制GYS2表达;GYS2通过调控增强p53蛋白的稳定性,抑制HCC的发生发展[19].p53已被证实了在抑制癌变过程中起着重要的作用[23-26].那么,GYS2与p53是如何协同调控HBV相关的HCC的发生发展,当前仍然没有相关理论或模拟研究揭示其深刻的物理机制,在HBV诱导HCC的发生发展过程中,糖原代谢的改变和潜在的分子机制仍然未知.
鉴于文献[19]中新颖而重要的实验结果,在本文中,将建立动力学理论模型,研究GYS2与p53抑制HBV相关的HCC进展的动力学机制,分析GYS2与p53的调控作用,进一步深刻揭示GYS2与p53调控HBV相关的HCC的抑癌机理,为设计阻断乙型肝炎向HCC转变的通路治疗方案提供理论依据.
2 理论模型
Chen等人的实验研究发现[19],GYS2与p53通过负反馈抑制HBV相关的HCC进程中,HBx、HDAC1与p53AC形成复合体,抑制GYS2表达;抑制HBx/HDAC1/p53AC复合物形成,则会支持GYS2的转录.GYS2与MDM2蛋白竞争结合p53,分别与p53形成复合体.同时,GYS2与MDM2竞争性地与p53结合,也阻止了p53介导的MDM2的泛素化和降解.MDM2也通过抑制p53的反式激活活性来抑制p53的功能[27].基于以上考虑,GYS2与p53抑制HBV相关的肝癌进展的具体模型示意图为:

图1 GYS2与p53抑制HBV相关的肝癌进展的具体模型示意图.Fig.1 Schematic depiction of the model on GYS2 and p53 inhibiting the progression of HBV-related hepatocellular carcinoma.
在这里,我们描述HBx、HDAC1与p53AC形成复合体HHP,这一复合体抑制GYS2表达.GYS2和MDM2竞争与p53结合,与GYS2和MDM2结合的p53标记为Gp53和Mp53.Gp53、Mp53分别和GYS2、MDM2形成的复合体为GYGP、MPMD.假定形成复合体HHP的反应为三级反应,形成其余复合体的反应为二级反应.复合体GYGP诱导p53形成稳态的p53(Sp53),与p300结合的Sp53标记为PSp53,p300通过与PSp53形成的复合体为pp53,并将PSp53乙酰化为p53AC.未与p300结合的Sp53标记为FSp53,FSp53抑制HCC的发生发展.基于Hill动力学与Michaelis-Menten方程[33,34],可以获得各组分浓度随时间变化的动力学方程组为:


以上方程组中,k3、k4为竞争因子参数,为了符合实验结果[19],我们模型化k3=1/{1+exp[0.5(1-[GYS2]/[MDM2])]},k3、k4描述了GYS2和MDM2对p53的竞争结合能力,其中:k4=1-k3.k10=?1/{1+exp[0.3(1-[p300]/[Sp53])]}描述了p300对Sp53的结合能力,k11=1-k10,标记未与p300结合的Sp53的分数,方程(5)中的Hill系数为n=3.GYS2通过与p53协同作用而起到抑癌作用,在这里我们考虑FSp53抑制HCC的发生发展.
生物系统具有很强的稳定性,这使得合理的数学模型能够在很大的参数范围内有效描述系统的特性,可以通过考察模型对参数变化的敏感性检测参数(如附录中附表所示)设置的合理性,模型中微分方程组可以通过四阶Runge-Kutta方法求解.
3 结果与讨论
Chen等人的实验结果表明[19],GYS2通过与p53结合,致使Sp53形成,FSp53抑制HCC的发生发展.为了深刻揭示GYS2与p53协同抑癌作用,取各参数值(如附录中附表所示),可以获得并分析[HBx]=0.2 μM时[Sp53]、[FSp53]随[GYS2]的变化关系.
图2 显示了[Sp53]和[FSp53]随[GYS2]变化的函数关系.从图2可以看出,在较小的[GYS2]范围内,[Sp53]和[FSp53]随[GYS2]的增大而显著增加.[Sp53]和[FSp53]随[GYS2]的变化呈现了相似的变化规律,由此表明了[FSp53]与[Sp53]的正相关性,Sp53表达水平的提升会促使FSp53表达水平幅度提高.如图2所示,在起始的GYS2浓度变化范围内(0.04~0.1 μM),[Sp53]和[FSp53]随[GYS2]的变化较为缓慢,当GYS2达到较高浓度时(0.12~0.16 μM),[Sp53]和[FSp53]随[GYS2]的增加较快增长.由此表明,少量的GYS2的增加即可促使Sp53的表达上调,进而FSp53的表达水平随着Sp53表达水平的提升而增大.当GYS2浓度达到较高时(0.12~0.16 μM),这会促使Sp53和FSp53的表达上调加快.由此可以确定,Sp53和FSp53的活性可以由GYS2灵敏地调控.GYS2调节提升了Sp53表达水平,激活并促进下游FSp53的表达提升,抑制HCC的发生发展.相反,如果GYS2敲减,会使得Sp53表达下调,进而降低FSp53表达水平,HCC发生发展的抑制程度减弱.Chen等人的实验结果[19]已经揭示,在HCV诱发的HCC进程中,由于GYS2的缺失,在很大程度上促进了HCC细胞的生长.

图2 [Sp53]与[FSp53]随[GYS2]的变化关系Fig.2 [Sp53]and[FSp53]as a function of[GYS2]
通过RNA测序进行的转录分析结果表明[19],GYS2的敲减抑制了p53通路,通过GYS2和p53的直接结合,GYS2的过多表达诱导p53表达水平提升.同时,MDM2介导的p53泛素化被GYS2减弱,MDM2则通过抑制p53的反式激活活性来抑制p53的功能[27].为了揭示MDM2介导的p53的潜在抑制机制,可以考察[MDM2]的动力学特性和MDM2影响Sp53的特性.
k5参数描述了Sp53对MDM2的激活速率,改变k5可以获得不同幅值的[MDM2]与[Sp53]随时间改变的函数关系.图3显示了不同k5条件下,[MDM2]与[Sp53]随时间改变的动力学关系.从图3a可以看出,随着时间的演化,[MDM2]极快地升高到了稳定值.并且,较大的k5对应了较大的[MDM2]随时间变化的幅值.这是由于较大的k5代表了Sp53对MDM2较大的激活速率,因此使得MDM2表达水平幅值变大.这是由于MDM2由Sp53诱导激活,很快提升了表达水平,Sp53的高表达会促使MDM2表达水平提升.同时,激活的MDM2与p53结合,形成复合物MPMD抑制Sp53的功能.另外,GYS2和p53结合的复合物GYGP诱导Sp53水平提升.图3b显示了在不同k5(不同MDM2表达幅值)条件下,Sp53幅值水平只是轻微改变,由此表明了Sp53的稳态特性,这意味着GYS2在调控维持Sp53处于稳态、进而抑制HCC中起着重要作用.实验的研究表明,MDM2通过与GYS2竞争性结合p53,抑制p53的泛素化而稳定了p53蛋白.部分稳定的p53蛋白(Sp53)经过p300乙酰化后,形成p53AC,并与HBx、HDAC1结合形成复合体HHP,抑制GYS2表达.
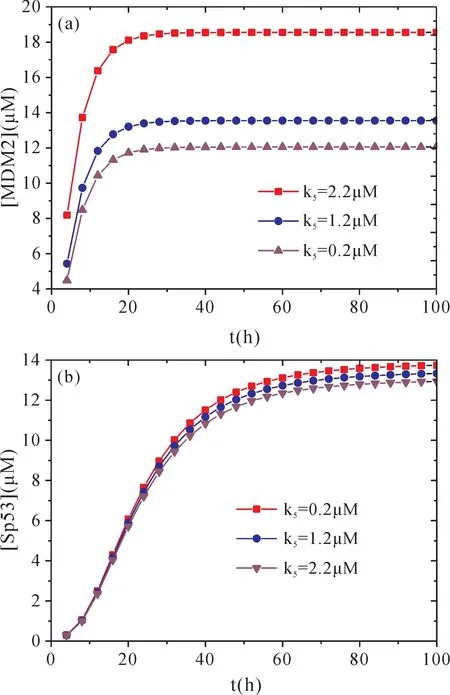
图3 [MDM2]与[Sp53]随时间改变的动力学关系Fig.3 Temporal evolutions of the levels of[MDM2]and[Sp53]
图4 显示了[HHP]随[p53AC]变化的函数关系.从图4可以看出,被p300乙酰化后的p53(p53AC)会导致HHP急剧增加.p53AC通过与HBx、HDAC1形成复合体HHC,这种复合体诱导GYS2表达水平降低.这样,通过p300介导的p53乙酰化,形成了依赖于p300的负反馈回路抑制GYS2.Chen等人发现[19],p53能够转录调节糖原合成中涉及的基因,例如PYGL,GBE1,G6PC和GSK3β.在这里,p53AC的过多表达,则诱导HHP表达上调,抑制GYS2的表达水平,进而会调低细胞中的糖原含量.因此,这种p53的异位表达的敲低,则会上调GYS2,由此表明了GYS2在p53介导的异常糖原代谢中的作用[18,19].

图4 [HHP]随[p53AC]变化的函数关系Fig.4 [HHP]as a function of[p53AC]
除了p53AC通过与HBx、HDAC1形成复合体HHC,参与糖原代谢调节,Chen等人的数据也表明乙肝表面抗原(HBsAg)阳性HCC患者的GYS2会被进一步降低,为了进一步深刻理解HBx在糖原代谢中的作用,可以考察不同HBx浓度条件下GYS2与Fsp53的动力学特性.
图5 呈现了在不同HBx浓度条件下,GYS2和FSp53浓度随时间改变的动力学关系.从图5a可以看出,在HBx处于较低浓度条件下,GYS2浓度经过较短时间升到了较大的稳定值,表明GYS2很快被激活并达到一定的表达水平.当HBx浓度较高时,GYS2很快升高到了最大值,然后持续极短时间后降低并趋于稳定.由于HBx与p53AC、HDAC1结合形成复合体HHP,较高浓度的HBx可以生成较多的HHP(图5a插图),HHP通过负反馈抑制GYS2表达.由此表明,较高浓度的HBx诱发减弱了GYS2表达,使得GYS2表达下调,这种下调使得HBx弱化了下游FSp53的表达,促进了HCC的发生发展.图5b呈现了随着HBx浓度增大,FSp53随时间改变的幅值降低.由此表明,HBx会促使FSp53的表达下调,这样下调后的FSp53对HCC的抑制程度减弱,有利于HCC增殖.因此,在糖原代谢过程中,HBx与HDAC1、p53AC形成复合体,调控GYS2表达降低,进而使得FSp53表达下调,HCC细胞增殖加快.相反,敲低的HBx不能形成过多的HHP,有利于GYS2表达上调,在一定程度上恢复HCC细胞中的糖原含量,并且GYS2表达上调还可以促使FSp53表达水平提升,抑制HCC的发生发展.实验研究也表明,HBx通过其120-134aa域抑制GYS2表达,在HepG2.2.15和HepG2-HBx细胞中,沉默的HBx会使得GYS2表达上调,在HBx阳性病例中,GYS2低表达更为常见[18,19].

图5 不同[HBx]条件下,[GYS2]与[FSp53]随时间改变的动力学关系Fig.5 Temporal evolutions of the levels of[GYS2]and[FSp53]at different[HBx]
在HCC的发生发展过程中,FSp53是最重要的抑制因子之一,p300与Sp53结合,调低了FSp53的表达水平,从而减弱了FSp53对HCC的抑制程度.
图6 呈现了在不同p300浓度条件下,[pp53]与[FSp53]随时间改变的动力学关系.从图6可以看出,[pp53]与[FSp53]随时间演化很快增加,并维持稳定值趋于不变,这表明pp53与FSp53很快会达到稳定的表达水平.比较图中p300浓度在[p300]=0.2 μM,[p300]=0.7 μM和[p300]=1.2 μM时的[pp53]幅值,可以发现,随着[p300]增大,[pp53]随时间变化幅值明显变大,这是由于,较多的p300有利于与Sp53形成较多的复合物pp53.过多pp53生成使得p53AC增多,p53AC协同HBx与HDAC1促使GYS2表达降低,形成了诱发HCC的负反馈通路.同时,与Sp53形成较多pp53,会消耗较多的Sp53,致使FSp53表达降低,从而导致FSp53对HCC抑制程度减弱,进而诱导HCC发生发展.

图6 不同[p300]条件下,[pp53]与[FSp53]随时间改变的动力学关系Fig.6 Temporal evolutions of the levels of[pp53]and[FSp53]at different[p300]
4 结 语
在本文中,基于Hill动力学与Michaelis-Menten方程,建立理论模型研究GYS2与p53抑制HBV相关的肝癌进展.理论模型考虑:HBx、HDAC1与p53AC结合形成复合体,并抑制GYS2表达;GYS2通过增强调控p53蛋白,进而抑制HCC的发生发展.研究发现,GYS2灵敏地促使了稳态p53(Sp53)的表达上调,并激活下游FSp53的活性,抑制HCC的发生发展.由此表明,在HCV诱发HCC进程中,由于GYS2的缺失,在很大程度上会促进HCC细胞的增殖.通过考察MDM2的浓度随时间改变的动力学关系,我们发现,MDM2只是轻微改变Sp53幅值水平,GYS2使得Sp53处于稳态.稳态的Sp53经过p300乙酰化后与HBx、HDAC1结合形成复合体,并抑制GYS2表达.由此表明了GYS2在p53介导的糖原代谢中对HCC的抑制作用[18,19].实验研究数据表明[19],HBsAg阳性HCC患者的GYS2会被进一步降低,通过考察不同浓度HBx条件下GYS2与Fsp53的动力学特性,我们发现,较高浓度的HBx减弱了GYS2表达,进而弱化了下游FSp53的表达,促进了HCC的发生发展.这也表明了在糖原代谢过程中,HBx与HDAC1、p53AC形成复合体,调控GYS2表达降低,进而使得FSp53表达下调,HCC细胞增殖加快.另外,p300与Sp53结合,也在一程度上调低了FSp53的表达水平,减弱了FSp53对HCC的抑制程度,进而诱导HCC发生发展.
本文中只考虑GYS2与p53协同抑制HBV相关的肝癌进展,事实上,GYS2还可以由糖原合酶激酶3β(GSK3β)磷酸化和抑制,还会被6-磷酸葡萄糖(G6P)变构激活[20,21],并在肝糖原昼夜节律的合成过程中由CLOCK基因转录调控[22],因此,GYS2的临床意义及其在人类癌症糖原调节中的生物功能仍需要进一步研究[35].本文考虑HBx、HDAC1与p53AC抑制GYS2表达,以及GYS2通过增强调控稳态p53表达,进而抑制HCC的发生发展,理论结果符合实验[19],表明了GYS2通过与p53协同作用,抑制HBV相关的肝癌基因的表达通路的动力学特性.理论结果进一步深刻揭示了GYS2与p53调控HCC的抑癌机理,可为设计阻断HBV向HCC转变的通路治疗方案提供理论依据.
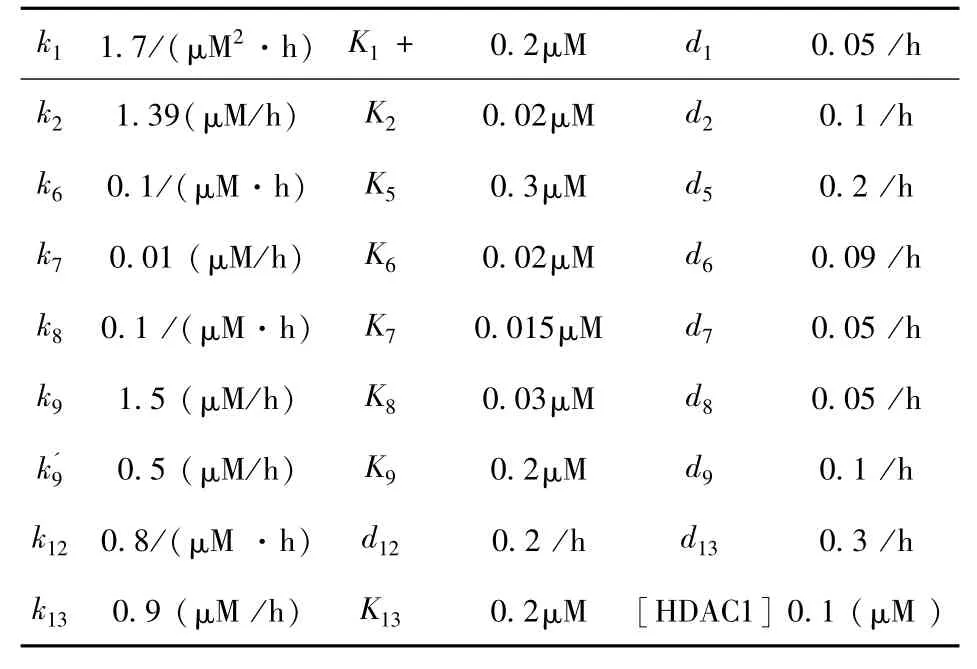
表1 模型中的参数取值Table 1 Standard parameter values of the model

