肿块型乳腺导管癌淋巴结转移的影响因素
谢冬梅,邹庆,曾茹雪,孟义兴,李洁,李欲丹,邱太春
乳腺癌是女性常见的恶性肿瘤之一,已成为全球女性发病和死亡首位的恶性肿瘤[1],因乳腺癌具有高度内部异质性特点,因此乳腺癌又基于特异基因表达的分子类型,可分为Luminal A、Luminal B、HER-2过表达及三阴性乳腺癌[2]。而导管癌又是乳腺癌中最常见的病理类型,约占所有乳腺癌的70%[3]。肿瘤淋巴结转移是影响恶性肿瘤预后的最重要的独立危险因素。乳腺的前哨淋巴结是最先出现,也是最为常见的转移部位,是评价肿瘤预后的重要指标[4]。因此,通过分析乳腺淋巴结转移患者的临床(年龄、肿瘤T分期、病理分级)、病理分子分型、MRI特点(大小、位置、ADC、动态增强曲线)的特点,寻找影响淋巴结转移的危险因素,有助于为临床制定精准化治疗方案提供参考依据[5]。
1 材料与方法
1.1 研究对象
回顾性分析2013年1月至2020年5月在我院经病理确诊的肿块型乳腺导管癌患者177例,其中淋巴转移阳性组67例,阴性组110例。对患者年龄、临床资料、病理、肿瘤T分期,病理分级,病理分子分型、MRI(大小、位置、ADC、动态增强曲线类型)资料进行分析。本研究获得医院伦理委员会批准(伦理受理号:2020-04-093),患者免除知情同意。
1.2 扫描方法
使用飞利浦Achieva 1.5 T磁共振扫描仪,乳腺专用线圈,分别获取T1WI、T2WI、扩散加权成像(dif f usion weight ed imaging,DWI)、ADC、动态增强图像(8个期);扫描参数:T1WI:TR=4.8 ms,TE=2.1 ms,翻转角=12°,压脂T2WI采用SPAIR,平均次数2,TR=3400 ms,TE=90 ms,回波链长度19,FOV=260 mm×320 mm,层厚3 mm,层间距0.3 mm,矩阵348×300,动态增强:注药前平扫1次,使用高压注射器经肘静脉快速团注钆喷酸葡胺,0.1 mmol/kg,继而推注20 mL生理盐水。采用快速梯度回波序列行动态增强MRI扫描,TR=5 ms,TE=2.2 ms,翻转角15°,平均次数1,FOV=300 mm×320 mm,矩阵300×320,层厚1 mm;图像后处理:采用飞利浦工作站(Phil ips EWS),获得ADC值及动态曲线。
1.3 数据处理
采用SPSS 20.0统计学软件对所有资料进行统计分析,计数资料采用t检验和卡方检验、Fisher确切概率法,P<0.05表示差异有统计学意义。
2 结果
2.1 两组临床资料比较
67例淋巴结转移组(A组),患者平均(51.40±10.56)岁,110例无转移组(B组)平均(49.26±8.77)岁,两组患者年龄、肿瘤直径、ADC值差异无统计学意义(表1)。

表1 淋巴结转移组与无转移组组间临床数据比较
两组在T分期及病理分级存在统计学差异(表2、3)。淋巴结转移组T分期以T2为主[56.7%(38/67)],T3、T4期分别为10.4%(7/67)、16.4%(11/67),病理分级以Ⅱb、Ⅲa期为主,分别为25.4%、22.4%;无转移组以T1为主(52.7%),病理分级以Ⅰ、Ⅱa为主,分别为31.8%、33.6%,分析数据发现,T分期越晚及病理分级越高,越容易发生淋巴结转移。

表2 淋巴结转移组与无转移组不同T分期的统计学比较(Fisher精确检验)
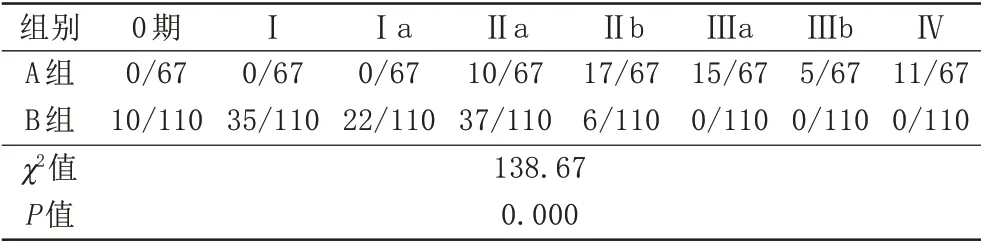
表3 淋巴结转移组和无转移组不同病理分期的比较(Fisher精确检验)
2.2 两组乳癌分子分型的比较
在分子分型上,淋巴结转移组和无转移组差异无统计学意义(表4)。两组中均以Luminal B型最高,在A组中为44.8%,B组中为40.0%,占总体乳癌的41.8%。Luminal A型、三阴型、HER-过表达型、其他类型分别为15.3%、11.9%、11.3%、19.8%。
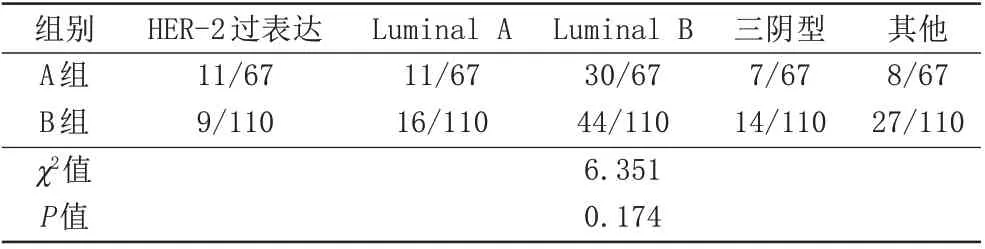
表4 淋巴结转移组和无转移组乳癌分子分型的比较(卡方检验)
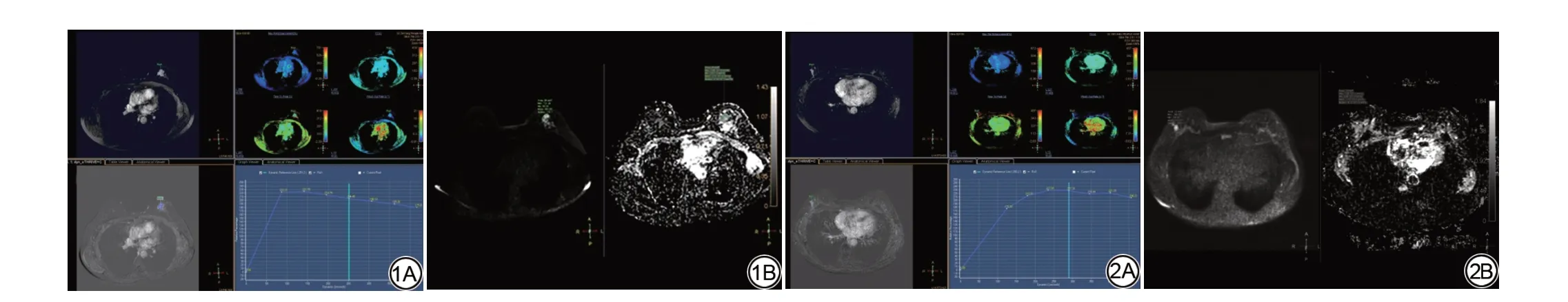
图1女,39岁,乳腺癌淋巴结转移者。A:肿块位于左乳外上象限,动态增强曲线为流出型;B:肿块ADC值为0.71×10-3 mm2/s 图2 女,42岁,无淋巴结转移乳腺癌患者。A:肿块位于右乳外上象限,动态曲线为平台型;B:肿块ADC值为1.12×10-3 mm2/s。
2.3 两组在位置分布上的比较
肿瘤在左、右侧分布上,右侧占所有乳腺癌的54.8%,左侧为44.6%,差异无统计学意义(P>0.05)(表5)。在象限分布上,以外上象限为主,占40.1%,余外下象限、内上象限、内下象限、跨象限、全乳、中央区分别为18.6%、14.7%、5.1%、19.8%、4.0%、1.1%(P<0.05),差异有统计学意义(表5)。且肿块位于中央区的患者,则均发生淋巴结转移(2/2)。

表5 淋巴结转移组和无转移组两组在位置分布上的比较(Fisher精确检验)
乳腺癌的动态曲线中以平台型最为常见(49.7%),转移组中为50.9%;流出型曲线为40.6%,转移组中为39.6%,以流入型最少,仅为9.8%。
3 讨论
乳腺癌淋巴结转移是影响乳癌的重要因素,在乳腺癌的治疗选择上有着决定性的作用[6]。随着现代医学的进步,对乳腺癌的深入研究发现,影响乳腺癌淋巴转移的因素很多,如乳腺癌的分子分型、T分期、肿瘤大小、肿瘤位置、病理学分级等因素有关[7],目前对转移性淋巴结的诊断主要依靠影像上形态大小及临床病理明确,对于导致淋巴结转移的高危因素尚不明确,因此通过收集、分析整理及免疫组化检测乳腺癌患者临床、病理及影像相关特征,寻找淋巴结转移相关危险因素,为临床下一步治疗方案的指导提供有价值的参考依据,降低乳癌转移,改善乳腺癌的预后[8]。
177例入组患者中,淋巴结转移率为37.9%(67/177),结果与翁剑华等[6]、王宝娜等[9]报道的64.9%不符合,分析其不同点发现,本研究中入组的患者,与翁剑华等[6]、王宝娜等[9]入组的乳癌肿块大小范围存在明显不同,可能是随着技术的进步及人们健康意识的加强,就诊的时间较早,乳癌肿块较小,分期较早;此外,本研究入组的所有乳腺癌均为肿块型导管癌。研究发现,乳腺癌淋巴结转移与肿块分布的象限、T分期、组织学分级存在相关性,与文献报道一致[10]。
3.1 乳癌淋巴结转移与肿块象限分布的关系
乳腺癌中以外上象限发生率最高,占所有乳腺癌的40.1%,淋巴结转移率最高为中央区,为100%(2/2),其次为全乳腺(6/7,85.7%),与Wu等[11]的结论一致;中央区转移率最高,入组患者中有2例患者肿块位于中央区,且均发生淋巴结转移(100%)。其原因可能与乳腺的淋巴结引流有关,正常乳腺的淋巴结引流分为内乳区和腋窝两组[12],同侧腋窝淋巴结引流乳腺75%淋巴液,剩余25%的淋巴结液由内乳淋巴结引流[13]。而乳腺中央区淋巴引流主要与外引流相关,即乳头乳晕区肿瘤可通过周围的毛细淋巴管直接进入到腋窝淋巴系统,由浅层到渗出,运输、定植到淋巴结的路程较近,转移的肿瘤细胞消耗相对减小,死亡数目减少,最终到达转移淋巴结处的肿瘤细胞相对更多,从而增殖更快造成转移淋巴结[14];其次是乳腺多发肿块者,转移率为85.7%(6/7)。
3.2 肿块型乳腺癌淋巴结转移与T分期、组织学分级的关系
入组的患者中T分期及组织学分级越高,转移率越高,与病理报道相符。病理上T分期反映的是乳腺癌浸润灶的大小,而组织学分级主要反映肿瘤的异质性程度,乳腺癌肿块的浸润程度越深,组织学分级越高,肿瘤侵犯淋巴结结转移的机会增加。本组研究显示所有入组患者中T2期的患者最多(73/177,41.2%)。当T2期时淋巴结转移率为52.1%,T3为70%(7/10),T4时高达84.6%(11/13),因此随着T分期增加,乳癌发生淋巴结转移的风险增加。
组织学分级以Ⅱa期最多(47/177,26.5%),0至Ⅰa期时未发现有淋巴结转移,Ⅱa期时为21%(10/47),Ⅱb时为53.1%(17/23),Ⅲa、Ⅲb、Ⅲc、Ⅳ均为100%。肿瘤组织学分级越高越容易发生淋巴结转移,其中≥Ⅲ期均发生淋巴结转移,与王宝娜等[9]报道的结果一致。
3.3 肿块型乳腺癌淋巴结转移与分子分型的关系
在分子分型上,Luminal B型在所有乳癌中最为多见,占41.8%,占转移组的44.8%,与王锡宏等[15]的研究一致;与李双等[16]报道的Luminal B型和Her-2型乳腺癌腋窝淋巴结转移数目越多的结果不符。本次研究未发现乳腺分子分型与肿块型乳腺导管癌淋巴转移的关系。
3.4 肿块型乳腺癌淋巴结转移与MRI动态曲线、ADC值的关系
既往江森等[17]及文洁等[18]研究证实,MRI动态增强曲线及ADC在鉴别乳腺良恶性病变存在重要价值。而Xing等[19]报道的ADC值可以鉴别转移性及非转移性淋巴结,但不能用于鉴别乳腺癌原发肿块是否发生淋巴结转移。本研究结果显示:在肿块型乳腺导管癌患者中,ADC及动态曲线类型(图1A、1B,图2A、2B)不存在统计学差异,ADCmean值在A组和B组分别为(0.95±0.28)mm2/s、(0.94±0.28)mm2/s,与张卫等[20]报道结果相符。原因是所有入组的乳腺癌均为肿块型乳腺导管癌,ADC值是肿瘤组织中水代谢的直接反应,同时与水分子扩散能力正相关[21],本次研究未能揭示ADC值在乳腺肿块与淋巴结转移的关系,可能原因是入组的病例较少。而本研究结果显示:同种病理类型的乳腺癌动态曲线也存在差异,肿块型乳腺导管癌中动态曲线以平台型最常见,而流入型最少见。而与淋巴结转移无统计学差异,与张肖[22]的研究结果一致。
综上,乳腺肿块的象限分布、T分期、组织学分级可以作为评价乳腺导管癌淋巴结转移的有用指标,可以为临床制定个体化治疗提供依据。
作者利益冲突声明:全体作者均声明无利益冲突。

