基于治疗前磁共振成像列线图预测鼻咽癌新辅助化疗疗效的初步研究
郑德春,许淑桂,赖国静,陈加优,任旺,陈韵彬
新辅助化疗(neoadj uvant chemot her apy,NAC)联合三维适形调强放疗是当前治疗中晚期鼻咽癌(nasophar yngeal car cinoma,NPC)的国人首选治疗模式之一。一项对6个临床试验的Met a分析显示,新辅助化疗不仅可以使约5.8%的鼻咽癌患者的5年总生存率获益,同时还能降低远处转移率,相对风险比为69%[1]。然而,研究表明新辅助化疗2周期后鼻咽肿瘤的退缩率差异很大,约45%的患者在新辅助化疗后获益不理想,肿瘤最大径退缩小于30%,疗效评估仅为稳定[2]。目前观点认为,肿瘤内部的异质性是影响化疗敏感性和疗效的主要因素之一。
影像组学方法是研究肿瘤异质性的新方法,它采用计算机技术原理无创性地提取医学影像图像上的高通量纹理特征,通过对这些特征进行筛选和构建模型,从而达到评价肿瘤异质性、评估肿瘤生物学特征等目的。目前已有学者应用影像组学方法在胶质瘤、直肠癌等方面开展了许多研究,取得了良好的效果[3-4]。基于MRI图像的影像组学纹理特征构建的模型可用于预测直肠癌新辅助放化疗疗效、基因突变状态等[4-5]。然而,各不同研究在预测模型的可重复性、准确性和稳定性等方面存在较多差异,有待于进一步研究。
本研究旨在构建立一个基于治疗前MRI纹理特征的列线图模型,探讨其预测鼻咽癌新辅助化疗疗效的应用价值。
1 材料与方法
1.1 临床病例资料
本研究回顾性收集2017年6月至2019年3月在我院收治的213例中晚期鼻咽癌患者(年龄15~77岁,中位年龄46岁)。本研究获得了我院伦理委员会的批准,所有参与研究的受试者签署了知情同意书。入组标准:(1)经病理证实的临床Ⅱ~Ⅳ期(UICC/AJCC第7版)鼻咽癌初诊患者;(2)拟行NAC联合三维调强放疗的治疗方案;(3)卡氏评分(kar nof sky perf or mance st atus,KPS)≥70,能够耐受化疗;(4)关于MRI检查时间的规定:治疗前MRI在住院后7 d内完成,化疗后MRI在第2周期末完成并用于疗效评价。排除标准:(1)Ⅰ期鼻咽癌患者;(2)MRI图像质量不佳;(3)未采取本研究所规定的治疗方案。
所有入组患者均接受每21 d为一个周期的“铂类+紫杉醇”化疗方案。用药方法如下:顺铂(中国山东省齐鲁制药有限公司)100 mg/m2ivgtt第1~3天+紫杉醇(海南中化联合制药工业有限公司)135 mg/m2ivgtt第1天。患者完成新辅助化疗后继续接受根治性调强放射治疗。
在本研究中,22例患者被剔除出组,包括:10例(4.7%)为Ⅰ期,6例(2.8%)有明显假牙伪影,5例(2.3%)接受同步放化疗方案。最后,共191例(89.6%)NPC患者纳入本研究。
1.2 临床因素收集和疗效评估
收集入组患者的年龄、性别、组织学WHO病理分型、TNM分期、鼻咽癌原发灶的最长径(l ongest diamet er,LD)和最短径(shor test diamet er,SD)等8个临床因素纳入统计分析。
临床疗效评价采用实体瘤治疗疗效评价标准(response eval uation criteria in sol id tumors,RECIST)[6]。根据化疗前与化疗后MRI所测得的鼻咽原发灶最大层面上最大径的变化率将化疗疗效分为:完全缓解(compl et e response,CR),在MRI鼻咽部肿块基本退缩且黏膜厚度小于5 mm,鼻咽镜检查未见明显异常;部分缓解(par t ial r esponse,PR),退缩率大于30%;疾病稳定(st abl e disease,SD),退缩率小于30%。本研究中无疾病进展的病例。在新辅助化疗第2周期末和放疗前进行疗效评估:将PR和CR的患者定义为有效组,将SD组定义为无效组。
1.3 MRI检查
采用3.0 T超导型磁共振成像仪(Achieva 3.0 T TX,Phil ips Medical Systems,The Net her l ands)进行MRI检查,接收线圈为16通道头颈联合神经血管线圈。本研究以患者的横轴位T2WI脂肪抑制(T2 weighted imaging with f at suppression,T2WI_FS)平扫和增强T1WI(T1 weighted imaging with contrast enhance,T1WI_CE)序列图像作为研究序列。主要成像参数如下:TR/TE:6000/70 ms(T2WI_FS),550/8.1 ms(T1WI_CE);本研究中T2WI_FS和T1WI_CE的几何参数一致,FOV为240 mm×230 mm,矩阵为232×219,空间分辨率为0.25 mm×0.25 mm×5.0 mm,层厚/层间距为5/1 mm。对比剂Gd-DTPA[马根维显(Magnevist),拜耳先灵,德国柏林]的用量为0.1 mmol/kg,注射速率为2 mL/s。
1.4 MR图像分割
将所有入组患者的MRI图像以DICOM格式从图像存储与传输系统中导出,采用ITK-SNAP软件(www.it ksnap.or g,ver sion 3.6.0)进行图像分割。由2名头颈诊断经验丰富的高年资主治医师盲法在T2WI_FS图像上手动逐层勾画鼻咽癌原发灶,从而获得原发灶的三维容积感兴趣区(vol ume of int er est,VOI),并在T1WI_CE序列的肿瘤最大层面上测量治疗前、化疗后鼻咽原发灶的LD和SD;由于T1WI_CE和T2WI_FS的几何参数一致,故直接将该VOI复制到T1WI_CE序列,然后再通过该软件进行VOI确认,使用该方法所有病例均能包括T1WI_CE序列上的肿瘤病灶。本研究的流程如图1所示。
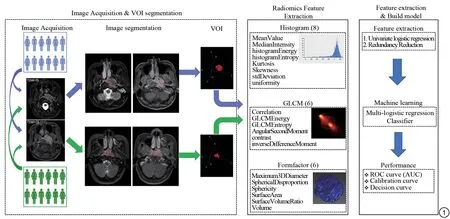
图1 工作流程图。工作流程中包括3个主要步骤:第一步是MRI图像的采集、鼻咽癌原发灶VOI的勾画。第二步是T2WI_FS和T1WI_CE序列的影像纹理特征的提取。第三步是数据分析,包括临床数据的单变量逻辑回归分析和影像纹理特征降维分析;机器学习和模型构建;进行诊断效能分析Fig.1 Workflow.This study included three main steps:Firstly,acquisition of MRIand segmentation of nasopharyngeal carcinoma by mean of volume of interest(VOI).Secondly,features extraction of T2WI_FS and T1WI_CE.Thirdly,data analysis,which included univariate logistic regression and redundancy reduction of imaging features,model construction by machine learning,and performance evaluation.
1.5 影像组学的纹理特征的提取
本研究使用GE公司开发的人工智能软件(Ar t if icial Int el l igence Kit V3.0.0.R,GE公司)进行MRI纹理特征提取。分别从T2WI_FS和T1WI_CE两个序列中提取180个纹理特征,包括直方图特征(n=42)、纹理特征(n=18)、形态学特征(n=9)、灰度级共生矩阵(n=40)、灰度级长度矩阵(n=60)和灰度区域大小矩阵(n=11)。
在使用机器学习模型对纹理特征进行降维分析之前,用Z-scor es法对患者的所有纹理特征的数学值进行标准化,以消除这些纹理特征的单位限制。Z-scor es=(x-μ)/σ,其中x为纹理特征的数学值,μ表示该特征在全体入组患者的平均值,σ为对应的标准差。
1.6 模型建立和统计学分析
统计分析使用SPSS软件和R编程语言(3.5.2版本)进行。不同疗效组之间的临床因素差异分析,数值变量根据数据正态分布检验结果采用独立t检验或Mann-Whit ney U检验,分类变量采用卡方检验。
将受试者按7∶3的比例随机分为训练组(training cohort,TC)和验证组(val idation cohort,VC),即134例归为TC组,57归为VC组。依次使用最大相关最小冗余(maximumrel evance minimumredundancy,mRMR)算法和LASSO(l east absol ut e shr inkage and sel ect ion oper at or)算法对TC组中T1WI_CE和T2WI_FS的360个纹理特征进行降维分析[7-8]。首先,采用mRMR方法去除TC组中冗余和无关的纹理特征,仅保留前20个纹理特征。然后,采用LASSO算法进一步选出最优特征子集,用于构建模型。计算出每个患者肿瘤原发灶的Radscor e:Radscor e由LASSO所选择的纹理特征的线性组合及每个特征所对应的加权系数计算出来。其次,通过多变量Logi st ic回归构建基于临床因素和Radscor e的预测模型。通过ROC曲线分析来评价和比较影像组学模型(r adiomics,仅Radscor e)、临床模型(cl inics,仅临床因素)和Radscor e与临床因素相结合的列线图模型三者之间的预测能力,计算出诊断准确度、ROC曲线下面积、敏感度、特异度、阳性预测价值(posit ive pr edict ion val ue,PPV)和阴性预测值(negat ive pr edict ion val ue,NPV)。最后,获得列线图、ROC图、校准曲线图(衡量预测NAC响应概率与实际的NAC响应概率的一致性),并通过Hosmer-Lemeshow检验获得预测模型的拟合优度和决策曲线来对这3种模型进行评价。在VC组中验证相对应模型的稳定性和实用性。P<0.05认为差异具有统计学意义。
2 结果
2.1 临床结果
经过2个NAC治疗,191例患者中有90例归为无效组,101例归为有效组,化疗有效率为52.9%,其中24例(12.6%)患者MRI评估达到CR。本研究中,除T分期(P=0.046)外,无效组和有效组之间的其他临床因素差异均无统计学意义(P>0.05)(表1)。
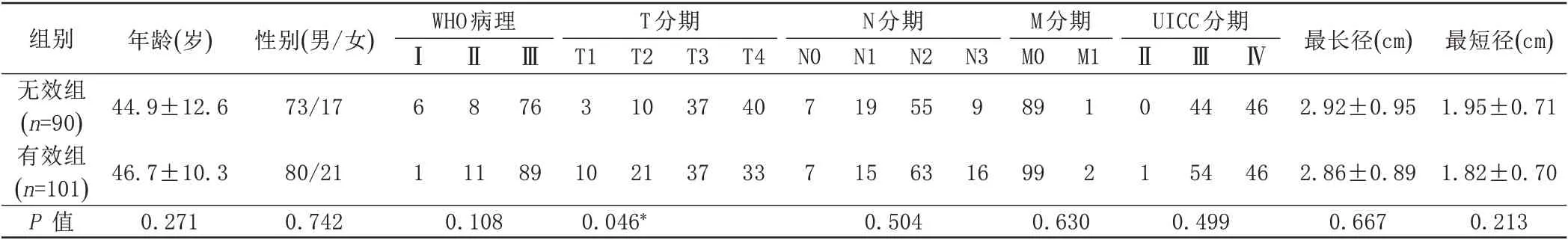
表1 有效组与无效组之间患者临床特征差异分析Tab.1 Characteristics differences between responders and non-responders NPC
2.2 列线图模型的构建
首先,通过mRMR方法在T2WI_FS和T1WI_CE两个序列的360个纹理特征中筛选了出20个纹理特征(图2A),然后采用LASSO算法(图2B)进一步优化,又剔除了3个因素,最终保留17个纹理特征(图2C)。接着计算每个患者的Radscor e,其公式为:Radscor e=-0.814×F1+(-0.749)×F2+(-0.625)×F3+(-0.545)×F4+(-0.464)×F5+(-0.361×F6)+(-0.186)×F7+(-0.065)×F8+(-0.02)×F9+(-0.012)×F10+0.036×F11+0.082×F12+0.121×F13+0.164×F14+0.315×F15+0.401×F16+0.525×F17+0.213(式中用图2C中的F1、F2、…F17代替各纹理特征的全名)。
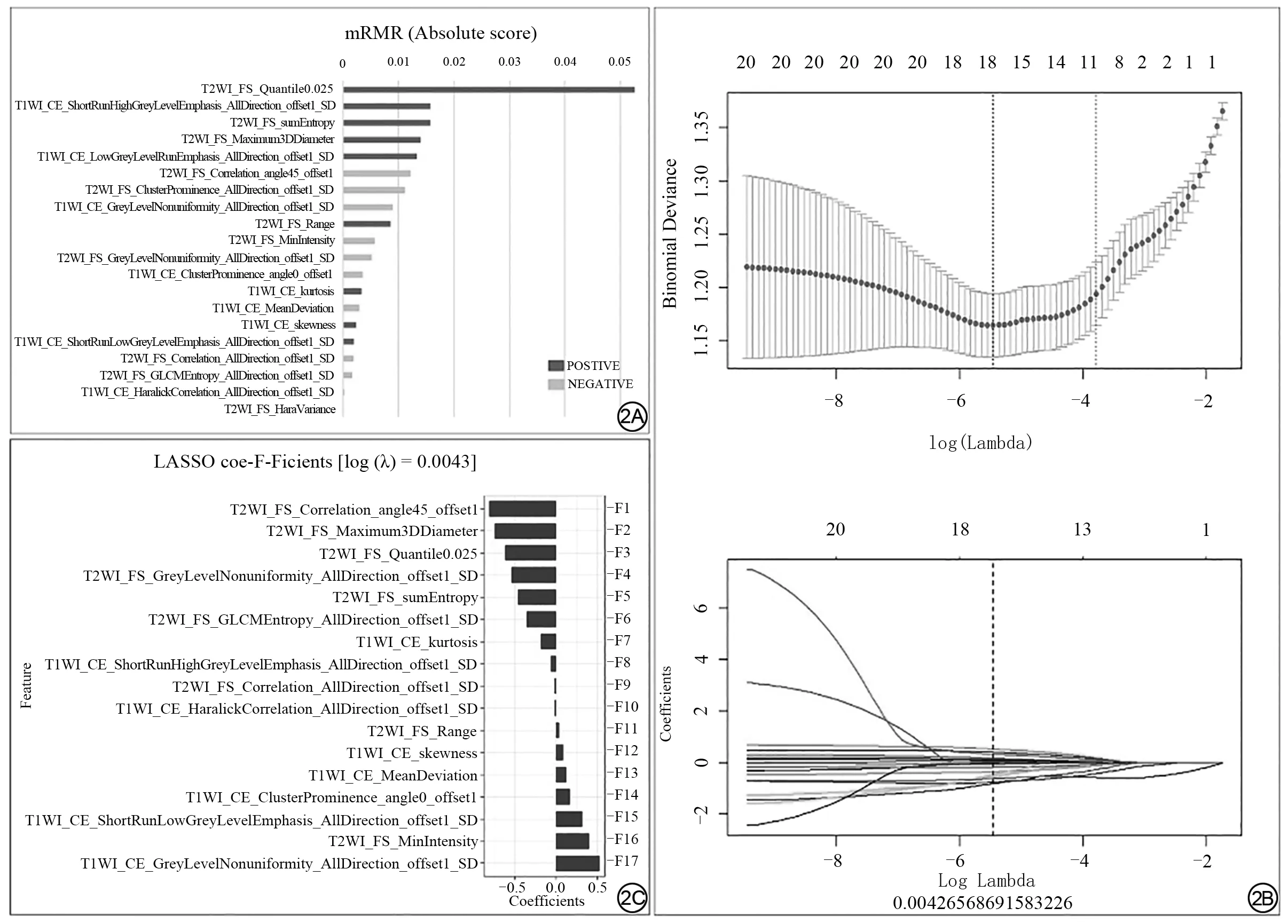
图2 影像纹理特征降维分析。最大相关最小冗余(A)和LASSO算法降维分析(B、C)Fig.2 Redundancy reduction of imaging features.Maximum relevance minimum redundancy(mRMR)(A)and least absolute shrinkage and selection operator(LASSO)analyses(B,C).
对8个临床因素做序贯单变量和多变量逻辑回归分析表明(表2):T分期和N分期两个临床因素可用于与Radscore构建列线图,预测新辅助化疗疗效(P<0.10)。
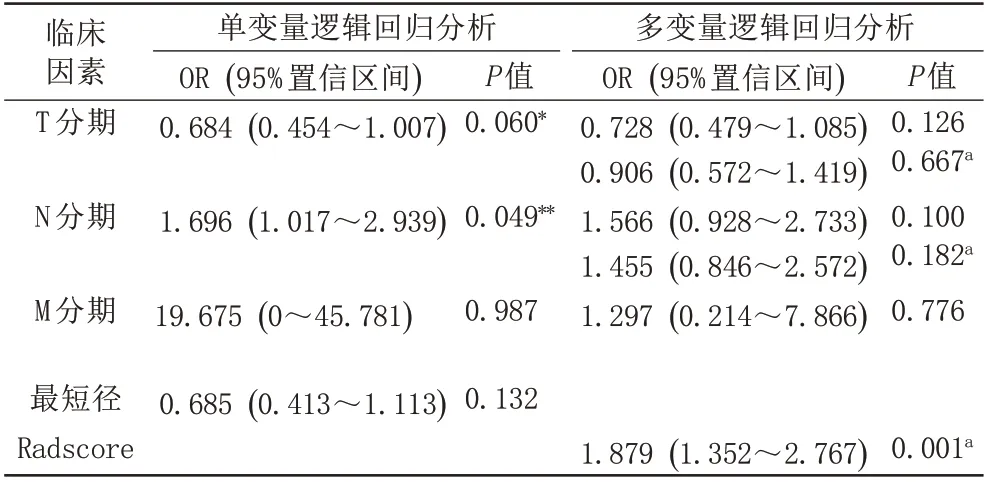
表2 临床因素预测鼻咽癌新辅助化疗疗效的逻辑回归分析Tab.2 Logistic regression analyses of clinical factors for predicting NACresponse in NPC
2.3 模型预测新辅助化疗疗效的效能分析
在本研究中,影像组学模型、临床模型、列线图模型预测鼻咽癌新辅助化疗疗效的诊断效果归纳于表3。通过在TC组中构建基于Radscor e与临床预测因子的列线图模型,本研究验证了基于治疗前MRI影像组学构建的模型评估NAC治疗反应的能力和潜在优势,并且对其可靠性和稳定性进行验证(图3)。
研究结果表明,列线图模型和影像组学模型在区分有效组和无效组患者的整体诊断效能适中,TC组的曲线下面积均为0.72(95%CI:0.63~0.81)。在VC组中,二者的曲线下面积分别为0.72(95%CI:0.59~0.85)和0.77(95%CI:0.74~0.89)。在TC组中,列线图模型预测新辅助化疗疗效的准确度高于临床模型(0.687 vs.0.604)。与单纯的影像组学模型相比,将影像学纹理特征与选定的临床因素相结合后的列线图模型在预测NAC治疗反应的诊断准确度略有提高(0.687 vs.0.679)。来自T1WI_CE和T2WI_FS的纹理特征对预测NAC疗效均有贡献,尽管各纹理特征之间的权重系数存在差异。在TC和VC组中,列线图模型的敏感度、特异度和NPV均大于临床模型(表3);在VC组中,列线图模型的PPV亦大于临床模型(0.733 vs.0.667,表3),而在TC组则不然。
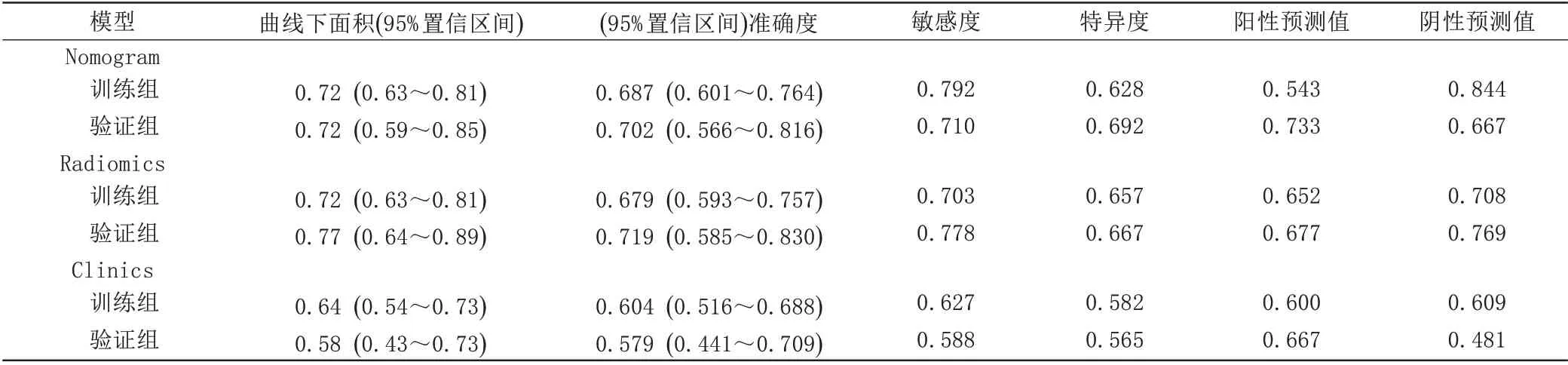
表3 列线图、影像组学、临床模型预测鼻咽癌新辅助化疗疗效的诊断效能Tab.3 Performance of nomogram,radiomics and clinics models in assessing NACresponse in NPC
列线图模型的校准曲线在训练和验证组中呈现出良好的校准性(图3D),说明TC组中列线图模型用于判断鼻咽原发灶经NAC治疗后预后不良的预测率和实际概率均较好。决策曲线进一步明确:在高风险阈值大于0.4水平时,基于治疗前MRI的列线图模型为预测中晚期鼻咽癌患者NAC疗效反应提供了关键值(图3C)。
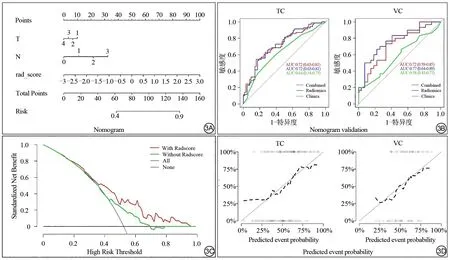
图3 诊断效能分析。列线图构建(A)、训练组(TC)和验证组(VC)中影像组学模型、临床模型和列线图模型三者的工作者特征性曲线(B)、决策曲线(C)、TC和VC对应列线图的校准曲线(D)Fig.3 Performance analysis.Constructed nomogram(A),receiver operating characteristic curves(ROC)analyses of the radiomics,clinics and nomogram models in training cohort and validation cohort(B),decision curve of nomogram(C),calibration curve(D).
3 讨论
新辅助化疗是局部中晚期鼻咽癌患者治疗的重要环节之一,鼻咽癌患者对新辅助化疗的反应与其远期疗效预后有关。本研究结果显示,完成2周期新辅助化疗后,52.9%的患者(101/191)疗效评定为治疗有效,这与Wang等[9]报道的鼻咽癌新辅助化疗有效率58.3%比较接近。有研究表明,鼻咽癌对NAC的治疗反应是无病生存、无局部区域复发生存、总生存的独立预后因素(P<0.03)[10-11]。然而,高达23%的鼻咽癌患者并没有从NAC中受益[10,12]。因此,建立一个可在治疗前预测肿瘤NAC治疗疗效的方法显得极其重要。这可让一部分患者免于接受无效的NAC,为患者选择和接受其他替代疗法提供依据,从而有望提高治疗效果并减少经济负担和心理负担[13]。尽管已有研究表明功能MRI技术在这方面具有潜在的应用价值[14-15],但采用功能MRI技术预测疗效需要额外的扫描序列和复杂的后处理分析。本研究表明,列线图模型预测鼻咽癌NAC疗效的诊断AUC为0.72(0.63~0.81)。今后,有望通过常规序列纹理特征构建出可靠的预测模型来预测鼻咽癌患者对NAC的疗效,代替功能MRI技术[3,9]。
联合多参数MRI放射组学方法能够对疾病的不同生物学特征进行分析,从而具有更好的诊断疾病、指导治疗和预测预后的潜能。本研究成果发现从T2WI_FS和T1WI_CE提取的纹理特征对预测NAC疗效的Radscor e均有贡献。既往的研究报道也表明,联合多参数MRI预测鼻咽癌患者化疗反应[9]或远期生存预后[16]的准确度、敏感度和特异度均有提高。此外,有研究报道,根据Har r el l’s一致性指数(concor dance index,C-index),影像组学方法鉴别不同生存亚群的能力优于T期(0.815 vs.0.803)和TNM分期系统(0.842 vs.0.765)[17]。在另一项回顾性影像组学研究中,研究者采用LASSO算法方法只在T1WI_CE序列的纹理特征建立了预测模型,而其他序列T2WI_FS、T2WI、T1WI的纹理特征并不能构建出预测NAC疗效的模型[9]。这种不一致性可能与该研究的设计有关,他们仅对MRI图像进行了简单的二维分析,有待于未来作进一步评估。
放射组学也在许多实体肿瘤中都得到了研究和验证[18-20]。值得注意的是,随着实体肿瘤类型的不同和研究设计的不同,相应所构建的影像组学模型之间的诊断准确度存在一定的差异[18]。本研究发现列线图模型优于单独使用影像组学或临床模型。这和一项近期发表的评估PET-CT预测鼻咽癌预后价值的研究一致,他们的成果表明联合临床因素、PET和CT纹理特征可以改善一致性指数,联合使用时的C-index范围为0.71~0.76,而单独使用时的范围为0.67~0.73[19]。另一项采用影像组学预测原发性直肠癌存在同步肝转移的研究成果显示其总体预测效能在训练组高达0.921,在验证组亦达0.912,结果达到了临床应用转化的水平[20]。开展多中心研究可以验证多参数和(或)多模态成像技术构建的影像组学模型的诊断效能和稳定性。一项收集了中国4家医疗机构的586例乳腺癌患者的回顾性研究率先报道了基于多中心的研究成果,该研究以预测乳腺癌新辅助化疗后手术病理证实CR状态为观察指标,其所构建的放射组学模型在训练组中其预测准确度为0.86,在另外3个外部验证组中对应的预测准确度也大于0.7[4]。尽管针对不同的肿瘤和研究目的所构建的诊断模型均明确了影像组学在肿瘤领域具有独特的应用价值,然而其诊断准确度存在一定的差异。来自文献报道的所用于构建模型的影像学纹理特征亦存在明显不一致性[4,8-9,16-21]。一项对17篇乳腺肿瘤影像组学的回顾分析发现,当前用于影像组学研究的软件及算法也存在广泛的多样性,这也将导致不同研究结果难以进行比较[22]。因此,在肿瘤领域影像组学的研究应用还有待于进一步深入,以保证诊断模型的准确度、敏感度和特异度等可以满足临床实际应用的需要。
本研究存在一些局限性。首先,本回顾性研究的两个序列层厚为5 mm,理论上这对所提取病灶的二阶和高阶影像纹理特征数值会产生一定的影响。其次,本研究未包括鼻咽癌的其他序列图像,特别是扩散加权成像的表观扩散参数图像。这主要是因为鼻咽颅底区的扩散加权成像经常存在程度不等的磁敏感伪影、图像变形。最后,本研究未对鼻咽癌患者的颈部转移性淋巴结同时开展有关研究,这部分内容仍具有一定的挑战。
总之,基于治疗前MRI的列线图模型预测鼻咽癌新辅助化疗疗效的价值优于临床模型。将来尚需要开展基于三维薄层的MRI的放射组学研究,并建立适用于研究颈部转移性淋巴结的预测模型以明确其预测转移性淋巴结治疗疗效的效能,最终构建一体化预测模型,明确建立放射组学方法在鼻咽癌疗效评估中的应用价值,最终达到提高鼻咽癌的临床管理的目的。
作者利益冲突声明:全体作者均声明无利益冲突。

