子宫内膜纤维化的MRI表现
冯永静,姜佩佩,周楠,胡清,孙双双,胡娅莉,周正扬*
育龄期女性不孕的发病人数在逐年上升,其中以继发性不孕最为常见,主要原因为机械损伤和感染[1]。宫腔损伤可导致子宫内膜纤维化[2],使内膜厚度变薄,血管发育不良,且宫腔损伤通过纤维化进行愈合,会导致子宫腔的收缩并加剧子宫内膜的破坏,最终导致正常解剖结构的破坏,使子宫内膜容受性降低,使胚胎难以着床,导致不孕、流产或植入失败[3-4]。及时评估子宫内膜纤维化并进行抗纤维化治疗有助于子宫内膜的重建和修复[5-6]。MRI由于其对软组织显像的优越性,可以通过无创的方式明确分辨子宫的各解剖层,通过多方位动态成像实现子宫结构和轮廓的可视化。本研究的目的是探究子宫内膜纤维化引起的子宫结构改变在MRI上的表现,协助临床整体把握子宫内膜纤维化引起的子宫结构改变。
1 材料与方法
1.1 一般情况
从2018年9月至2020年1月,本研究前瞻性纳入了53例经宫腔镜检查证实子宫内膜纤维化的不孕症患者,年龄27~43岁,平均(33.6±3.9)岁。并招募34名健康的育龄期女性作为健康对照组,年龄24~35岁,平均(28.4±3.4)岁。本研究经过医院伦理委员会的批准(批准文号:2019-051-01),所有参与者都签署了书面知情同意书。
患者的纳入标椎:①临床有过刮宫史或宫腔粘连分离术病史,宫腔镜下看到子宫内膜的瘢痕组织;②没有其他严重的子宫疾病,如较大的子宫肌瘤、子宫内膜结核或严重的先天性宫腔畸形;③卵巢功能正常;④在月经周期的围排卵期,超声提示有优势卵;⑤没有MRI检查禁忌证,如心脏起搏器、人工耳蜗、幽闭恐惧症等。
志愿者的纳入标椎:①月经周期及月经量正常的育龄期女性;②没有子宫疾病,如子宫腺肌症、子宫肿瘤和宫腔感染等;③没有流产、刮宫和其他宫腔损伤的病史;④在月经周期的围排卵期,超声提示有优势卵;④没有MRI检查的禁忌证。
1.2 检查方法
所有的扫描均在一台3.0 T的MRI仪器(Ingenia,Phil ips Heal t hcar e,Best,t he Net her l ands)上进行,使用16通道体部线圈,采取仰卧位头先进。志愿者及入组患者在进行MRI检查前需排空膀胱,以避免膀胱过度充盈引起的运动伪影。扫描序列包括矢状位T2加权成像[TR=1700~5000 ms,TE=100 ms,矩阵大小=200×166,扫描野=120 mm×120 mm,层厚=3 mm,层间距=0.3 mm,信号平均次数(number of signal averaged,NSA)=1.1];冠状位脂肪抑制T2加权成像(TR=3000~5000 ms,TE=80 ms,矩阵大小=200×167,扫描野=120 mm×120 mm,层厚=2 mm,层间距=0.2 mm,NSA=2)。
1.3 图像分析
所有的图像由两名放射科医生进行独立分析,他们对患者的临床信息都不知情。子宫内膜厚度(endometrial thickness,EMT)、结合带厚度(junctional zone thickness,JZT)及宫腔长径(l ength of uterine cavity,LUC)的测量是通过医院工作站的通信系统(picture achieving and communication system,PACS),在子宫矢状位T2加权图像的正中矢状面上进行。EMT的测量是测量垂直于子宫长轴方向的子宫内膜上下径长度,即子宫中央的内膜高信号区与肌层低信号交界处之间的距离,选取的是子宫内膜最厚的位置;JZT的计算是分别测量出子宫前壁、子宫后壁和宫底结合带的厚度,然后将其平均值定义为JZT;LUC的测定是测量宫底至子宫峡部的距离(图1)。并将两位放射科医生测量的数据的平均值作为最后的结果。
1.4 统计学分析
数据的统计分析使用SPSS 22.0软件。测定结果以均数±标准差表示,使用独立样本t检验对患者和正常志愿者之间的子宫解剖参数的差异进行统计学分析。使用二元Logist ic回归分析对单因素分析(独立样本t检验)有统计学意义的指标建立联合模型,使用ROC对各参数的诊断效能进行评价。使用Z检验对联合模型和解剖参数的AUC值(ROC曲线下面积)进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 子宫结构的改变
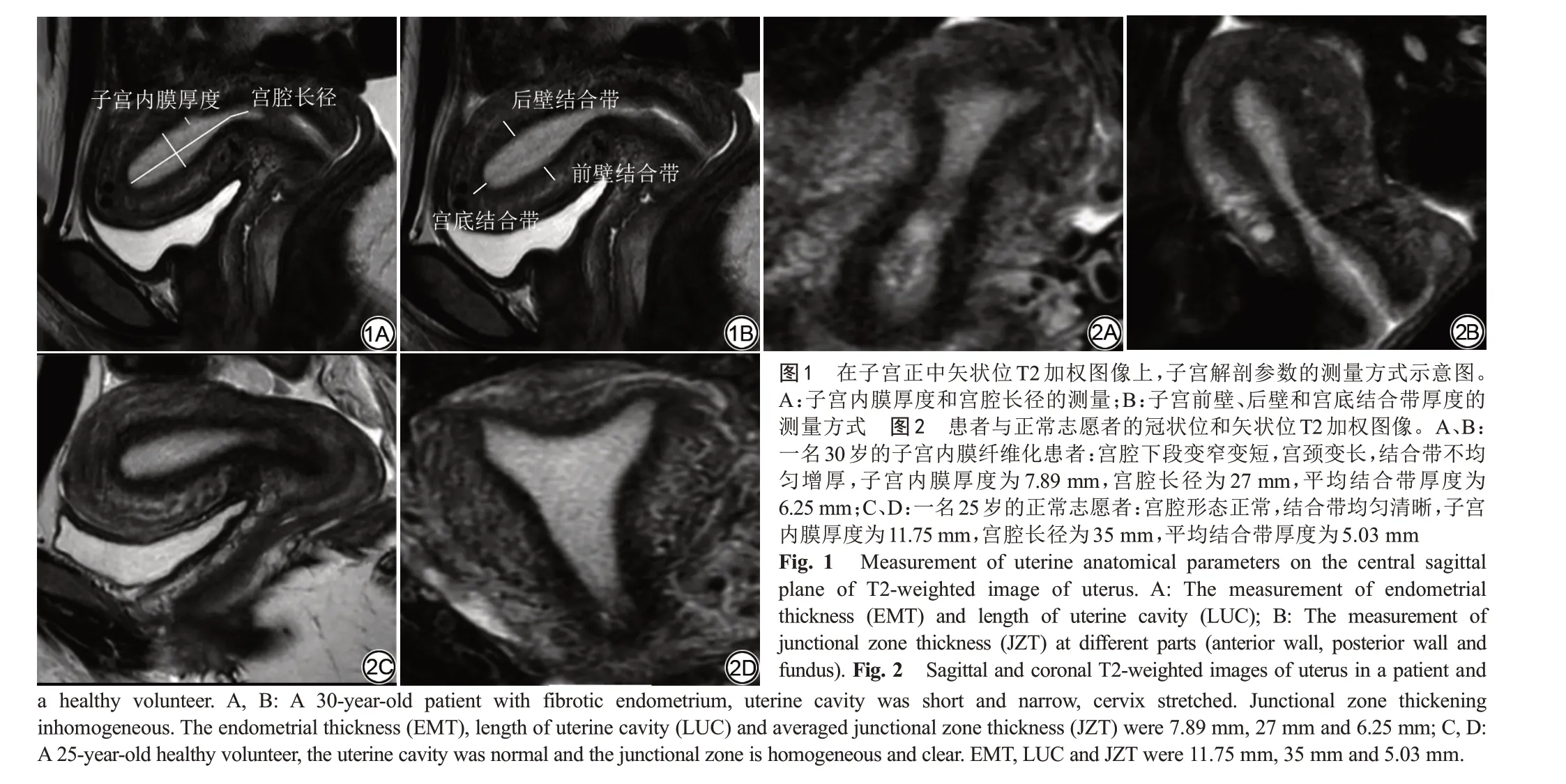
MRI可以对子宫结构进行整体评估。矢状位T2加权图像可以清晰地显示子宫的3层解剖结构。图2是一位患者和一位志愿者的T2加权图像。矢状位图像上可以看到子宫内膜纤维化患者的子宫内膜变薄、结合带增厚紊乱和宫腔缩短,冠状位可以更直观地显示出宫腔短缩,子宫下段变细变窄,宫颈拉长。患者和正常志愿者的子宫解剖参数的差异见表1。患者的EMT明显低于正常志愿者(P<0.01),患者的LUC明显低于正常志愿者(P<0.01),患者的JZT明显高于正常志愿者(P<0.01)。
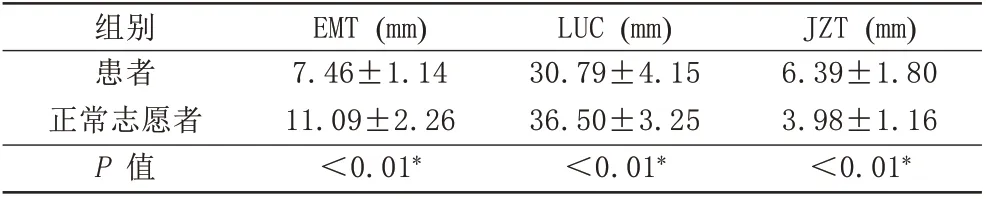
表1 患者和正常志愿者子宫解剖数据的差异Tab.1 Difference of uterine anatomical parameters between patients and healthy volunteers
2.2 解剖参数及联合模型对子宫内膜纤维化的诊断效能
使用二元Logist ic回归分析建立EMT、LUC和JZT相结合的联合模型。如表2所示,EMT、LUC、JZT及联合模型对子宫内膜纤维化均具有较好的诊断效能。联合模型的诊断效能明显高于单独参数,且差异有统计学意义(P均<0.05)。图3是联合模型的ROC曲线图。
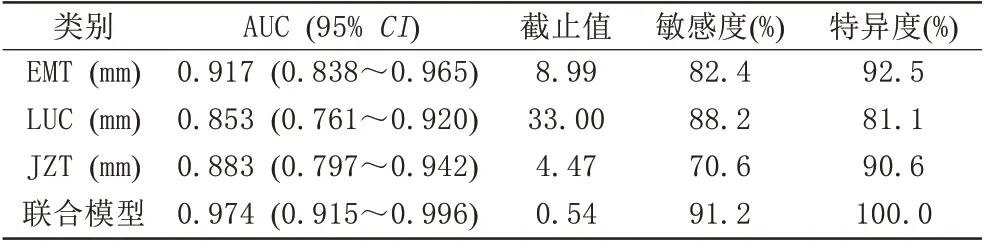
表2 EMT、LUC、JZT及联合模型评估子宫内膜纤维化的诊断效能参数Tab.2 Performance of uterine anatomical parameters and multivariate model in evaluating endometrial fibrosis

图3 EMT、LUC及JZT联合诊断子宫内膜纤维化的ROC曲线Fig.3 Receiver operating characteristic (ROC)analysis of the combination of EMT,LUCand JZT in diagnosing endometrial fibrosis.
2.3 宫腔镜下的子宫腔
宫腔镜可以看到宫腔表面的改变。患者的宫腔镜检查都可以看到苍白的子宫内膜和致密的纤维瘢痕组织布满整个宫腔。宫腔失去了原本的柔软性,变得僵硬没有弹性。图4是一名入组患者的宫腔镜图片。
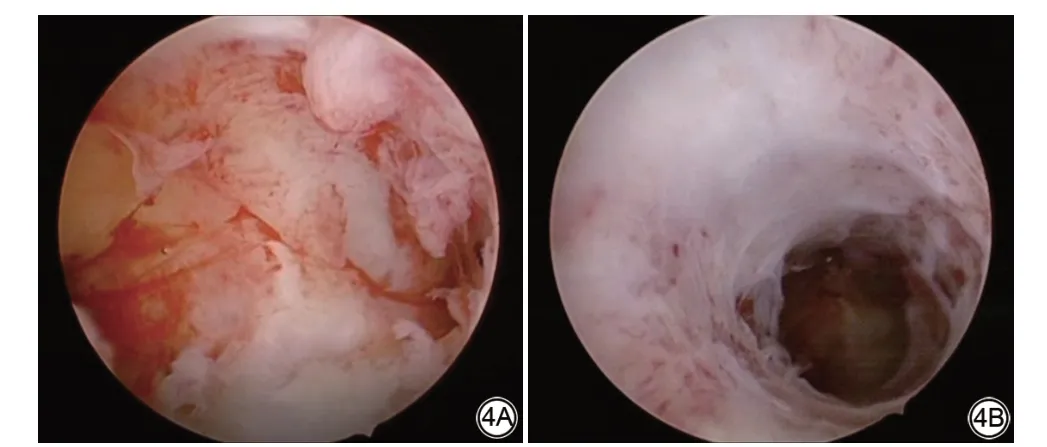
图4 一名患者的宫腔镜图片,可以看到宫底和子宫中下段宫腔内的瘢痕组织Fig.4 Hysteroscopy images of a patient.Dense fibrotic scar tissue can be seen on the bottom of uterine cavity and on the middle and lower of uterine cavity.
3 讨论
本研究发现与正常志愿者子宫相比,子宫内膜纤维化患者的子宫内膜厚度明显变薄,宫腔长径明显缩短,子宫结合带厚度明显增加,MRI检查可以更加直观地显示患者子宫整体形态的改变。因为正常子宫内膜厚度和结合带厚度在不同月经周期也会发生改变[7],而且有研究发现在月经周期的排卵期,结合带分区结构的边界最清晰[8],所以本研究中的所有参与者均在MRI扫描前进行了超声检查,提示存在优势卵后再进行MRI扫描,以确保所有参与者均控制在围排卵期的同时更优地显示子宫结构。
3.1 子宫内膜纤维化导致子宫内膜变薄,宫腔短缩
正常子宫内膜由基底层和功能层组成,靠近子宫肌层的1/3是基底层,是由腺体、致密的基质和血管形成,且含有子宫内膜间充质干细胞,会在功能层脱落后增生修复受损的内膜[9],维持子宫内膜上皮的动态平衡。所以当子宫内膜基底层受到损伤时,子宫内膜腺体减少,细胞外基质的沉积代替了正常的子宫内膜[10],子宫内膜上皮的增生修复受阻,使子宫内膜难以恢复到原来的厚度。外科手术、重复或剧烈的刮除会损伤子宫内膜的基底层,上皮直接暴露于外源性损伤,会发生上皮-间质转化,破坏上皮的稳态性,导致局部组织重塑和功能障碍[11]。子宫内膜上皮细胞再生延迟,丢失的基质被纤维组织取代,允许活性成纤维细胞和结缔组织形成,导致子宫内膜内纤维组织甚至是瘢痕组织的形成[5]。子宫内膜纤维化和瘢痕收缩也会激发组织重塑变形,导致子宫腔的短缩和扭曲[3]。由于肌成纤维细胞的收缩和血管系统的减少,纤维化器官通常表现出不平坦的表面,苍白并缺乏弹性[12]。Bu等[13]的研究发现,在EMT很薄的情况下,尤其是宫腔内有较多纤维瘢痕组织时,宫腔镜下的子宫内膜苍白,血管稀疏,子宫内膜的血液供应不足,会影响胚胎的植入和子宫内膜基质细胞的蜕膜化。Yuan等[14]的研究表明子宫内膜厚度是体外受精(in vitr o f er t il izat ion,IVF)治疗后宫内妊娠、异位妊娠、自然流产和活产的重要且独立的预测因子。正常的子宫内膜表达许多细胞粘附分子(包括整合素、选择素和钙粘蛋白),是胚胎植入需要的细胞分子,被称为“植入标记物”,当细胞内膜受损,缺乏特定蛋白质的表达,细胞粘附分子的生成减少可能是导致植入失败的原因[15]。
3.2 子宫内膜纤维化导致结合带的异常增厚
子宫内膜纤维化患者的结合带增厚、紊乱。结合带是子宫肌层的内1/3,在MRI的T2WI图像上表现为低信号,与子宫内膜间的分界清晰,是显示结合带最佳的检查方式。子宫内膜下肌层的解剖破坏可以通过任何原因引起的交界区增厚来表现。当子宫内膜下肌层的结构受到损伤,会破坏子宫内膜-子宫肌层交界区的屏障功能,从而激活肌成纤维细胞而发生纤维化反应[16]。有研究发现子宫内膜纤维化患者的子宫肌层中也存在纤维组织沉积[6],可能是子宫内膜纤维化侵及子宫肌层组织,使子宫内膜-子宫内膜下肌层单位被破坏,造成了子宫内膜下肌层的病理性增厚和结构的紊乱[17]。这可能解释在磁共振图像上发现的结合带结构增厚、紊乱。排除子宫腺肌病的病史,结合带增厚紊乱可以作为子宫内膜纤维化的间接指标之一。
结合带的异常增厚或破坏影响人类生育力。最近有研究表明,结合带增厚可能与不孕和IVF成功率降低有关[17-18]。非妊娠子宫中传播的子宫肌层收缩起源于结合带[19],且这种收缩与生育力之间有着紧密的联系,增厚的结合带可能会影响子宫收缩力,从而阻碍精子运输或可能干扰胚胎植入[20]。此外,结合带与其覆盖的子宫内膜一起参与胎盘的形成。因此,这种胎儿-母体界面的子宫内膜-子宫肌层部分被命名为“胎盘床”。当损伤累及子宫内膜和内部肌层时,也会影响胎儿生长需要的血液供应[21]。结合带由致密区和过渡区组成,致密区与组织学上的黏膜下肌层相对应,是子宫内膜与子宫肌层的分界,当子宫内膜纤维化引起结合带的异常改变时,说明纤维化侵及子宫肌层,提示内膜纤维化的程度加深,对临床评估疾病严重程度有很好的辅助价值。
3.3 MRI评估子宫内膜纤维化的优势
本研究发现,EMT、LUC和JZT相结合的联合模型对子宫内膜纤维化的诊断效能高于单独参数,提示EMT、LUC和JZT联合诊断可进一步提高子宫内膜纤维化的诊断效能,具有重要的临床意义。宫腔镜下活检是检测子宫内膜纤维化的金标准,但其为侵入性检查,存在二次损伤的风险,而且存在取样误差,难以成为监测纤维化进展的理想方法[22]。而且宫腔镜检查只能观察到宫腔内的情况,无法对子宫的形态改变以及肌层的变化进行整体的把握。超声可以提示子宫内膜纤维化引起的子宫内膜变薄和宫腔形态改变,但是超声检查的主观性较强,图像不易保存,不利于监测和随访。而且超声上的结合带结构不如MRI清晰,MRI可以更好地评估子宫内膜纤维化对肌层造成的影响。
3.4 研究的局限性
首先,研究的样本量较少;其次,本研究只是对子宫内膜纤维化患者的子宫MRI形态学表现进行了整体的描述,没有根据患者内膜纤维化的严重程度进行分级评估,这将有待于进一步探索。
3.5 结论
总之,本研究探究了子宫内膜纤维化患者的子宫MRI表现。子宫内膜变薄、宫腔短缩表明子宫内膜纤维化引起了宫腔的组织重塑,间接反映子宫正常结构和功能的丢失。结合带增厚紊乱表明纤维化侵及子宫肌层,预示着纤维化程度的加深。MRI可以对子宫内膜纤维化患者的子宫整体形态的改变进行直观和动态地评估,方便临床随诊,可以协助临床医生掌握子宫内膜纤维化的疾病变化。
作者利益冲突声明:全体作者均声明无利益冲突。

