血清STNFR-Ⅰ的检测在肺癌患者中的应用价值研究
杨 蕾
山东省淄博市沂源县人民医院,山东 淄博 256100
近年来,受各种因素的影响致使肺癌发病率逐渐呈递增趋势,对人们的身体健康及生命安全造成严重威胁。在以往的临床诊断中主要采用神经元特异性烯醇化酶(NSE)以及癌胚抗原(CEA)作为肺癌患者血清检测的标志物,但随着应用的深入而发现,上述标志物检测的敏感性相对较低,使得其临床应用效果存在一定限制[1]。肿瘤坏死因子(TNF)属于多功能细胞因子的一种,因可溶性肿瘤坏死因子受体(STNFR)保持与TNF结合的特性,使得其生物学功能逐渐受到临床工作者的广泛关注[2]。本研究经过对肺癌患者进行血清STNFR-Ⅰ检测,进而探讨其价值。报道如下。
1 资料与方法
1.1一般资料 取2019年1月-2019年12月因肺癌来我院接受治疗的78例患者为研究组,并选取同时期来我院体检的78名健康者为对照组。研究组男46例,女32例,年龄45-79岁,平均(61.1±10.5)岁,组织病理学分型:肺泡细胞癌9例,腺癌24例,鳞癌32例,小细胞未分化癌13例。TNM分期:Ⅰ期5例,Ⅱ期18例,Ⅲ期26例,Ⅳ期29例。对照组男49名,女29名,年龄43-80岁,平均(61.4±10.7)岁。两组人员基本资料无显著差异(P>0.05),入选人员均知情并同意本研究,且该研究已获得伦理委员会准许。
1.2方法 分别抽取两组人员空腹静脉血,经10min离心后取其血清,并放置于-40℃的环境中保存待测,利用酶标仪并采用酶联免疫吸附法检测其STNFR-Ⅰ水平,利用放射免疫法检测两组人员的血清CEA指标。其中STNFR-Ⅰ检测所用试剂盒由英国Amersham公司提供,而CEA检测试剂盒则由新传生物技术有限公司提供。上述操作均由同一组检验科人员严格按照相关要求执行,并准确记录其检测结果。
1.3观察指标 检测并比较两组人员及不同病理分期肺癌患者的血清STNFR-I及CEA水平,并比较其阳性率,上述指标的正常范围:STNFR-I,0.6-1.2ug/L;CEA<20ng/ml。
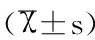
2 结 果
2.1两组人员血清STNFR-I及CEA水平对比 与对照组相比研究组的STNFR-I及CEA水平均较高(P<0.05),小细胞分化癌组的STNFR-I水平均高于鳞癌、腺癌及肺泡细胞癌组,(P<0.05),且STNFR-I检测的阳性率均高于CEA检测(P<0.05),具体见表1。
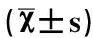
表1 比较两组人员血清STNFR-I及CEA水平
2.2不同分期肺癌患者的STNFR-I水平对比 Ⅰ期患者的STNFR-I水平水平及STNFR-I水平阳性率均低于Ⅱ、Ⅲ、Ⅳ期(P<0.05),且随着病理分期增加其检测的值与阳性率均呈递增趋势,具体见表2。

表2 比较不同分期肺癌患者的STNFR-I水平
3 讨 论
据研究表明,可溶性肿瘤坏死因子受体是借助细胞膜经由蛋白酶水解的一种肿瘤坏死因子受体片段,并在人体的各种液体中均有存在,与膜表面受体相互对应,主要以STNFR-I及STNFR-Ⅱ两种形式存在。STNFR能够与肿瘤坏死因子进行竞争性结合,当其与TNF进行有效结合后,能够导致TNF的生物学活性丧失,使其杀死肿瘤细胞的功能受到抑制[3]。此外,能够导致STNFR配体丧失,不能够对酪蛋白酶进行激活,降低机体细胞的免疫功能,促进肿瘤生长,进而使得机体对肿瘤逐渐失去控制。部分学者研究显示,STNFR在肿瘤患者中的血清升高情况不具备特异性,但在排除自身免疫性疾病以及炎症后,机体血清STNFR升高则表明其肿瘤病情发展,即使对于早期的肿瘤患者,与血清CEA升高情况比较,STNFR升高更为常见[4]。因此,对肿瘤患者进行血清STNFR检测,对其病情早期诊断、治疗方案的确立及预后评估等均具有至关重要的作用。经本研究显示:小细胞分化癌组的STNFR-I水平均高于鳞癌、腺癌及肺泡细胞癌组,且STNFR-I检测的阳性率均高于CEA检测(P<0.05);Ⅰ期患者的STNFR-I水平水平及STNFR-I水平阳性率均低于Ⅱ、Ⅲ、Ⅳ期(P<0.05),且随着病理分期增加其检测的值与阳性率均呈递增趋势。由此可见,肺癌患者血清STNFR-I检测的阳性率相对较高,且随着病理分期增加其指标逐渐呈递增趋势。据实验显示,肺癌患者机体内能量代谢情况失去平衡,其高代谢能量摄入及消耗情况降低,而蛋白消耗增加,导致患者体重降低,而上述高代谢低体重状态与机体全身性的炎症反应紧密相关,而STNFR-I作为机体中重要的炎性介质,能够有效参与高代谢与低体重的消耗过程。因此,STNFR-I指标伴随着患者病情加重而呈递增趋势。
综上所述,对肺癌患者进行血清STNFR-I检测,有助于对肺癌患者进行病情诊断,并采取针对性的治疗方案,同时可进行疗效及预后情况评估,临床应用价值较高。

