细菌脂多糖对甜味受体T1R2可变剪接与功能的调控作用
朱健慧 郑欣 彭显 徐欣 Robert Margolskee 周学东
1.口腔疾病研究国家重点实验室 国家口腔疾病临床研究中心四川大学华西口腔医院牙体牙髓病科,成都610041;2.Monell Chemical Senses Center,美国费城PA 19104
哺乳动物可感知甜、酸、咸、苦、鲜五种基本味觉,味觉感知对于个体摄取营养物质、鉴别有毒有害物质有重要意义[1]。味觉异常是以味觉改变为特征的疾病,处于味觉异常状态的患者容易出现食欲减退、营养不良、情绪消极等,严重影响生活质量[2]。近日研究[3]报道新冠肺炎患者出现味觉感知障碍或味觉丧失,提示微生物对味觉感知的重要影响。味觉异常的病因尚不明确,但口腔卫生状况不佳、牙周病等口腔局部微生物因素与味觉感知的变化具有相关性[4]。
味觉感受器中的味觉受体细胞被某些物质激活后,通过感觉神经将味觉信号传递至大脑相应区域,形成味觉感知。甜味受体属于G蛋白偶联受体(G protein-coupled receptors,GPCRs)C家族,为Ⅰ型味觉受体家族(taste receptor type 1,T1R)中的两种亚型T1R2和T1R3组成的异源二聚体,可被糖(葡萄糖、果糖等),人工甜味剂(糖精、安赛蜜等)及甜味蛋白(莫奈林、神秘果素等)等甜味配体激活产生甜味信号[5]。研究[6]表明,小鼠摄取脂多糖(lipopolysaccharide,LPS)后,对蔗糖的甜味敏感度显著降低,但其机制尚不明确。
可变剪接指来源于同一基因的前体mRNA经过不同方式的剪接,形成不同的成熟mRNA,进而翻译为结构、功能不尽相同的蛋白质。可变剪接是真核生物中广泛存在的转录后调控方式,具有重要的生物学意义[7]。LPS可通过调控Toll样受体下游分子MyD88编码基因的可变剪接影响其在炎症反应中的功能[8]。T1R2前体mRNA包含6个外显子和5个内含子,可能受到可变剪接调控,影响甜味感知功能。本研究旨在探究LPS对甜味受体可变剪接的影响,从转录后调控角度揭示口腔微生物感染引起味觉感知异常的可能机制。
1 材料和方法
1.1 主要试剂和材料
RNA提取试剂盒MiniBEST Universal RNA Extraction Kit、逆转录试剂盒PrimeScript™RT reagent Kit with gDNA Eraser、高保真DNA聚合酶Prime-STAR®Max DNA Polymerase、实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qPCR)试剂TB Green®Premix Ex Taq™Ⅱ、感受态细胞E.coliDH5αCompetent Cells(TaKaRa公司,日本),限制性核酸内切酶BamHⅠ-HF/NotⅠ-HF、T4连接酶(New England Biolabs公司,美国),无内毒素质粒小提中量试剂盒(北京Tiangen公司),lipofectamine 2000、标签抗体6x-His Tag Monoclonal Antibody(Thermo Scientific公司,美国),胎牛血清(fetal bovine serum,FBS)、DMEM培养基、添加钙镁的DPBS溶液(Gibco公司,美国),penicillin/streptomycin(P/S,Hyclone公司,美国),标签抗体Monoclonal ANTI-FLAG®M2 antibody(Sigma公司,美国),抗鼠荧光二抗Goat Anti-Mouse IgG H&L(Alexa Fluor®488/594,Abcam公司,英国),牛血清蛋白(bovine serum albumin,BSA)(BioFroxx公司,德国)。引物合成及DNA测序由北京擎科生物科技公司完成。
1.2 逆转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)
取8周龄C57BL/6J小鼠6只(雄性3只,雌性3只),使用颈椎脱臼法处死小鼠,体视显微镜下分离舌背包含味蕾组织的轮廓乳头、菌状乳头及叶状乳头,分别提取RNA,逆转录获得cDNA,RT-PCR扩增完整T1R2转录本(正向序列:5’-AAGGCTGTTACTTGGCTGGC-3’,反向序列:5’-GGTGGGTGGGACTAGCTCTT-3’),行琼脂糖凝胶电泳,对长度小于T1R2本构体的DNA片段行TA克隆,随机挑取单菌落测序。为进一步验证异构体表达,在异构体缺失序列上、下游设计引物(正向序列5’-CAGTGGAACTGGATCGTGGT-3’,反向序列5’-GCGTCACAGTCCTGGTTACA-3’),以前述cDNA为模板,PCR扩增异构体对应DNA片段,并通过琼脂糖凝胶电泳进行验证。
1.3 甜味受体异源性表达实验
1.3.1 质粒载体构建 RT-PCR扩增T1R2/T1R3本构体转录本、T1R2剪接异构体(T1R2_Δe3p)转录本,克隆至真核表达载体pcDNA3.1(+),测序验证序列无误。甜味受体信号通路下游G蛋白表达质粒Gα16-gust44-pcDNA3.1-hygro由Monell Chemical Sensens Center(费城,美国)提供。
1.3.2 细胞培养和转染 HEK293细胞在添加10%FBS和1%P/S的高糖DMEM培养基中培养。转染前将细胞接种至黑色透明底96孔板,按照lipofectamine 2000说明书操作,将等量T1R2本构体表达质粒和(或)异构体(T1R2_Δe3p)表达质粒、T1R3本构体表达质粒及Gα16-gust44表达质粒转染至HEK293细胞。
1.3.3 FlexStation 3检测 甜味受体功能转染48 h后,吸出培养基,加载终浓度为2.5μmol·L-1的钙离子荧光染料Fluo-4,避光孵育1 h后,再次DPBS漂洗,每孔加入50μL DPBS后避光孵育30 min。以DPBS为溶剂配制甜味配体溶液,其终浓度为蔗 糖100 mmol·L-1、葡 萄 糖100 mmol·L-1、果 糖100 mmol·L-1、糖精1 mmol·L-1、安赛蜜10 mmol·L-1、三氯蔗糖10 mmol·L-1[9],FlexStation 3自动移液酶标仪(Molecular Devices公司,美国)动态监测荧光值变化。绘制荧光强度(F)-时间曲线,如果配体可激活甜味受体,该曲线会在30~60 s之间出现峰值,计作Fpeak;每孔选取最后20 s内10个读数的平均值作为基线,计作F0;绘制标准化荧光强度(F/F0)-时间曲线,其纵坐标可间接反映胞内钙离子浓度变化。计算(Fpeak-F0)/F0代表受体-配体效应强度,绘制柱状图比较甜味受体功能。
1.4 细胞免疫荧光检测
在异构体T1R2_Δe3p 3’端添加6His标签,在T1R2本构体3’端添加FLAG标签,克隆至真核表达载体pcDNA3.1(+)。使用lipofectamine 2000将等量T1R2-FLAG、T1R2_Δe3p-6His、T1R3及Gα 16-gust44表达质粒转染至HEK293细胞。转染48 h后,4%多聚甲醛固定15 min,PBS漂洗,0.2%Triton X-100通透10 min,3%BSA封闭30 min,6His或FLAG一抗(1%BSA 1∶1 000稀释)孵育2 h,漂洗,用带有荧光基团的二抗孵育1 h,再次漂洗,在10μg·mL-1DAPI溶液中孵育5 min,漂洗后使用倒置荧光显微镜观察并拍照。
1.5 LPS局部注射及qPCR检测
将8周龄、雄性C57BL/6J小鼠随机分为LPS处理组(n=5)及PBS对照组(n=5),行注射麻醉,使用LPS(5 mg·kg-1)或等体积PBS行舌背局部注射,6 h后使用颈椎脱臼法处死小鼠。分离小鼠舌背轮廓乳头与菌状乳头,分别提取RNA,逆转录为cDNA,利用T1R2_Δe3p(正向序列5’-GATCGTGGTGCTGGAGGTTC-3’,反向序列5’-GCTCAGCTCTGGCGAGAATA-3’)、T1R2(正向序列5’-CCAAGTGCAATGAGTACAACATGA-3’,反向序列5’-AGCAGACATCCACCATCTCG-3’)、T1R3(正向序列5’-GCAACCAGGTGCCAGTCT-3’,反向序列5’-AGCAGGCTGTGCTTTTCTCT-3’)特异性引物进行qPCR扩增。相对表达量以βactin(正向序列5’-GGTCAGAAGGACTCCTATGTGG-3’,反向序列5’-TGTCGTCCCAGTTGGTAACA-3’)为内参,采用2-ΔΔCt法计算,并计算T1R2_Δe3p相对T1R2的表达比例。
1.6 统计学分析
采用SPSS 20.0软件进行分析,采用独立样本t检验,以双向P<0.05为差异有统计学意义。
2 结果
2.1 甜味受体T1R2存在可变剪接异构体T1R2_Δe3p
味蕾组织RNA行RT-PCR扩增T1R2转录本,产物行琼脂糖凝胶电泳后,发现T1R2存在若干较短的剪接异构体(图1A),测序结果显示其中一个剪接异构体的3号外显子部分丢失。特异性引物qPCR反应后通过琼脂糖凝胶电泳验证该异构体表达,将其命名为T1R2_Δe3p(图1B)。对丢失序列进行分析,发现其5’端(GU)及3’端(AG)为内含子特征序列,在mRNA剪接过程中可能被识别为内含子而丢失(图1C)。开放阅读框分析显示T1R2_Δe3p翻译起始与终止位点未发生改变,其翻译产物缺少位于胞外段配体结合区域的29个氨基酸残基(图1D)。

图1 剪接异构体T1R2_Δe3p的发现Fig 1 Identification of splicing isoform T1R2_Δe3p
2.2 可变剪接异构体T1R2_Δe3p导致甜味受体功能下调
与T1R2/T1R3本构体相比,T1R2_Δe3p与T1-R3组成的甜味受体受到适当浓度的糖精、安赛蜜、三氯蔗糖、葡萄糖、果糖、蔗糖等甜味配体刺激后,细胞内钙离子浓度变化显著下调,且与阴性对照相比差异无统计学意义(图2)。T1R2_Δe3p与T1R3组成的甜味受体无法与甜味刺激物结合产生味觉信号,表现为甜味感知功能的缺失。将T1R2_Δe3p与T1R2/T1R3共同转染至HEK-293细胞,甜味配体刺激后胞内钙离子浓度变化显著下调,但高于阴性对照组(图2)。qPCR与细胞免疫荧光图像显示过表达T1R2_Δe3p后,甜味受体本构体T1R2/T1R3的mRNA和蛋白表达水平无明显变化(图3)。
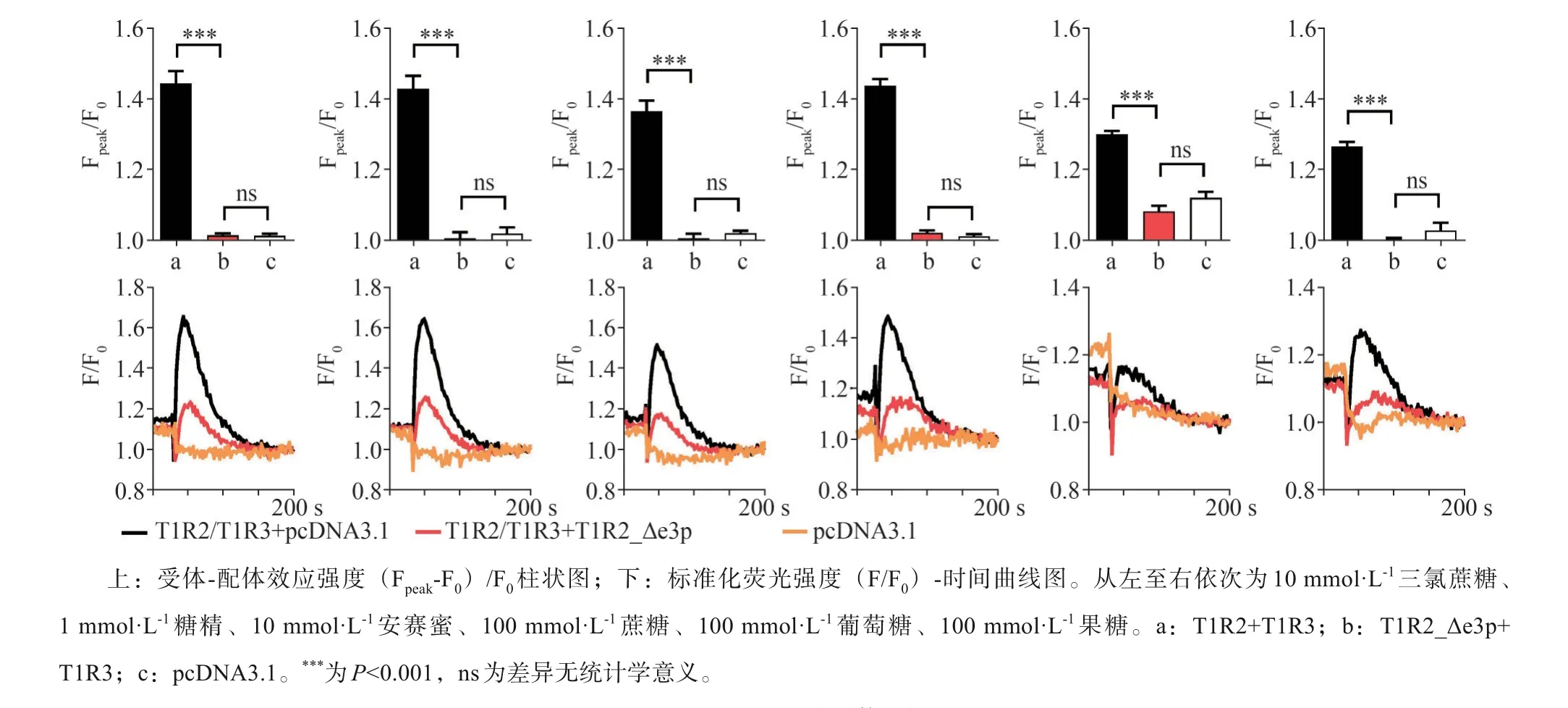
图2 T1R2_Δe3p对甜味受体功能的影响Fig 2 The effect of T1R2_Δe3p on thefunction of sweet tastereceptor
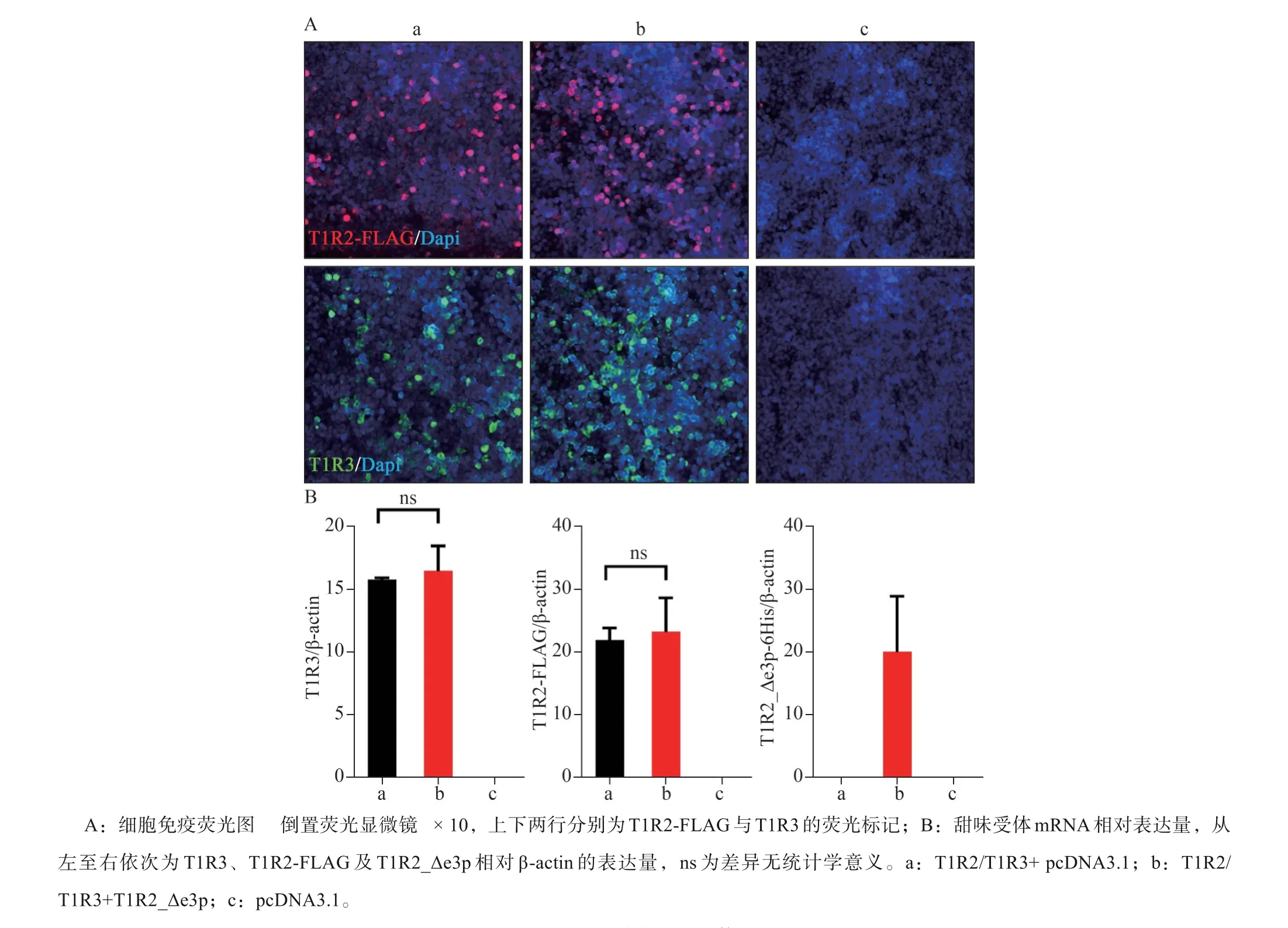
图3 T1R2_Δe3p对本构甜味受体表达量的影响Fig 3 The effect of T1R2_Δe3p on the expression of canonical sweet taste receptor
2.3 局部注射LPS后T1R2_Δe3p表达比例上调
小鼠舌背局部注射LPS后,菌状乳头、轮廓乳头组织qPCR结果显示,甜味受体T1R2/T1R3表达量与对照组比较差异无统计学意义(图4)。菌状乳头中T1R2_Δe3p表达量(P=0.045 4)及相对T1R2本构体表比例(P=0.017 8)均有显著上升(图4),轮廓乳头T1R2_Δe3p相对T1R2本构体表比例显著上升(P=0.037 1,图4)。
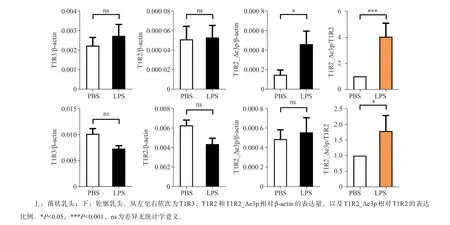
图4 LPS对T1R2/T1R3本构体与T1R2_Δe3p表达量的影响Fig 4 Theexpression of canonical T1R2/T1R3 and T1R2_Δe3p affected by LPS
3 讨论
人类的口腔作为消化道的起始,是人体与环境进行物质交换的重要场所,有超过600种微生物定植[10]。口腔微生物不仅是龋病、牙髓病、根尖周病、牙周病等口腔常见病、多发病的最主要致病因素,还与恶性肿瘤、糖尿病、心血管疾病等全身性疾病密切相关[11]。味觉感受器位于味觉乳头内的味蕾中,主要分布于口腔内的舌背黏膜,微生物作为局部刺激因素对味觉传导有一定影响。
口腔卫生状况及感染性疾病的患病情况与味觉异常的发生有关[4]。LPS为革兰阴性菌细胞壁的组成成分,可通过活细菌外膜囊泡或死细菌崩解的方式释放,是重要的活性致病物质[12]。有研究[13]报道,腹腔注射LPS可升高小鼠味觉乳头炎性因子的表达量,可能通过影响味觉前体细胞增殖参与味觉异常的发生。本研究发现了对甜味受体功能有显著影响的T1R2_Δe3p,LPS局部刺激可使其表达比例升高,从转录后调控的角度解释了微生物抗原成分引起味觉感知能力下降的原因。
甜味受体T1R2/T1R3属于GPCR的C家族,除拥有GPCR超家族7次跨膜结构和偶联G蛋白引起下游分子信号转导的共同特点以外,其与配体结合的结构域位于500~600个氨基酸残基组成的氨基端末端,具有类似于捕蝇草的双小叶空间结构,被命名为捕蝇草结构域(Venus flytrap domain,VFTD)[14]。本研究发现的T1R2剪接异构体蛋白缺少的29个氨基酸残基位于本构体的VFTD内。异源性表达实验结果显示T1R2_Δe3p与T1R3共转染后无法结合甜味配体,推断其原因为异构体蛋白无法形成可与甜味刺激物结合的VFTD结构。过表达T1R2_Δe3p后,T1R2/T1R3本构体在mRNA及蛋白质水平表达量无明显变化,但甜味受体功能明显下调。推测其机制为T1R2_Δe3p竞争性与T1R3结合形成无功能的二聚体,抑制T1R2/T1R3二聚体的形成,整体下调甜味受体与配体的结合。
mRNA可变剪接是转录后调控的关键步骤,异常剪接与肿瘤、免疫性疾病、神经退行性疾病、代谢性疾病等多种疾病相关[15]。可变剪接存在复杂的调控网络,其中剪接因子可识别前体mRNA中剪接调控元件,发挥促进或抑制剪接的作用[16]。本研究发现剪接异构体T1R2_Δe3p对甜味受体功能有显著抑制作用,其表达受到LPS局部刺激的调控。LPS影响甜味受体可变剪接的分子机制有待于进一步研究,推测LPS可能通过调控某些关键剪接因子对T1R2_Δe3p表达产生影响。进一步发现调控甜味受体可变剪接的关键剪接因子将为人工干预甜味受体功能提供理论基础。此外,LPS局部刺激影响小鼠味觉乳头内T1R2_Δe3p丰度变化是否对其甜味敏感度产生影响仍有待进一步证实。
综上,本研究发现了小鼠甜味受体T1R2的可变剪接异构体T1R2_Δe3p,其对甜味受体T1R2/T1R3的功能有显著抑制作用,LPS局部刺激可显著上调T1R2_Δe3p异构体表达,从转录后调控角度揭示微生物感染影响宿主味觉感知的分子机制。
利益冲突声明:作者声明本文无利益冲突。

