核酸转录介导的扩增中室内质控方法的探讨
季茂胜,赵 欣,张蓝江,王 欢,陈 雪,董玉芳,魏彩冰
四川省成都市血液中心血液筛查实验室,四川成都 610041
目前血液核酸检测技术(NAT)已在我国采供血机构全面开展和普及,检测原理主要分为聚合酶链反应(PCR)和转录介导的扩增(TMA),使得其在检测灵敏度和特异度方面表现极佳。通过利用NAT检测人类免疫缺陷病毒(HIV)、丙型肝炎病毒(HCV)、乙型肝炎病毒(HBV),降低了只依赖酶联免疫吸附试验(ELISA)检测献血员标本导致的输血传播性疾病的发生[1]。《血站核酸检测实验室质量保证指南》中提到血站核酸检测室内质控的基本要求为每一批次检测应至少有一个弱阳性室内质控品。各血站实验室尚未建立较统一的NAT质量控制体系[2-3],然而室内质控是检测和评价本实验室质量管理体系运行情况,确定检测结果是否可靠、稳定的重要因素[4]。为此本中心实验室结合实际工作中的室内质控检测结果,通过绘制箱体图法和Levey-Jennings质控图法回顾性分析实验过程中的检测情况,对两种质控分析方法在转录介导的扩增中对室内质控的监测情况作比较。
1 材料与方法
1.1室内质控品数据来源 收集2019年3月9日至7月19日本核酸实验室室内质控品(HBV-DNA、HCV-RNA、HIV-RNA)检测的待测物信号/临界值(S/CO值)。
1.2室内质控品 室内质控品HBV-DNA、HCV-RNA、HIV-RNA为购于北京康彻思坦公司的标准品,水平分别为30 IU/mL、30 IU/mL、200 IU/mL,批号为20190110,有效期至2021年1月9日。
1.3仪器与试剂 HBV、HCV、HIV1型(Procleix Ultrio Plus Assay)核酸联检检测试剂盒(主批号为700354,有效期至2020年5月15日)及Procleix Tigris核酸检测系统均购于盖立复生物诊断公司,试剂使用前在试剂孵育器内32 ℃孵育1 h。严格按照仪器和试剂说明书及本实验室的标准操作文件进行操作。
1.4室内质控品检测 从-30 ℃冰箱取出室内质控品室温解冻后,上下缓慢颠倒使其充分混匀(HIV室内质控品为干粉状态,使用其相应的溶解液充分溶解后颠倒混匀)瞬间离心。在温度15~25 ℃、湿度20%~85%环境下,室内质控品与常规标本一同检测。机器在使用的情况下,每天做一次HBV-DNA、HCV-RNA、HIV-RNA 3个项目的室内质控品检测。结果判读:仅当核酸检测试剂盒自带的校准物与对照品同时有效时,室内质控品才能判断为有效,记录S/CO值。
1.5箱体图的绘制 使用统计软件SPSS17.0分别计算HBV-DNA、HCV-RNA、HIV-RNA室内质控品的中位数(M)、下四分位数(QL)、上四分位数(QU)、四分位数间距(QR)=QU-QL,绘制箱体图判定离群值;也可以通过计算离群值上下限判定离群值,即当S/CO值>QU+1.5QR或 2.1箱体图结果 实验期间在一台Procleix Tigris机器上共检测了86组HBV-DNA、HCV-RNA、HIV-RNA室内质控品数据。3个项目的M、QL、QU、QR及离群值上、下限如表1所示。当HBV-DNA室内质控品检测的S/CO值<12.86或>15.36时判断为离群值;HCV-RNA室内质控品检测的S/CO值<8.44或>11.13时判断为离群值;HIV-RNA室内质控品检测的S/CO值<9.84或>14.51时判断为离群值。在检测的86组数据中HBV-DNA的第32次(S/CO值为16.03)、38次(S/CO值为16.04)为离群值;HCV-RNA室内质控品无离群值;HIV-RNA室内质控品的第32次(S/CO值为14.59)为离群值,与通过SPSS17.0统计软件绘制的箱体图所显示的离群值结果一致,见图1。 表1 室内质控品百分位数及离群值上、下限 图1 室内质控品S/CO值箱体图 图2 HBV-DNA室内质控品Levey-Jennings质控图 图4 HIV-RNA室内质控品Levey-Jennings质控图 箱体图是利用数据中的5个统计量即最小值、QL、M、QU与最大值来描述数据的一种方法(箱体图的最下、上线段为最小、大值;中间箱体的下、上沿为QL和QU),它可以看出数据是否具有对称性、分布的离散程度等信息[5],离群值以星号或圆点在箱体图的上方或下方显示,箱体图的绘制依靠实际数据,不需要事先假定数据服从特定的分布形式,不对数据作任何限制[6]。图1中可以看出HIV-RNA的箱体上下高度范围(即QR)比HBV-DNA、HCV-RNA箱体高度范围大,表明HIV-RNA的离散程度大于HBV-DNA、HCV-RNA的离散程度,这与它们之间s、CV的差别一致[7]。 目前国内采供血机构核酸实验室普遍的做法是采用定性的方法进行质量控制[12],即外部质控品HBV-DNA、HCV-RNA、HIV-RNA检测结果为反应性的情况下,本批次实验结果有效。虽然结果中HBV-DNA、HCV-RNA、HIV-RNA室内质控品分别4次、4次、6次超出失控限,但S/CO值定性结果为反应性,实际工作中笔者依然判断当批次检测有效,当室内质控品S/CO值超出失控限时,如果内标、对照有效依然可以判断实验有效。这是因为在每一次实验运行过程中,Procleix Ultrio Plus Assay的内部质控体系通过以下3个方面达到自身实验监控的目的:(1)内标。通过包含内标的目标捕获试剂将内标添加到每个检测标本、对照或校准物管中,使试剂的内标在标本处理、扩增和检测步骤中均可作为质控品来监测实验过程,每个测试管的有效性需要内标的相对光值大于或等于内标临界值[13]。(2)对照。阴性对照呈无反应性并且阳性对照呈反应性时本批次实验有效。(3)校准物质。虽然它的检测是为了计算待测物和内标的临界值,但它的有效或无效也能在一定程度上起到监测实验的作用。内部质控体系可以全面覆盖检测的整个过程,但是仅可以作为当批次实验有效性的验证,并不能监测仪器整个使用周期中NAT体系(包括仪器、试剂、质控品)的稳定性情况[14],而Levey-Jennings质控图法通过室内质控品的监控可以很好地弥补这方面的不足。 图2中86次HBV-DNA室内质控品S/CO值围绕平均值随机上下波动,其中第32、38、50、62次超出失控限,分析原因发现第32、38、62次实验当天机器出现“磁清洗工作台液位感测故障”,采取的措施是实验开始前增加一次磁力工作站的高级磁力冲洗以减少其故障的发生,但第50次机器运行情况正常,猜测是由机器的偶发故障所造成;图3中HCV-RNA室内质控品S/CO值从第65次起出现在平均值一侧,观察发现所用盖立复试剂并未更换批号,排除试剂原因。所用机器在六月中旬曾做过半年维护保养(正好为第65次的时间段),由于测量化学发光信号的冷光仪经过校正,导致室内质控品数值不同于校正前的数值,机器的系统误差造成结果漂移,解决办法是在维护保养后应重新绘制质控图,以排除仪器校正对质控结果的影响;而图4中HIV-RNA室内质控品从第56次起后面的检测值都低于平均值,分析原因可能是由于HIV-RNA作为核糖核酸易于降解(质控品为干粉)在保存过程中随着时间的延长RNA降解导致浓度降低,致使S/CO值低于平均值造成的,使用新订购的室内质控品并尽快使用以减少保存时间对浓度的影响。 两种质控方法相比较,箱体图法仅仅可以发现少数离群值,而通过Levey-Jennings质控图中超出失控限原因的分析[15],不仅可以评估仪器的运行状态,还可以监测试剂和质控品的质量状态,监测核酸检测体系的稳定性,从而更好地保证核酸检测的质量控制。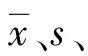
2 结 果




3 讨 论