双重兑卤法生产低钠光卤石工艺研究
熊家晴,张 宇,朱俊国
(1.西安建筑科技大学环境与市政工程学院,陕西西安710055;2.陕西省环境工程重点实验室;3.西北水资源与环境生态教育部重点实验室)
氯化钾作为一种重要的矿产资源,广泛应用在农业、工业、医药业和机械电子等领域,尤其在农业领域,钾肥发挥着极其重要的作用[1]。但中国钾资源产能不足,目前仍有一半以上的钾盐依靠国外进口[2]。中国钾资源主要储存于盐湖卤水中,且大多集中于西部盐湖[3],生产氯化钾所必须的物质是光卤石KCl·MgCl2·6H2O(Carnallite,简写Car),其主要通过盐湖卤水结晶析出[4]。目前,盐湖制钾的主流工艺是“晒卤-浮选法”,即将卤水在盐田中经日晒蒸发析出含有氯化钠的光卤石,然后通过浮选方法去除氯化钠得到氯化钾[5]。由于晒卤阶段受自然因素影响较大,其成矿周期长,盐湖卤水蒸晒得到光卤石往往需要数月甚至半年以上,且晒卤得到的光卤石原矿中氯化钠含量较高,需要通过投加药剂浮选分离氯化钠[6],浮选过程反应的废液排放还会对环境造成一定的危害[7]。
本研究采用双重兑卤法生产低钠光卤石,即钾饱和卤水(氯化钾析出卤水,称之为D卤)和老卤(水氯镁石析出卤水,称之为F卤)第一次掺兑析出固相氯化钠并且生成钾母液,再以钾母液和老卤进行第二次掺兑直接生产低钠光卤石。该方法可以省去晒卤过程中钾饱和卤水后续的蒸发阶段,从而减少了钾盐的损失[8],极大地提高了钾的收率、缩短生产周期,且整个过程无需添加浮选药剂,简化了生产工艺,高效环保,为高效快速实现卤水生产钾盐提供了新的思路。
1 实验部分
1.1 原料与仪器
原料:实验所用卤水为氯化物型盐湖钾饱和卤水和老卤,其组分和浓度见表1和表2。
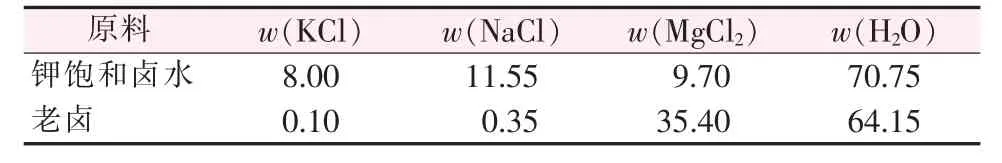
表1 钾饱和卤水和老卤的质量组成Table 1 Mass compositions of potassium saturated brine and old brine %

表2 钾饱和卤水和老卤的质量浓度Table 2 Mass concentration of potassium saturated brine and old brine g/L
仪器:ICE3000型热电火焰原子吸收光谱仪;UItimqⅣ型X射线衍射仪;JSM-6510LV扫描式电子显微镜;101-0AB型电热鼓风干燥箱;AL104101型分析天平;SHB-Ⅲ型循环水真空泵。
1.2 分析方法
钾离子浓度采用四苯硼钠-季铵盐容量法和火焰原子吸收法检测;钠离子浓度采用差减法和火焰原子吸收法检测;镁离子浓度采用乙二胺四乙酸二钠滴定法检测;氯离子浓度采用汞量法检测[9];析出固相结晶的组分采用X射线衍射法和扫描式电子显微镜检测。
1.3 实验原理
根据Na+,K+,Mg2+∥Cl-—H2O四元体系相图杠杆原理和直线规则,当改变盐湖卤水中各物质的组分含量时,相图上的系统点将会发生相应的移动。钾饱和卤水与老卤以一定的比例掺兑,反应后新的系统点将靠近于光卤石相区的E点(KCl、NaCl与Car共饱和点),此过程中有大量的氯化钠固体析出,并且系统点的移动避开了氯化钾结晶相区,减少了钾盐的损失,得到脱钠钾母液(称之为E卤)。钾母液再和老卤以一定比例掺兑,系统点最终进入到光卤石相区,溶液将会大量析出光卤石晶体[10]。
1.4 实验方法
将钾饱和卤水和老卤以1∶(1.3~2.2)的不同质量比进行掺兑,搅拌15 min充分混合,静置一段时间,溶液析出固相氯化钠,然后进行真空抽滤固液分离,得到氯化钠固体和钾母液,对固相氯化钠进行干燥,再将钾母液与老卤以1∶(1.2~2.2)的不同质量比进行掺兑,搅拌15 min充分混合,静置一段时间,溶液析出固相光卤石,然后进行真空抽滤固液分离,并干燥得到光卤石固体,其工艺流程图见图1。

图1 双重兑卤法工艺流程图Fig.1 Process flow diagram of double brine mixing method
2 结果与讨论
2.1 脱钠阶段关键影响因素及析出固相分析
2.1.1 兑卤比例对脱钠过程的影响
当钾饱和卤水和老卤以不同的质量比(mD∶mF)掺兑时,溶液中会大量析出氯化钠,反应完成后,其反应液中各离子的浓度会发生显著变化,溶液中钠、钾、镁、氯等离子的浓度随兑卤比例的变化见表3。

表3 D卤与F卤按不同比例掺兑溶液中各离子浓度Table 3 Ion concentration in solutions of D brine and F brine mixed in different mass ratios
由表3可以看出,随着兑入老卤比例的增加溶液中钠离子、钾离子浓度呈逐渐降低趋势,而镁离子、氯离子的浓度呈逐渐上升的趋势。钠离子、钾离子浓度的降低是由于钠离子参与反应大量析出固相氯化钠,以及掺兑的老卤逐渐增多使溶液的体积不断增大造成的;而镁离子、氯离子浓度的增加是由于老卤中镁离子、氯离子的含量非常高,随着老卤加入量不断增大,镁离子、氯离子的浓度将相应增加。
图2 为兑卤脱钠过程中钠离子、钾离子的收率随兑卤比例的变化情况。由图2看出,钠离子的收率在兑卤比例为1∶(1.3~1.8)之间快速上升,在兑卤比例为1∶1.8之后上升较平缓;钾离子的收率在兑卤比例为1∶(1.3~1.8)之间相对缓慢上升,在兑卤比例为1∶(1.8~2.3)之间上升较快。说明随着掺兑的老卤量不断增加,钠离子的析出速率先增大后减小,而钾离子析出的速率将越来越快。兑卤脱钠过程中伴随着钾离子的损失,并且钾离子损失率随着掺兑比例的增大而增大,这是由于向钾饱和卤水中不断加入老卤,而老卤中富含大量的氯化镁,镁离子结合了溶液中大量的水,从而使氯化钠溶解度降低而饱和析出[11]。随着老卤加入量进一步的继续增大,系统点进入光卤石相区,钾离子最终以光卤石的形式析出而损失[12]。
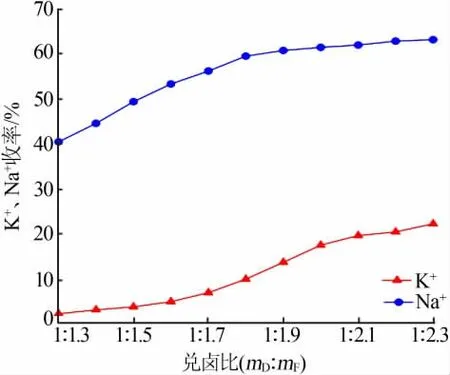
图2 脱钠阶段不同兑卤比对K+、Na+收率的影响Fig.2 Effect of different brine mixing ratios on K+and Na+yields in sodium removal stage
综合考虑兑卤脱钠的效果,钠离子的去除量不能太小,钾离子的损失量不宜太多,并且老卤的加入量也不宜过多,故确定钾饱和卤水和老卤的质量比为1∶1.8,此时钾离子的损失率为9.58%,钠离子的去除率为59.30%。
2.1.2 陈化时间对脱钠效果的影响
当钾饱和卤水与老卤以质量比为1∶1.8掺兑并充分搅拌之后,反应液分别以不同的时间静置,检测静置在不同时间条件下反应液中各种离子浓度的变化情况,以确定兑卤反应最佳陈化时间(见表4)。从表4看出,随着时间的延长,溶液中钠离子和氯离子的浓度大幅减少,而钾离子、镁离子的浓度相对降幅较小,这是由于钠离子和氯离子主要参与反应并析出氯化钠,而只有少量的钾离子与镁离子参与了反应。
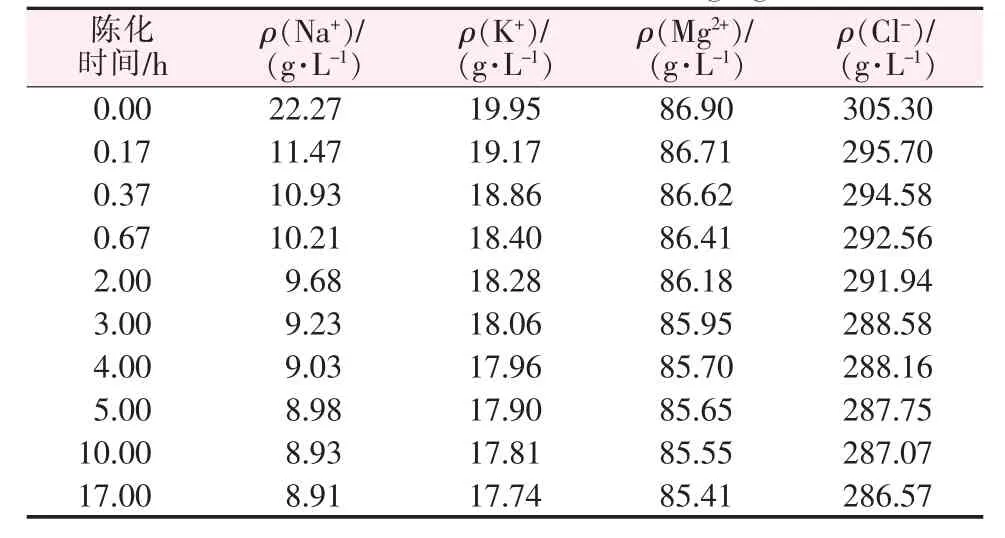
表4 D卤与F卤以质量比1∶1.8掺兑在不同陈化时间下的离子浓度Table 4 Ion concentrations of D brine and F brine mixed with a mass ratio of 1∶1.8 at different aging times
不同的陈化时间对钠离子、钾离子浓度的影响见图3。由图3可以看出,开始静置大约20 min,钠离子浓度迅速下降,随着时间的不断延长,大约4 h后钠离子浓度下降的速率越来越缓,说明氯化钠的析出主要发生在反应初期;而钾离子浓度相对降幅较小,说明反应中只有少量光卤石析出,其析出阶段也集中在反应初期。随着陈化时间的不断延长,钠离子、钾离子的浓度下降速率越来越慢,在大约4 h之后钾离子、钠离子浓度基本保持不变,所以陈化4 h溶液已达到平衡状态,反应基本完成。
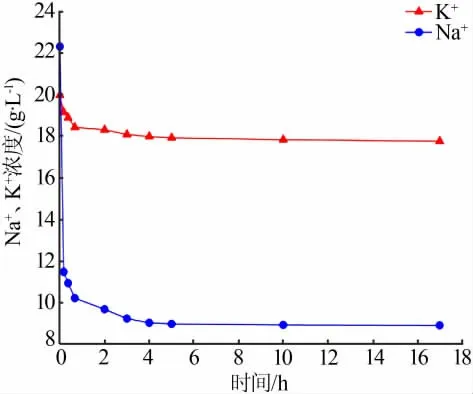
图3 脱钠阶段不同陈化时间对Na+、K+浓度的影响Fig.3 Effect of different aging times on Na+and K+concentrations in sodium removal stage
2.1.3 脱钠阶段析出固相的组分特征
将钾饱和卤水和老卤以兑卤质量比1∶1.8掺兑,对其析出的固相进行固液分离并干燥,通过X射线衍射测定其固相组分,如图4所示。扫描电镜观察其微观结构如图5所示。由图4~5可以看出,在兑卤比为1∶1.8时,兑卤脱钠过程析出的固体绝大多数为氯化钠,只含有少量的光卤石。
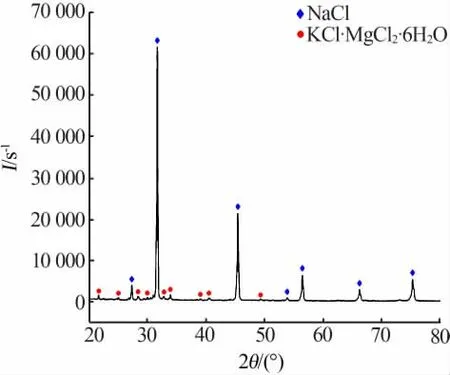
图4 脱钠阶段析出固相的XRD谱图Fig.4 XRD pattern of the solid phase precipitated in sodium removal stage

图5 脱钠阶段析出固相的扫描电镜相貌图Fig.5 SEM image of solid phase precipitated in sodium removal stage
2.2 生产光卤石阶段关键影响因素及析出固相分析
2.2.1 兑卤比例对光卤石形成过程的影响
将钾饱和卤水与老卤以兑卤质量比1∶1.8掺兑,充分搅拌并陈化4 h后对其反应物进行真空抽滤固液分离,得到氯化钠固体和富钾母液(E卤)。将钾母液和老卤以不同质量比(mE∶mF)掺兑,反应液中各离子浓度变化情况见表5。由表5可见,随着老卤掺兑比例的逐渐增大,溶液中钾离子、钠离子的浓度相对减小,而镁离子、氯离子的浓度相对增大。这是因为随着加入老卤的量不断增大,钾离子、钠离子生成固相光卤石和氯化钠的量也在不断地增加;而加入的老卤中富含大量的镁离子、氯离子,随着加入老卤量的增大溶液中的镁离子、氯离子浓度大量增加。
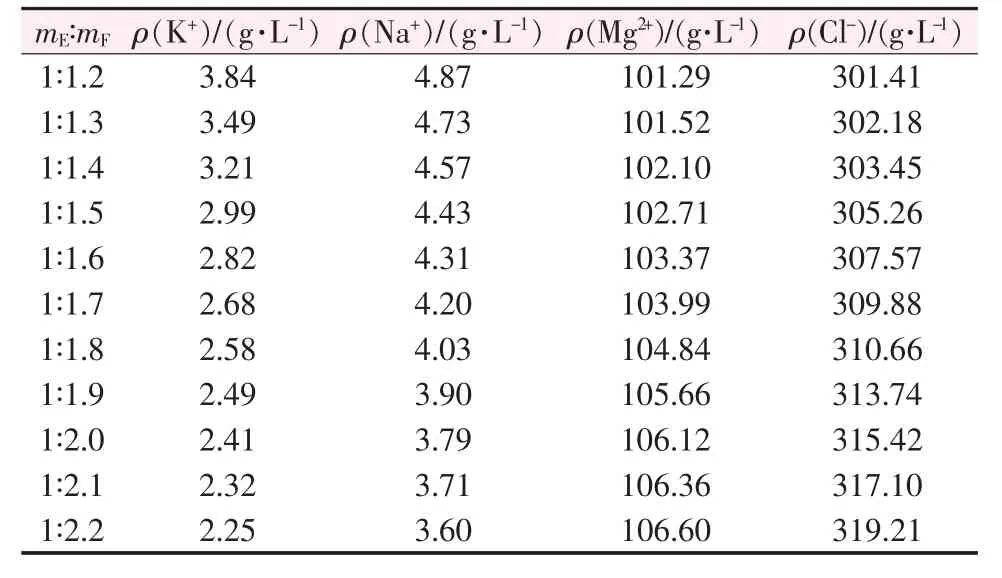
表5 E卤与F卤以不同比例兑卤溶液中各离子浓度Table 5 Ion concentrations of each ion in solutions of E brine and F brine mixed in different mass ratios
图6 为兑卤生产光卤石过程中钾离子、钠离子的收率随兑卤比的变化情况。由图6可以看出,钾离子的收率远大于钠离子的收率,说明第二次兑卤溶液析出的物质主要为光卤石,只有少量的氯化钠。随着老卤的掺兑比例不断增大,溶液中钾离子的收率呈逐渐上升趋势,然而伴随钾离子的析出,溶液中钠离子的收率也随着老卤掺兑量的增加而增加。钾离子的收率在兑卤比为1∶(1.2~1.7)之间相对快速上升,在兑卤比小于1∶1.7之后上升趋于平缓;钠离子的收率在兑卤比为1∶(1.2~1.7)之间缓慢上升,在兑卤比小于1∶1.7以后相对快速上升。这是因为老卤和钾母液按一定的比例掺兑后,系统点的位置发生了变化,其进入到光卤石相区,在“同离子效应”的作用下溶液结晶析出光卤石[13],随着老卤的继续掺兑,钾离子的收率将达到极值并逐渐趋于平稳,过程中钠离子也有少量析出。
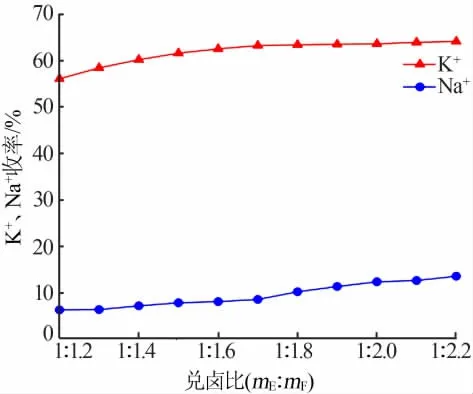
图6 生产光卤石阶段不同兑卤比对K+、Na+收率的影响Fig.6 Effect of different brine mixing ratios on K+and Na+yields in carnallite production stage
不同兑卤比例下析出光卤石固体中的氯化钠含量占比如图7所示。由图7可以看出,光卤石中的氯化钠质量分数为2.6%~5%,随着老卤掺兑比例的增大,光卤石中氯化钠的含量也在相应增加,在兑卤比例小于1∶1.7时氯化钠的含量增加较快。综合考虑兑卤的效果,反应中光卤石应大量析出,而光卤石中氯化钠的含量不能过多,并且老卤的加入量也不宜过大,故确定钾母液和老卤的兑卤质量比为1∶1.7,此时钾离子的收率为62.69%,钠离子的收率为8.55%,析出固体光卤石质量分数为96.96%,氯化钠质量分数为3.04%。
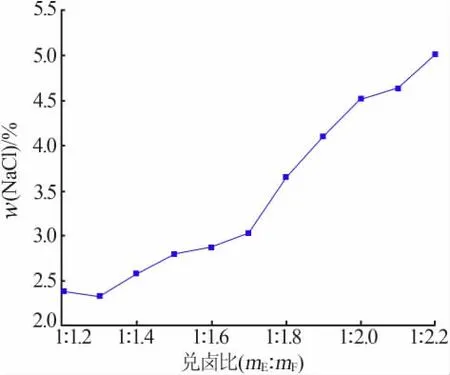
图7 不同比例兑卤析出光卤石中氯化钠的含量Fig.7 Content of sodium chloride in carhalite precipitated by halide in different proportion
2.2.2 陈化时间对析出光卤石效果的影响
本实验在钾母液和老卤以兑卤比mE∶mF=1∶1.7掺兑,充分搅拌之后,溶液分别静置不同的时间,检测在不同静置时间下反应液中各种离子的浓度的变化情况,以确定兑卤反应最佳陈化时间,见表6。由表6可以看出,随着陈化时间的延长,溶液中K+、Na+、Mg2+、Cl-离子的浓度均在下降,而钠离子的浓度相对变化较小,说明溶液中主要是K+、Mg2+、Cl-离子反应生成光卤石,伴随反应只有少量的氯化钠析出。

表6 E卤与F卤以质量比1∶1.7掺兑在不同陈化时间下的离子浓度Table 6 Ion concentration of E brine and F brine mixed with a mass ratio of 1∶1.7 at different aging times
不同的陈化时间对钾离子、钠离子浓度的影响见图8。由图8可以看出,开始静置大约10 min内钾离子浓度迅速减小,随着时间的不断延长,钾离子浓度下降的速率越来越缓慢,相应钠离子的浓度也在下降,但其减少量相对钾离子变化较小,说明光卤石的析出主要发生在反应初期,伴随着少量的氯化钠析出;大约在3.5 h之后钾离子、钠离子浓度变化趋于平稳。所以陈化3.5 h之后溶液已达到平衡状态,反应基本完成。
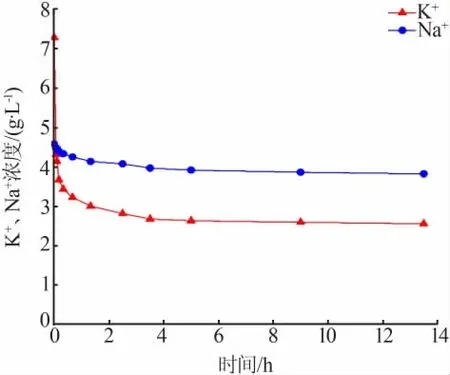
图8 生产光卤石阶段不同陈化时间对K+、Na+浓度的影响Fig.8 Effect of different aging times on Na+and K+concentrations in carnallite production stage
2.2.3 生产光卤石阶段析出固相的组分特征
钾母液和老卤以质量比为1∶1.7掺兑,充分搅拌并陈化3.5 h后,对其析出的固相进行固液分离并干燥,通过X射线衍射测定其固相组分如图9所示。扫描电镜观察其微观结构如图10所示。由图9、图10可以看出,其析出的固体绝大多数为光卤石,只含有少量的氯化钠,光卤石中氯化钠的质量分数为3%左右,兑卤所得的光卤石为低钠光卤石[14]。
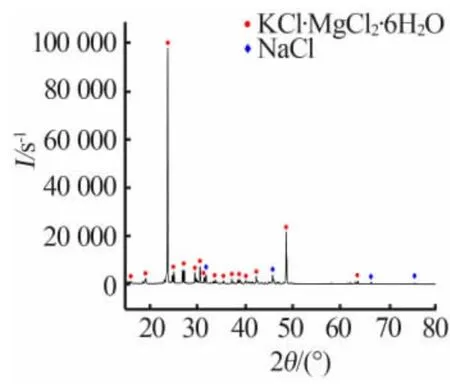
图9 生产光卤石阶段析出固相的XRD谱图Fig.9 XRD pattern the solid phase precipitatedincarnallite productionstage

图10 生产光卤石阶段析出固相的扫描电镜相貌图Fig.10 SEM image of solid phase precipitated in carnallite production stage
3 结论
1)两次兑卤效果均较为理想,第一次兑卤钠离子的去除率达59.30%,第二次兑卤钾离子的收率达62.69%。2)双重兑卤法生产光卤石,可以直接将钾饱和卤水与老卤两次兑卤生产光卤石,生产过程中无需药剂的投加,相比于传统法,该方法简单、环保。3)第一次兑卤脱钠反应在陈化4 h左右基本反应完全;第二次兑卤生产光卤石反应在陈化3.5 h基本反应完全,其生产速度快、周期短。4)双重兑卤方法可以省去晒卤过程中钾盐的蒸发损失阶段,并且生成的光卤石纯度高达97%左右,氯化钠质量分数约为3%,可以生产出品质优良的低钠光卤石。

