MCL-1与HMGB1对以硼替佐米为基础一线治疗的多发性骨髓瘤患者预后分析
聂泽强,马爻芳,李乐,段丽祥
(运城市中心医院血液内科,山西 运城 044000)
多发性骨髓瘤(multiple myeloma,MM)是一种以浆细胞异常增殖为主要特征的恶性血液系统肿瘤,约占所有血液恶性肿瘤的10%,其临床症状包括骨质破坏、贫血、高钙血症及肾功能不全等[1]。近年来,随着靶向药物蛋白体酶抑制剂和免疫调节剂进入临床一线治疗,患者疗效得到明显改善。采用蛋白体酶抑制剂硼替佐米一线治疗MM患者,总治疗反应率达到90%,部分缓解(very good partial response,VGPR)率达到60%以上[2]。MM作为一种异质性疾病,患者生存期存在较大差异,初诊时进行预后评估尤为重要。髓样细胞白血病蛋白-1(myeloid cell leukemia 1,MCL-1)属于B细胞淋巴瘤-2(B-cell lymphoma 2,BCL-2)蛋白家族的重要成员之一,在凋亡调控及血液系统肿瘤的发生发展中发挥着重要作用[3]。高迁移率族蛋白B1(high mobility group protein B1,HMGB1)作为重要的炎症细胞因子,在多种恶性肿瘤病理过程中发挥着重要作用[4];研究[5]表明,MM的发生与慢性炎症相关,但目前关于HMGB1与MM相关性的研究报道较少。本研究以硼替佐米为基础一线治疗的MM患者为研究对象,拟探讨MCL-1、HMGB1与患者预后的关系,以为初诊MM患者预后评估提供一定的参考。
1 资料与方法
1.1 一般资料
本研究为回顾性研究,纳入2013年1月至2017年12月运城市中心医院收治的50例MM患者。其中,男性28例,女性22例;年龄40~73岁,平均(51.76±9.84)岁。纳入标准:(1)均符合国际骨髓瘤工作组(international myeloma working group,IMWG)诊断标准[6],并通过病理检查证实;(2)D-S分期为I~III期;(3)均接受硼替佐米为基础的一线治疗;(4)临床及随访资料完整。排除标准:(1)合并严重心肝肺功能损伤者;(2)合并严重急慢性感染者;(3)合并其他恶性肿瘤者;(4)临床资料缺失者。
1.2 治疗及疗效评价
患者均接受硼替佐米为基础的一线治疗:PD方案(硼替佐米+地塞米松)、PAD方案(硼替佐米+地塞米松+阿霉素)、PCD方案(硼替佐米+地塞米松+环磷酰胺)。于4个疗程化疗结束后,参照IMWG标准[6]进行疗效评价,分为完全缓解(complete response,CR)、VGPR、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)及疾病进展(progressive disease,PD)。将PR及以上定义为有效。
1.3 随访
采用门诊结合电话等方式对患者进行随访,每3个月1次,随访截止至2020年12月或患者死亡,中位随访时间为32(6~75)个月。总生存期(overall survival,OS)指患者确诊开始至患者死亡或者随访截止日期所经历的时间。
1.4 观察指标
收集患者初诊时一般资料及生化指标,包括性别、年龄、免疫分型、血钙(serum calcium,Ca)、血红蛋白(hemoglobin,Hb)、白蛋白(albumin,ALB)、血肌酐(serum creatinine,Scr)等。并收集患者MCL-1、HMGB1检测数据,检测方法:采集患者外周静脉血5 mL,离心(3 000 rpm)分离留取血清,采用酶联免疫吸附法进行MCL-1、HMGB1的检测。
1.5 统计学分析
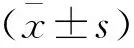
2 结果
2.1 不同DS分期MM患者一般资料的对比
年龄、性别、免疫分型及Ca、ALB、Scr水平在不同DS分期患者之间对比,差异无统计学意义(P>0.05)。随着DS分期提高,患者Hb水平逐渐降低,差异均有统计学意义(P<0.05)。见表1。
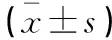
表1 不同DS分期MM患者一般资料的对比
2.2 不同DS分期患者血清MCL-1、HMGB1水平对比
不同DS分期患者血清MCL-1、HMGB1水平对比,差异有统计学意义(P<0.05);随着DS分期提高,患者血清MCL-1、HMGB1水平均逐渐增高。见表2。
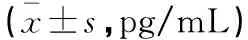
表2 不同DS分期患者血清MCL-1、HMGB1水平对比
2.3 不同疗效患者血清MCL-1、HMGB1水平对比
50例患者4个疗程化疗结束后,总有效率为64.00%(32/50);无效组的血清MCL-1、HMGB1水平均高于有效组,差异有统计学意义(P<0.05)。见表3。
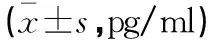
表3 不同疗效患者血清MCL-1、HMGB1水平对比
2.4 血清MCL-1、HMGB1水平与患者生存预后的关系研究
根据患者血清MCL-1、HMGB1水平中位数,定义MCL-1<60.21 pg/mL为低表达(n=24),≥60.21 pg/mL为高表达(n=26);并定义HMGB1<231.58 pg/mL为低表达(n=21),≥231.58 pg/mL为高表达(n=29)。MCL-1<60.21 pg/mL组中位OS时间为39(95%CI:12~77)个月,高于MCL-1≥60.21 pg/mL组的33(95%CI:8~62)个月,差异有统计学意义(χ2=4.615,P=0.036);HMGB1<231.58 pg/mL组中位OS时间为37(95%CI:11~75)个月,高于HMGB1≥231.58 pg/mL组的32(95%CI:9~60)个月,差异有统计学意义(χ2=4.215,P=0.045)。MCL-1和HMGB1患者的总生存曲线见图1。Cox回归分析显示,性别、年龄、免疫分型、Hb与MM患者预后无相关性(P>0.05),而DS分期、MCL-1、HMGB1与患者预后独立相关(P<0.05)。见表4。
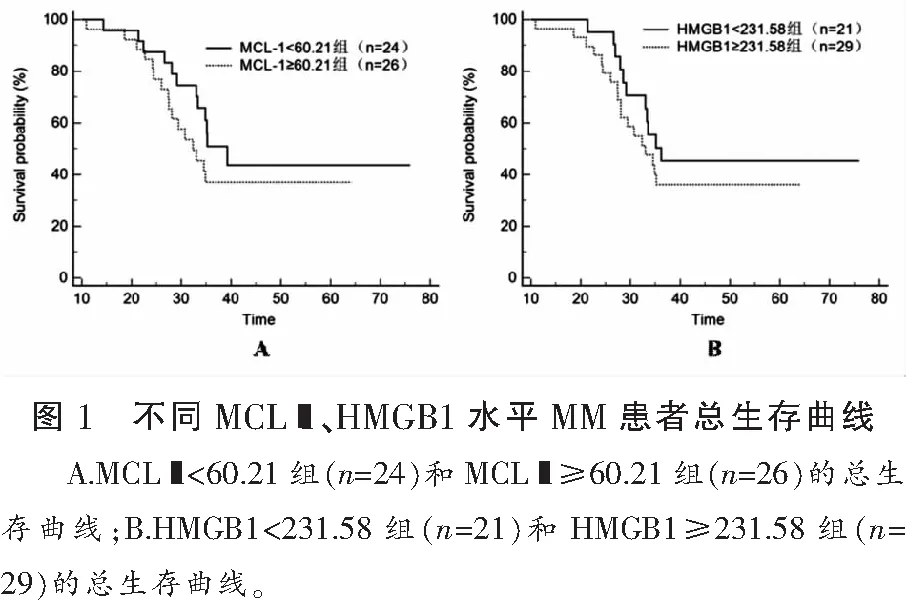
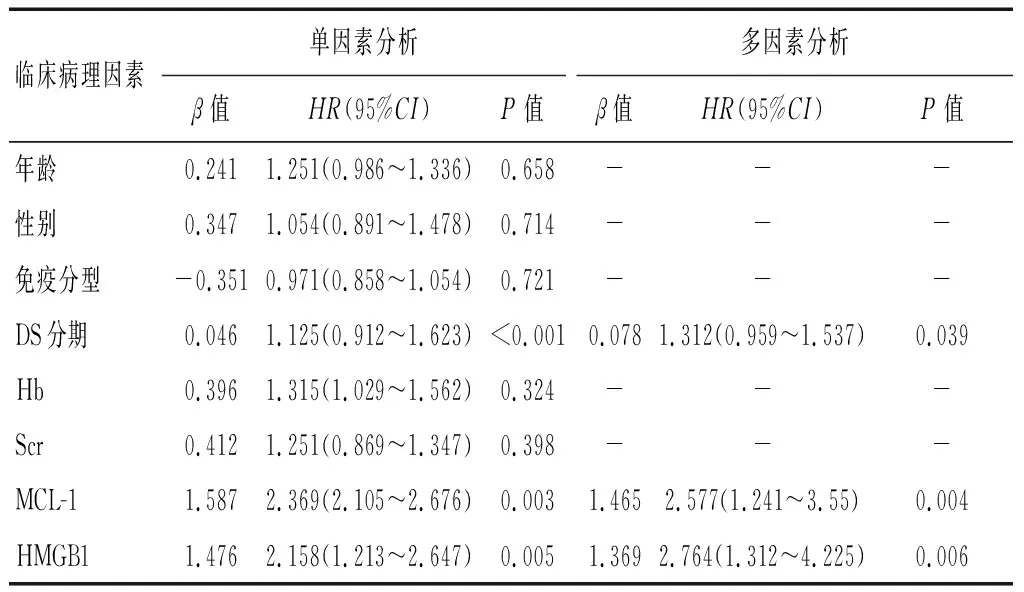
表4 MM患者预后影响因素的单因素及多因素分析
3 讨论
MM是一种有着较强生物学特异性的血液肿瘤,预后影响因素众多。2013年IMWG推荐临床采用ISS分期来对患者进行预后评估。硼替佐米为基础的一线治疗方案能够在某种程度上可克服细胞遗传学异常特征对预后不良所产生的影响[7-8],故在新药时代下ISS分期可能难以准确预测患者预后[9]。因此,寻找可作为预后预测的可靠指标尤为重要。
MCL-1作为BCL家族抗凋亡蛋白的重要成员,在线粒体凋亡通路中发挥着重要作用,同时参与骨髓瘤细胞生长、粘附、移行等多个生物学过程[10]。MCL-1在MM患者骨髓组织中的表达会随着ISS分期的提高而提高[11]。患者经化疗治疗后MCL-1水平可出现降低,故MCL-1表达检测对于追踪疾病进展及疗效评价有着重要意义[12]。本研究显示,随着DS分期提高,MM患者血清MCL-1水平逐渐增高,且MCL-1与治疗疗效密切相关,其表达检测可能有助于疗效评价。此外,MCL-1≥60.21 pg/mL患者中位OS时间短于MCL-1<60.21 pg/mL患者,Cox多因素生存分析显示,MCL-1可作为MM患者预后的独立预测指标。MCL-1能够通过与促凋亡蛋白相互结合而对其活性产生抑制作用,进而影响骨髓瘤细胞的凋亡。当血清MCL-1水平升高,可提示MM患者有着较大的肿瘤负荷,预后也较差[13]。
HMGB1在心肺肾等组织细胞核中有着广泛分布,可与DNA结合而调控基因转录过程,并对核小体结构的稳定有着重要维持作用;而释放到细胞以外的HMGB1能够参与机体炎症免疫反应、组织生长及肿瘤转移等多种过程[14]。Roy等[15]研究显示,白血病患者血清HMGB1水平显著增高;张欣等[16]研究也表明,HMGB1在MM患者中表达增高,且其表达水平与治疗效果相关。HMGB1可增加化疗耐药性,因而HMGB1高表达患者化疗疗效较差[17]。本研究也显示,HMGB1与MM患者DS分期及治疗疗效相关,可用于硼替佐米为基础的一线治疗MM患者疗效评价中。同时,对HMGB1在MM患者预后评估作用中的统计分析显示,HMGB1≥231.58 pg/mL组中位OS时间显著不如HMGB1<231.58 pg/mL组;且Cox生存分析表明,在纳入年龄、性别等因素后,HMGB1仍可作为MM患者预后的独立预测因子。HMGB1在MM发生发展中发挥作用的机制可能与以下通路有关[18-19]:(1)RAGE通路:RAGE对HMGB1的亲和力较高,是HMGB1的主要受体,二者在肿瘤侵袭转移中可发挥着协同作用,胞外的HMGB1能够与细胞表面的RAGE相结合,引起RAGE上调,进而促进肿瘤生长、转移。(2)Toll样受体:TLR2、TLR4同样也是HMGB1的重要受体,可通过相互作用活化细胞,影响肿瘤的发生发展。
综上所述,MCL-1、HMGB1与MM患者临床分期及疗效相关,是预后的独立预测因素,MCL-1、HMGB1较高,可提示患者预后较差。本研究的局限性在于,仅进行了回顾性分析研究,数据的收集难免存在偏倚,再加上样本量较小,真实性及准确性仍需大样本量的前瞻性研究进行验证。

