攻胎饲粮中添加25(OH)D3对高胎龄母猪及其初生仔猪血清激素和抗氧化指标的影响
崔建鑫,杨艳阳,乔 娜,张卓炜,邓纪昌,黄坤玄,杨 帆,李 英*,唐兆新*
(1.华南农业大学 兽医学院,广东 广州 510642;2.江西农业大学 动物群发性疾病监测与防控研究所,江西 南昌 330045)
国内现代瘦肉型母猪养殖使用年限是3~4年,平均年产2.2~2.5胎,年提供仔猪一般水平为20头(国外可达到30头左右)。增加母猪生产胎次和提高高胎龄母猪所产仔猪体质可以有效提高母猪的利用率。根据养猪业的发展现状,提高母猪胎次,加强仔猪体质迫在眉睫。钙是影响母猪繁殖的重要因素,在胚胎着床、发育中起着重要作用,同时高脐带血钙可能有助于胚胎的发育[1-3]。妊娠期间,母体需要更多的钙,但随着年龄的增加,高胎龄母猪整体机能减弱,钙摄取能力降低,且经过多次生产后更易出现缺钙现象[4-5]。维生素D是一种脂溶性维生素,可以增强小肠对钙的吸收,被称作补钙剂。与口服维生素D相比,口服25(OH)D3是一种更加安全高效的补充维生素D的方式[6]。这种新型的维生素D在2007年被允许用到猪饲料中[7],我国农业部第2045号公告将25(OH)D3列入《饲料添加剂品种目录(2013)》,准许25(OH)D3在猪生产上作为维生素及类维生素类饲料添加剂使用。近年来的研究认为在饲粮中添加25(OH)D3可以提高母猪的生产性能[8],但在高胎龄母猪及高胎龄缺钙母猪攻胎饲粮中添加25(OH)D3对母猪及仔猪体内激素及抗氧化水平产生的影响尚不清楚。本试验将40头妊娠85 d 的母猪按照饲粮中钙含量及是否添加25(OH)D3随机分为4组,连续饲喂至分娩前1 d,探究攻胎饲粮中添加25(OH)D3对高胎龄母猪及初生仔猪血清激素及抗氧化水平的影响,为高胎龄母猪及缺钙高胎龄母猪攻胎饲粮的配制提供科学依据。
1 材料与方法
1.1 试验设计试验选用健康状况良好、遗传背景相似、预产期均衡的7胎龄妊娠母猪40头,随机分为4组,每组10个重复。试验日粮配比在符合NRC(2012)标准配比的基础上,按照试验要求有目的的对饲料钙、磷和25(OH)D3的含量进行调整并将其分为对照组、低钙组、25(OH)D3组和低钙+25(OH)D3组。饲料组成及其营养水平见表1。试验过程中,钙、磷和25(OH)D3添加情况见表2。
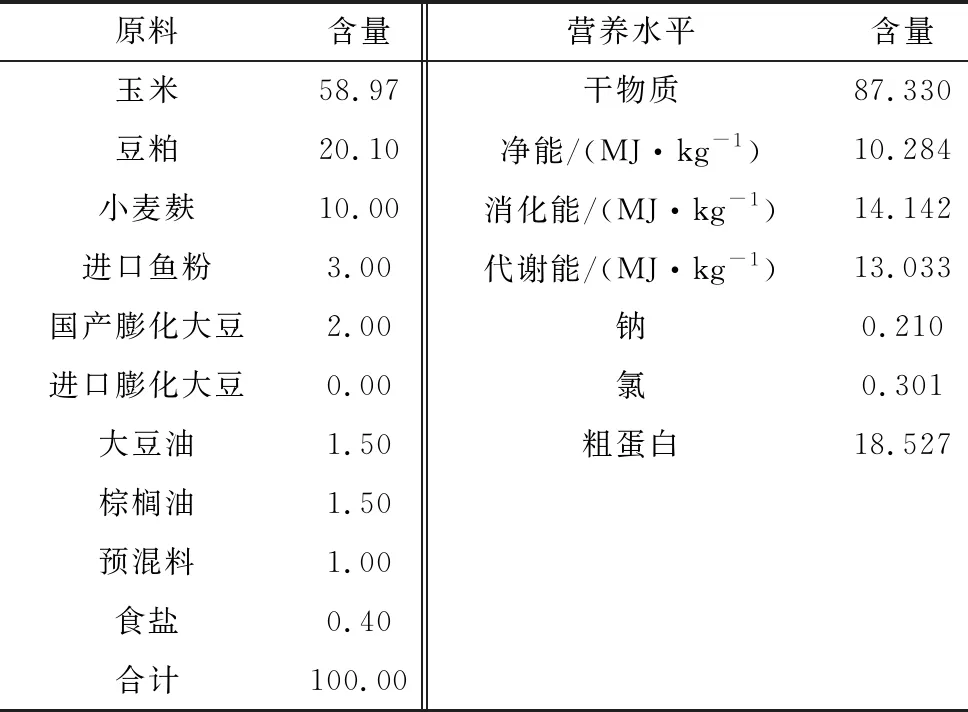
表1 基础饲粮组成及营养水平(风干基础) %
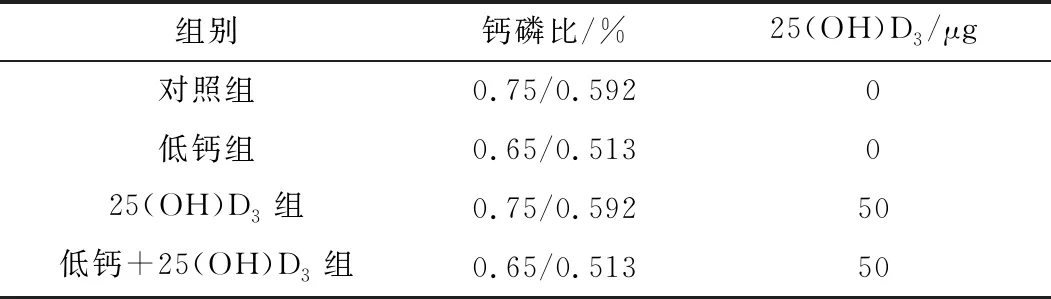
表2 试验饲料钙、磷和25(OH)D3添加水平
1.2 饲养管理试验在广州韶关翁源县丰泽畜牧养殖有限公司猪场进行。在母猪妊娠85~114 d按照试验分组饲喂母猪,85~90 d每头母猪每日饲喂2 kg,91 d至分娩,每头母猪每天饲喂3 kg,怀孕110 d,转入产房。母猪分娩后,改用母猪哺乳料。产房温度控制在20℃,试验期间按猪场日常管理程序给试验猪喂料、饮水和免疫。
1.3 母猪血样采集分别在母猪妊娠85,114 d 耳缘静脉采血,新鲜血液于4℃放置30 min,3 000 r/min 离心15 min,收集上清,分装于0.5 mL离心管,液氮保存备用。
仔猪血样:仔猪初生2 h内,前腔静脉采集血液。血清收集和储存方法与母猪血样相同。
1.4 试验材料及仪器雌二醇(E2)、猪促红细胞生成素(EPO)、猪甲状旁腺素(PTH)、猪皮质醇(Cor)和猪甲状腺激素(T4)酶联免疫分析试剂盒均购自上海酶联公司。过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、血清丙二醛(MDA)和活性氧(ROS)试剂盒购自南京建成。Elx 808型酶标仪,购自Bio Teck公司(美国);Nanodrop2000型,微量紫外分光光度计,购自Thermo Fisher科技公司(美国)。
1.5 母猪及仔猪血清激素水平检测母猪及仔猪血清冰上融化后,离心,使用酶联免疫试剂盒检测母猪血清中E2、EPO、PTH、Cor和T4激素水平和仔猪血清中EPO、PTH、Cor和T4激素水平。检测过程严格按照试剂盒说明书进行。
1.6 母猪及仔猪血清抗氧化水平检测母猪及仔猪血清冰上融化后,离心,采用酶标仪法测定血清中MDA含量、ROS水平以及SOD的活力,其中ROS水平用荧光强度值(FIV)表示。微孔法检测血清中CAT、GSH-Px的活力。严格按照试剂盒说明书操作。

2 结果
2.1 攻胎饲粮添加25(OH)D3对高胎龄母猪血清激素的影响检测结果如表3所示,母猪妊娠85 d血清内E2、EPO、PTH、T4、Cor激素在各组之间均无显著性差异(P>0.05)。表4中的结果表明,与对照组相比,母猪妊娠114 d时的25(OH)D3组E2激素含量显著降低(P<0.05),但EPO激素含量显著上升(P<0.05)。妊娠114 d,母猪血液内T4激素含量均有升高,但各组之间均无显著性差异(P>0.05);低钙组母猪血清中PTH含量显著高于25(OH)D3组和低钙+25(OH)D3组(P<0.05),但与对照组相比没有显著性差异(P>0.05)。Cor激素在低钙+25(OH)D3组含量最高,且显著高于25(OH)D3组(P<0.05),除此之外,其他各组之间均差异不显著(P>0.05)。主效应分析表明,饲粮中添加25(OH)D3可显著提高母猪EPO的激素水平(P<0.05),低钙的情况下可造成Cor含量上升。
表3 各组妊娠85 d母猪血清中激素表达水平
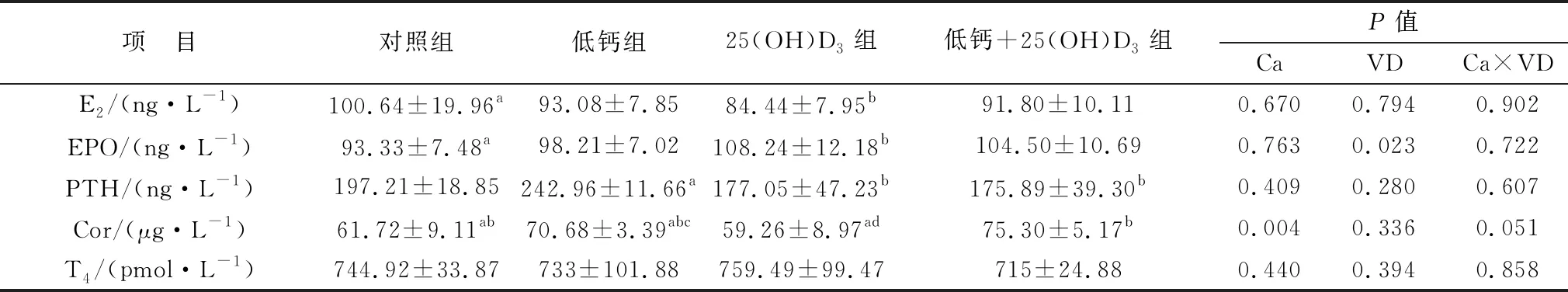
表4 各组妊娠114 d母猪血清中激素表达水平
2.2 攻胎饲粮中添加25(OH)D3对仔猪血清激素的影响初生仔猪血清激素检测结果如表5所示,25(OH)D3组仔猪血清中EPO含量显著高于对照组(P<0.05),低钙+25(OH)D3组EPO含量显著低于低钙组和25(OH)D3组(P<0.05)。仔猪血清T4含量在各组之间均无显著性差异(P>0.05)。与对照组相比,低钙组、25(OH)D3组和低钙+25(OH)D3组血清PTH激素含量均显著升高(P<0.05)。Cor含量在25(OH)D3组显著低于其他3个试验组(P<0.05)。主效应分析表明,钙和25(OH)D3联合能显著降低EPO激素水平的表达(P<0.05),钙能显著影响Cor激素水平。

表5 各组初生仔猪血清中激素表达水平
2.3 添加25(OH)D3对高胎龄母猪血清抗氧化水平的影响如表6所示,母猪妊娠85 d,抗氧化各指标在各组之间均无显著性差异。表7所示,相比于对照组,妊娠母猪114 d时,25(OH)D3组与低钙组的ROS水平显著降低(P<0.05),但低钙+25(OH)D3组ROS含量高于两者。妊娠114 d母猪血清中,25(OH)D3组和低钙+25(OH)D3组血清中SOD、CAT、GSH-Px的含量显著高于对照组和低钙组(P<0.05),与此同时,低钙组中CAT含量与对照组相比显著降低(P<0.05)。MDA水平在各组之间均没有显著变化(P>0.05)。主效应分析表明,在饲料中添加25(OH)D3可显著提升SOD、CAT、GSH-Px的表达量(P<0.05)。
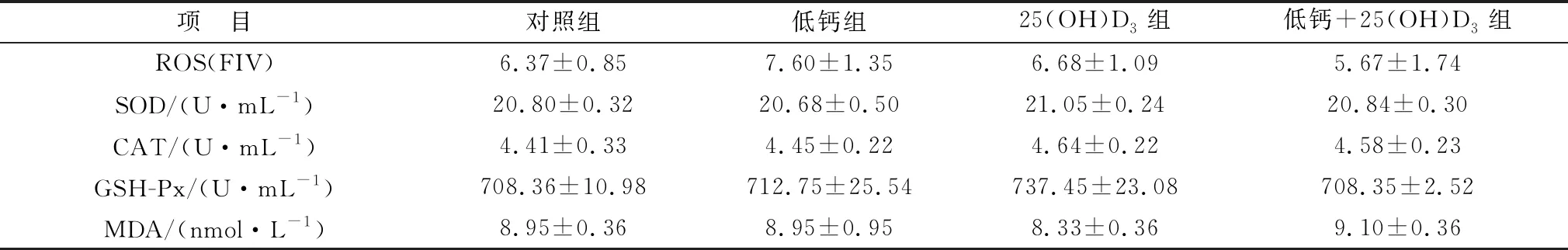
表6 各组妊娠85 d母猪血清中抗氧化指标水平

表7 各组妊娠114 d母猪血清中抗氧化指标水平
2.4 母猪饲粮中添加25(OH)D3对仔猪血清抗氧化水平的影响如表8所示,初生仔猪低钙组和低钙+25(OH)D3组血清中ROS水平显著低于对照组(P<0.05)。与母猪血清激素抗氧化水平检测结果相同,初生仔猪25(OH)D3组和低钙+25(OH)D3组血清中SOD、CAT的含量显著高于对照组和低钙组(P<0.05)。GSH-Px和MDA水平在各组之间均没有显著变化(P>0.05)。主效应分析结果表明,25(OH)D3可以显著提高仔猪的抗氧化水平。
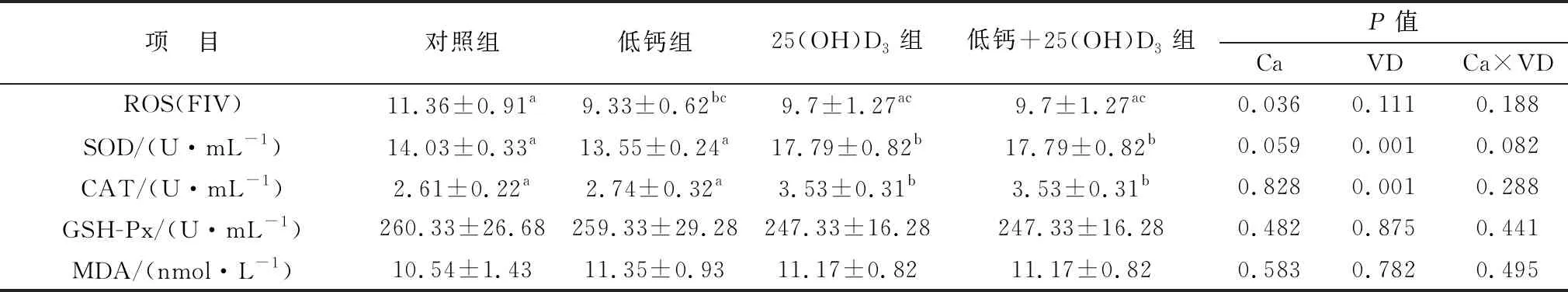
表8 各组初生仔猪血清中抗氧化指标水平
3 讨论
3.1 攻胎饲粮中添加25(OH)D3对母猪及仔猪血清激素的影响胆骨化醇是补充维生素D常见的渠道,肠黏膜吸收胆骨化醇之后转变为25(OH)D3,继而转变为1,25-二羟基维生素D3(1,25(OH)2D3)。激素对机体的生长、发育、繁殖、代谢等起着重要的调节作用,适当的调节激素水平对机体生长发育等有促进作用[9-10]。钙稳态是通过肠道吸收、肾脏排泄和骨代谢来调节的,这些过程受PTH、性激素和维生素D等调控[11]。PTH作为与机体生长发育至关重要的激素之一,其含量与机体内钙和25(OH)D3的含量密不可分。机体可通过调节PTH的含量来控制血清内25(OH)D3与钙的平衡,当机体缺乏维生素D时,PTH分泌增多,且血清中的PTH与25(OH)D3含量成反比[12-13]。同时有研究表明[14],PTH能动员钙从骨组织中释放到血清中,低钙会在一定程度上提高PTH的表达量。在本研究中,低钙组母猪和仔猪血清内PTH含量最高,且低钙组母猪血清内PTH含量显著高于25(OH)D3组和低钙+25(OH)D3组,同时低钙组仔猪血清PTH含量显著高于其他3个试验组,本试验结果对PTH、钙、维生素D之间的相互影响做了印证。4个试验组中,25(OH)D3组的E2激素表达量最低并显著低于对照组,低钙+25(OH)D3组表达量也低于对照组,但差异不显著。母体妊娠8周之后,E2主要由胎儿-胎盘分泌,且妊娠后期母体E2水平上升会导致胎儿获得的营养物质减少,引起胎儿T4水平下降,生长速度下降[15,16]。而本试验中,各试验组间母猪和仔猪血清T4含量均没有显著性差异。且母猪25(OH)D3组血清内T4含量最高,低钙组及低钙+25(OH)D3组依次低于对照组;仔猪25(OH)D3组血清内T4含量最低,低钙+25(OH)D3组及低钙组依次高于对照组。陈胜等[15]在对兔的研究中发现,母兔TH水平上升对初生仔兔TH水平无显著影响。但BUZZARD等[17]认为,由于种间成熟期以及胎盘屏障的通透性的差异性,其结果会有一定的差异。根据试验结果推测机体内钙和25(OH)D3的含量对T4水平没有显著的影响。
促红细胞生成素(EPO)是由肾皮质肾小管周围间质细胞和肝脏细胞分泌的一种激素类物质,参与红细胞前体细胞的分化与成熟。KIM等[18]发现EPO在体内可通过激活JAK/STAT信号通路促进骨形态蛋白(BMP2)的产生和骨形成,同时EPO在体外可以直接激活间充质细胞分化为成骨细胞[18]。用25(OH)D3喂养高胎次母猪可减少骨代谢,改善骨状态,同时也可增强初生仔猪的生长性能及骨状态[19]。本试验结果表明,25(OH)D3组母猪及仔猪血清内EPO激素水平显著高于对照组,但是低钙组母猪及仔猪血清中EPO含量均高于对照组,但差异不显著。对各组EPO的表达量进行分析后我们发现,25(OH)D3在母猪血清EPO的变化中起主效应;而在仔猪血清中钙和25(OH)D3联合作用起主效应,但对于仔猪低钙组EPO表达量的升高,推断缺钙初期机体会代偿性产生较多的EPO,但其作用机制还需要进一步深入研究。Cor是一种内源性的糖皮质激素,参与哺乳动物各种复杂的生物效应,如生长、免疫反应和新陈代谢,在机体受到压力时会升高。试验结果显示,25(OH)D3组母猪与仔猪血清中Cor含量最低,由此推断25(OH)D3可以减轻母猪孕期压力。对各组母猪血清内Cor含量进行分析发现,钙在Cor的表达中起主效应。
3.2 攻胎饲粮中添加25(OH)D3对母猪及仔猪血清抗氧化水平的影响ROS被认为是生成ATP过程中的氧化代谢产物,ROS的积累超过细胞抗氧化能力水平时会损伤细胞,有研究表明Ca2+与ROS有一定的关联[20-21]。母猪缺钙会使线粒体呼吸会受到一定程度的抑制,导致ROS含量降低[22]。本试验结果显示妊娠母猪低钙组血清中的ROS含量显著低于对照组,同时妊娠114 d的母猪25(OH)D3组血清内的ROS含量低于低钙组,推测其可能是因为Ca2+参与呼吸链中部分酶的合成,诱导ROS的产生。机体抗氧化水平与Ca2+的摄取量呈正相关,同时也受到1,25(OH)2D3激素的调控[23]。目前发现1,25(OH)2D3能增加抗氧化酶、解耦连蛋白2(CUP2)、CUP3的表达[24]。UCP可抑制电子传递链中电子泄露,降低能量代谢中产生的自由基[25]。
SOD是一种需氧生物中以超氧阴离子为底物的酶,也是一类重要的氧自由基清除剂,妊娠后逐渐增加。CAT是一种机体内广泛存在的一类末端氧化酶,能催化H2O2分解,减少羟自由基(·OH)的产生,清除体内ROS,减轻其对细胞的损害[26]。GSH-Px是机体内存在的含硒清除自由基和抑制自由基反应的系统,可以清除ROS和酯质过氧化物。本试验结果显示,25(OH)D3组在母猪及仔猪血清中SOD、CAT的活力显著高于对照组与低钙组,而低钙+25(OH)D3组SOD、CAT的活力处于25(OH)D3组和低钙组之间,且25(OH)D3对SOD、CAT的活力影响起主效应,同时母猪血清中GSH-Px有着相同的结果;表明25(OH)D3可以有效改善高胎龄母猪及初生仔猪的抗氧化能力。

