不同年龄段女性胶质母细胞瘤差异蛋白组学分析
兰春燕 李海南 王 磊 戴利军 邵佳芬 高华方,* 马 旭
1.国家卫生健康委科学技术研究所(北京,100081);2.北京协和医学院研究生院;3. 广东三九脑科医院
胶质瘤是最常见的原发性颅内中枢神经系统肿瘤[1],约占颅内恶性肿瘤的80%,其中胶质母细胞瘤(GBM)是恶性程度最高的胶质瘤,患者病情发展隐匿,即使经过最积极的治疗,中位生存期仅为15个月[2]。研究表明,不同性别的患者驱动GBM发展的过程及对治疗反应方面存在差异,且年龄也是GBM预后的重要评判指标[3]。Ohgaki等[4]对751例不同年龄组GBM患者的研究发现,年龄<50岁GBM患者的生存期为8.8个月;而年龄≥50岁组GBM患者的生存期为4.1个月,即年龄≥50岁的晚发GBM患者的预后比中青年患者差[5]。多项研究致力于从基因层面探寻胶质瘤的新的治疗靶点[6-7],但由于蛋白是细胞生物学功能的直接执行者,因此蛋白组学是分析GBM相关疾病的强有力的工具[8]。本研究采用蛋白组学技术对不同年龄段女性GBM患者的差异表达蛋白进行分析,寻找与年龄相关的差异表达蛋白,并通过生物信息学分析为不同年龄段GBM女性患者的靶向诊疗提供思路。
1 资料与方法
1.1 临床资料
纳入广东省三九脑科医院2018-2020年收治的18例GBM女性患者为研究对象,患者中位年龄49岁(20~71岁)。其中年龄<50岁10例;≥50岁8例。本研究获得广东三九脑科医院伦理委员会的批准,患者或家属均知情同意并签署知情同意书。本研究符合《赫尔辛基宣言》。
1.2 样本制备与数据采集
所有组织样本均通过手术或活检的方式取自GBM患者脑部肿瘤病变区域。18例GBM活检组织均从-80℃冰箱取出,进行样本预处理。蛋白提取后,采用Bradford蛋白定量试剂盒进行蛋白浓度的测定,并通过凝胶电泳实验对条带清晰度等的判断进行蛋白质检。取120μg蛋白样品经胰蛋白酶酶解,采用18C除盐柱进行除盐后,进入质谱仪内上机检测。采用数据依赖采集(DDA)的方式进行真实谱图库的构建。使用配有Nanospray FlexTM(ESI)离子源的Q ExactiveTMHF-X 质谱仪进行数据的采集,设定离子喷雾电压为2.5kV,离子传输管温度为320℃,质谱全扫描范围为m/z 350-1500,使用高能碰撞解离(HCD)方法碎裂进行二级质谱检测。下机后的文件直接导入到Proteome Discoverer 2.2软件进行数据库的检索及蛋白的定量分析。
1.3 统计学分析
使用Excel软件筛选在所有GBM样本中均表达的蛋白。在R(版本3.6.1)语言环境下,R Studio利用limma软件包进行两组不同年龄段GBM组织内差异蛋白组学数据的处理,应用P<0.05及差异倍数(FC)>2的指标进行差异蛋白的筛选。使用ggplot2软件包进行两组间差异蛋白的可视化,将Log2(FC)作为横轴,-Log10(P)为纵轴进行火山图的绘制。使用微生信在线网站进行成比例韦恩图的绘制。采用Kobas软件对蛋白进行功能注释,使用metascape软件进行差异蛋白的基因本体(GO)细胞组成(CC)的富集分析,并进行京都基因和基因组百科全书(KEGG)功能富集分析。采用STRING软件进行99种差异显著蛋白的相互作用网络分析,并将分析结果导入Cytoscape v.3.7.2软件进行蛋白互作网络结果的可视化。
2 结果
2.1 差异蛋白组学分析
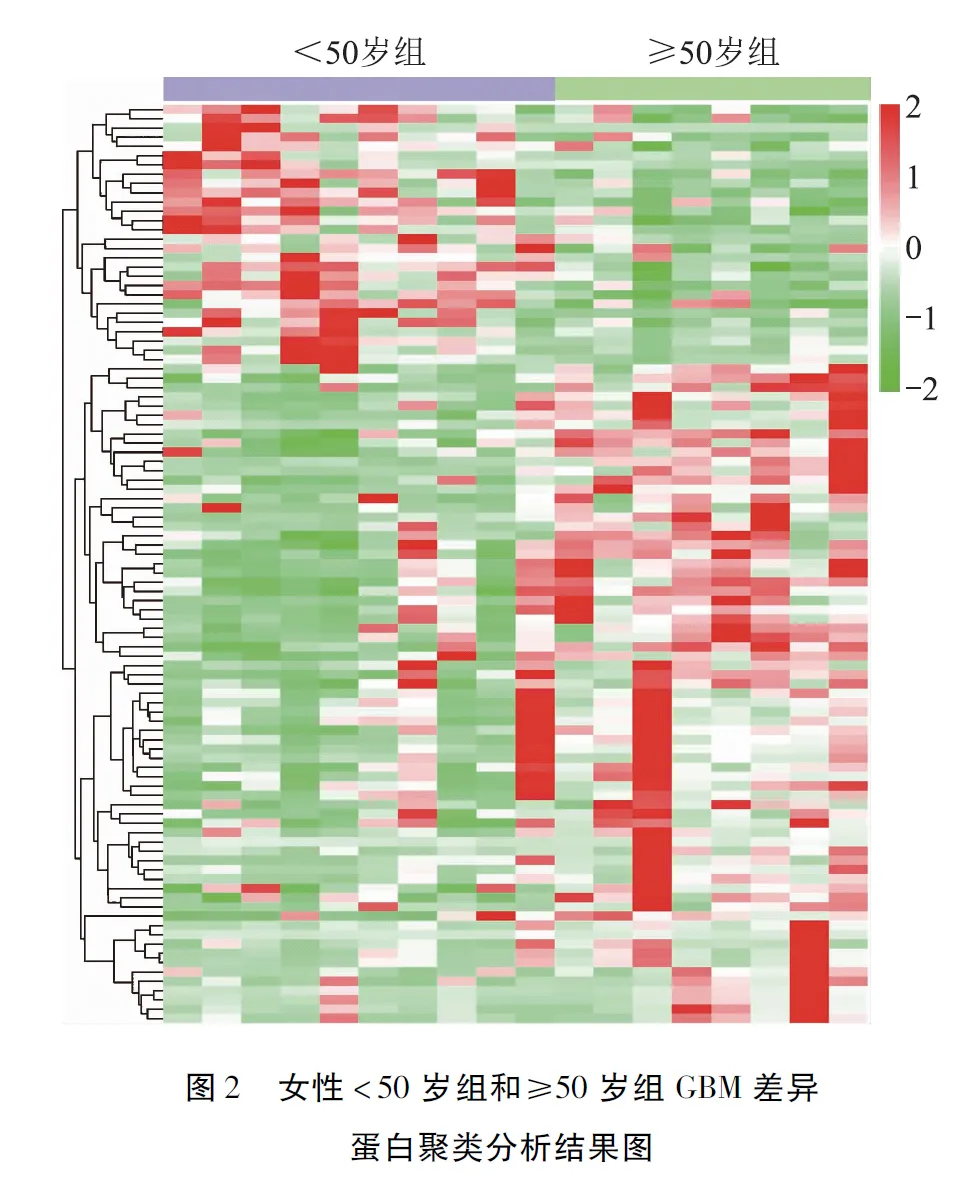
使用uniprot数据库进行蛋白的注释,可信度在99%以上的谱肽(PSMs)为可信PSMs,将至少含有1个特异性肽段的蛋白定义为可信蛋白,本研究只保留可信的谱肽和蛋白,并进行错误发现率(FDR)验证,去除FDR>1%的肽段和蛋白。通过上述过滤标准,在18例女性GBM患者中共鉴定到4617种蛋白,其中3530种蛋白在所有GBM组织中均表达。仅在年龄≥50岁的女性GBM患者中表达的蛋白数目为813种,而仅在年龄<50岁的女性GBM患者中表达的蛋白数目为274种。筛选得到≥50岁组GBM中上调表达蛋白共计71种,下调蛋白共计28种(图1)(1079页)。将数据归一化后进行聚类热图的绘制,能够可视化差异表达蛋白在每例患者病变组织内的上下调情况(图2)(1080页)。

2.2 差异表达蛋白功能富集分析
通过对差异蛋白进行GO细胞定位富集分析,发现差异蛋白主要定位在细胞外囊泡及肌动蛋白骨架及脂膜筏(图3A)(1080页)。通过KEGG信号通路富集分析发现,差异蛋白主要参与的信号通路是细胞凋亡和肌动蛋白细胞骨架的调节(图3B)(1080页),且参与上述信号通路的差异蛋白在高龄女性GBM患者中表达量均明显上调(P<0.05,FC>2)。

2.3 差异蛋白相互作用网络分析
对99种差异蛋白进行相互作用网络分析。以连接度大小作为关键蛋白的评价指标,本研究结合文献调研情况及数据分析结果,筛选了3个连接度最大的蛋白作为关键蛋白(图4)(1080页)。3个关键蛋白及其对应的编码基因分别是α1-酸性糖蛋白(ORM1)、膜联蛋白(ANXA2)、α1-酸性糖蛋白2(ORM2)。

3 讨论
GBM作为恶性程度最高的脑部肿瘤,主要见于成年人。人类对GBM疾病的病情进展及结局在性别和年龄上的差异已经成为共识,但目前尚无针对不同年龄段抑或是不同性别GBM患者的靶向针对性治疗,从分子角度探寻蛋白靶点对GBM患者的精准靶向治疗尤为必要。
蛋白组学技术可以进行高通量的蛋白筛选和发现,通过差异蛋白组学研究,有利于发现与疾病发生发展相关的重要蛋白分子,进而解析疾病发病机制,促进对疾病的精准诊疗。本研究采用DIA蛋白组学技术,数据采集的时候将整个扫描窗口划分为若干个窗口,再对每个窗口的离子进行二次碎裂,可以采集所有的离子信息[9]。相比于传统的DDA技术,该技术对蛋白的覆盖度更高,在18例GBM女性患者病变组织的DIA蛋白组学研究共鉴定了4617种蛋白。因此将<50岁组和≥50岁组女性患者肿瘤组织的差异表达蛋白进行功能富集分析和相互作用网络分析,可能会揭示女性GBM患者不同的预后原因。
α1-酸性糖蛋白是一种急性期反应蛋白,主要由肝脏分泌的蛋白质,有证据表明该蛋白也可在淋巴细胞和肿瘤细胞中合成[10-11]。已经有大量的研究报道该蛋白在患者体内的含量与多种肿瘤如肝癌、胰腺导管腺癌等疾病的预后呈负相关[12-13]。相关研究表明,相比存活期较长的GBM患者,α1-AG在预后差、生存期短的患者体内的含量更高,这可能是与α1-AG含量增加所导致的免疫功能受损密切相关[14]。这将为GBM的恶性进展提供机制的见解。
膜联蛋白是一种钙依赖性磷脂结合蛋白,是一种高丰度蛋白,在各种肿瘤细胞中异常高表达。研究表明该蛋白与炎症、肿瘤密切相关[15-16]。相关研究报道膜联蛋白与胶质瘤的增殖相关[17],是调节血管生成和恶性神经胶质瘤侵袭的因素,并且胶质瘤级别与该蛋白阳性率呈正相关[18]。该蛋白可能通过STAT3-cyclin D1信号通路调控胶质瘤细胞的增殖[19]。由此推断,该蛋白的高表达可能作为高龄GBM患者预后差的潜在蛋白标记。
综上所述,本研究对两个年龄段女性GBM的差异蛋白组学进行分析,不仅发现了差异蛋白的细胞定位及可能参与的信号通路,为了解高龄GBM患者预后,更为不理想的发病机制提供一定的思路;而且还挖掘了3个调节GBM恶性增殖的潜在蛋白靶点,这将为不同年龄阶段GBM患者的精准治疗有所帮助。不过这一初级结论还需后续扩大样本量进行验证的同时,纳入分子生物学实验,进一步探究本文挖掘的3个关键蛋白对GBM恶性增殖的调控作用以及潜在的分子机制。

