膜联蛋白A7在肾癌组织中的表达及对肾癌细胞生物学特性的影响
张亚丽,高海琴
(山西省太原市中心医院,山西 太原 030009)
1 材料和方法
1.1 材料及试剂 80例肾癌组织和相应的癌旁组织(距癌组织≥1 cm)样本均取自我院2014年1月至2016年1月收治的手术患者,并经病理诊断证实。肾癌患者中男57例,女23例;平均年龄(55.3±5.5)岁;根据2009年美国癌症联合会(AJCC)TNM分期标准[7]分类,Ⅰ期17例,Ⅱ期22例,Ⅲ期26例,Ⅳ期15例。Fuhrman分级[8]:1级35例,2级37例,3级8例。采用定期复查和电话相结合的方式随访3年且随访资料完整。统计患者的总生存期(OS)。OS定义为患者从病理学确诊日期开始至死亡或末次随访日期。本研究经医院医学伦理委员会批准(批准文号:TYZZYY〔2014〕1802),患者及家属均知情同意。
人肾癌786-O细胞购自中国科学院上海细胞库。慢病毒包装的ANXA7和表皮生长因子受体(EGFR)过表达慢病毒质粒p HRi-ANXA7、p HRi-EGFR和短发夹RNA(shRNA)慢病毒表达质粒p HRi-sh-ANXA7均购自上海吉玛有限公司。RPMI1640培养基及胎牛血清购自美国Gibco公司;反转录试剂盒购自美国Sigma公司;Lipofectamine-3000转染试剂购自美国Vector公司;Trizol试剂盒购自Ta KaRa公司;凋亡检测试剂盒购自上海碧云天生物技术公司;免疫共沉淀试剂盒Anti-HA Immunopreci-pitation Kit购自Sigma公司;Western Blot试剂盒购自美国BD公司;小鼠多克隆抗体Anti-Annexin-7、兔多克隆抗体Anti-EGFR均购自美国Abcam公司。
1.2 RT-qPCR检测肾癌组织中ANXA7的表达 依据Trizol法提取各组样本的总RNA,使用引物如下:ANXA7(FP:5'-AGGTCGGTGTGAACGGATTTG-3',RP:5'-TGTAGCCATGTAGTTGAGGTCA-3')。反 应 条件:75℃预变性,2 min,进入以下循环:90℃变性,5 min;60℃退火,60 s;72℃延伸,30 s;共40个循环。相对表达量用2-CT表示。每个样本独立重复实验3次。
1.3 免疫组化检测肾癌组织中ANXA7的表达 组织切片常规脱蜡和水化后置于PBS缓冲液中高压修复,然后用3%过氧化氢室温下浸泡以阻断内源性过氧化物酶,封闭,分别加稀释好的一抗4℃过夜孵育,次日复温后PBS洗涤干净,分别加稀释好的二抗,室温孵育30 min,PBS洗涤。加适量DAB孵育5 min,去离子水终止反应,苏木素复染5 min,无菌水冲洗后,依次用不同浓度梯度的乙醇脱水2 h,无菌滤纸吸净表面残存液体,使用二甲苯透明,中性树胶封片,光学显微镜观察组织形态并拍摄。细胞质或细胞核内呈棕黄色颗粒判断为ANXA7阳性染色细胞,每张切片随机选取5个视野,计算细胞阳性率后取平均值。
1.4 细胞培养及转染 人肾癌786-O细胞用含10%胎牛血清RPMI1640培养基培养,每2日换液1次,汇合率达90%左右传代。取对数生长期髓核细胞进行转染,采用Lipofectamine 3000通过脂质体介导法将慢病毒包装的ANXA7、sh-ANXA7和EGFR质粒分别转染至786-O细胞中,转染按Lipofectamine 3000试剂说明书操作。细胞分为Control组(未转染)、NC组(转染慢病毒质粒空载)、ANXA7组(转染p HRi-ANXA7)、sh-ANXA7组(转染p HRi sh-ANXA7)、EGFR组(转染p HRi-EGFR)、ANXA7+EGFR 组(转染p HRi-ANXA7和p HRi-EGFR)、sh-ANXA7+EGFR组(转染p HRi sh-ANXA7和p HRi-EGFR)。
1.5 平板克隆实验检测细胞增殖 转染后细胞培养48 h,胰蛋白酶消化各组细胞并按每孔5×103个密度铺6孔板继续培养,隔周更换新鲜培养液,2周后用考马斯亮蓝染色,以大于30个细胞的克隆记为一个菌落,在显微镜下观察并拍照记录菌落形成数量,每组设3个复孔,重复实验3次。
1.6 流式细胞术检测肾癌细胞凋亡率 胰蛋白酶消化各组细胞,用预冷的1×PBS清洗2次,buffer缓冲液重悬并轻柔吹打混匀,调整各组细胞量约为1×105个,加入Annexin V-FITC 5μL混匀后,再加入PI 5μL,室温下静置15 min后,用流式细胞仪测定各组细胞凋亡率。
1.7 免疫共沉淀检测ANXA7与EGFR的相互作用用1×PBS清洗细胞,加入裂解液于冰上裂解蛋白,将裂解液分为正向免疫沉淀和反向免疫沉淀两组,分别加入ANXA7抗体和EGFR抗体,4℃孵育过夜;按照试剂盒说明书将HA琼脂糖beads加入上述孵育好的裂解液中,4℃振荡孵育1 h后,离心收集琼脂糖beads,弃上清,并用1 m L裂解缓冲液清洗3次,Western Blot分析结果。
1.8 Western Blot检测PI3K/AKT信号通路蛋白表达 分别收集各组样本,用裂解液裂解组织及细胞,提取总蛋白并测定蛋白浓度。制备蛋白样品并上样、电泳,转至PVDF膜,加含有5%BSA的封闭液室温下封闭2 h。加入适宜浓度一抗,4℃封闭过夜。次日用缓冲液清洗PVDF膜3次,加入二抗,室温孵育1 h后,加入显色液曝光显影。
由于当天云层非常厚,而村落中高高的屋檐下光线比较昏暗。在这种光线下拍摄,我换上了大光圈定焦镜头将光圈开到最大,此时快门速度依旧无法达到安全范围。好在松下G9相机机内搭载了5轴防抖技术,可以提供相当于6.5挡的快门速度补偿,与镜头光学防抖相互匹配,即便在边走边拍的手持拍摄情境下,依然可以得到清晰的图像。
1.9 统计学方法 采用SPSS 16.0统计软件进行χ2检验,Kaplan-Meier法绘制生存曲线,用Log-rank检验比较组间生存率。P<0.05表示差异具有统计学意义。
2 结果
2.1 ANXA7在肾癌组织中的表达 采用RT-qPCR对肾癌组织及其癌旁组织中ANXA7 mRNA的表达进行检测,免疫组化检测ANXA7蛋白的表达。结果如图1(见本期第125页)所示,与癌旁组织相比,肾癌组织中ANXA7的mRNA表达量明显下降(P<0.05);免疫组化结果显示,ANXA7在肾癌组织中以阴性表达为主,而在癌旁组织中以阳性表达为主。在肾癌组织中ANXA7阳性表达率为31.25%(25/80),显著低于癌旁组织的80.00%(64/80),差异有统计学意义(P<0.05)。

图1 ANXA7在肾癌组织中的表达
2.2 ANXA7蛋白与临床病理参数之间的关系ANXA7蛋白的表达在不同年龄、性别和不同肿瘤大小的患者组织中差异无统计学意义(P>0.05);而在不同Fuhrman分级、淋巴结转移和肿瘤TNM分期的患者癌组织中表达差异均有统计学意义(P<0.05)。见表1。
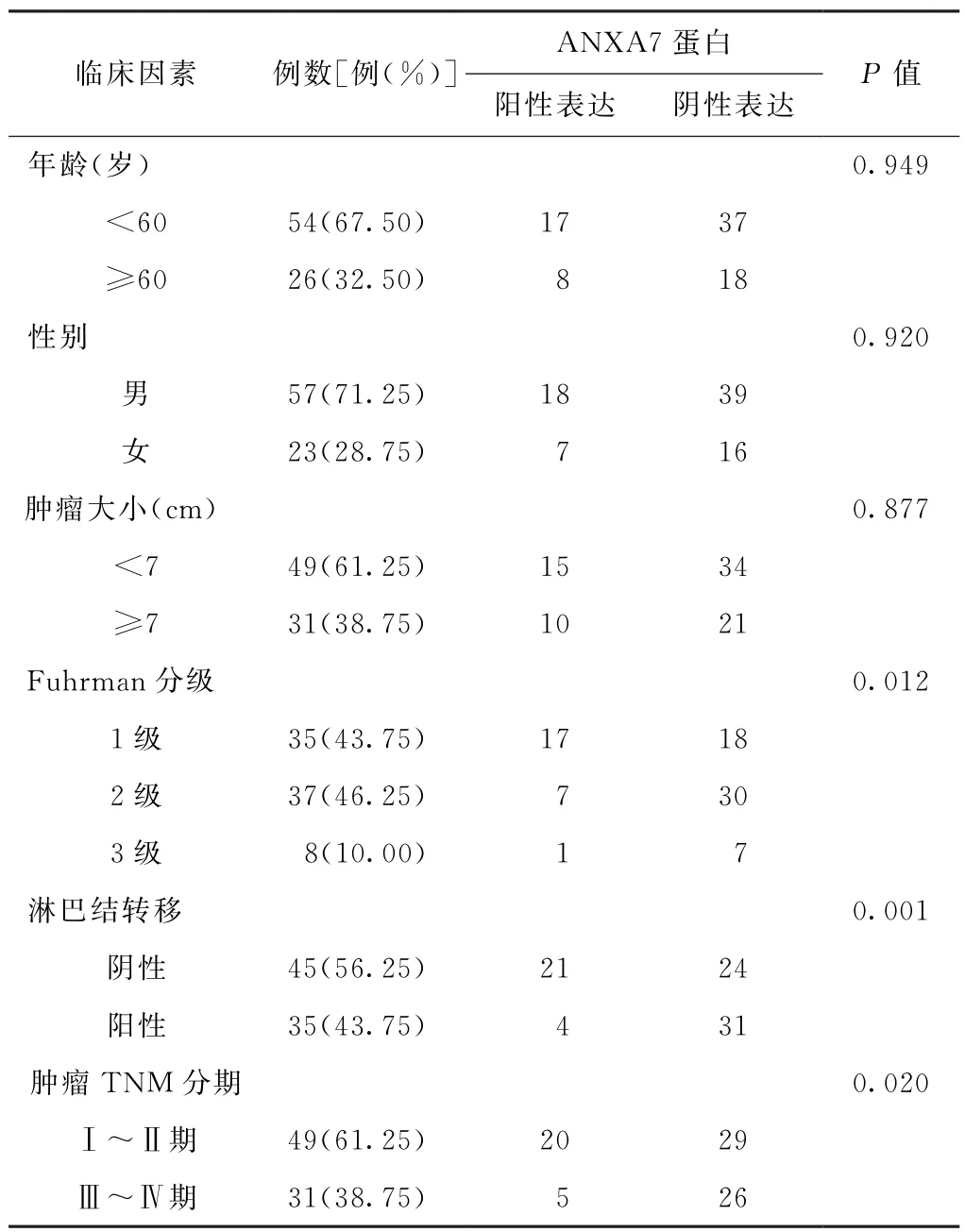
表1 ANXA7的表达与临床病理指标的相关性分析(n=80)
2.3 ANXA7蛋白与肾癌患者预后生存分析 Kaplan-Meier生存分析显示,ANXA7阳性表达组生存率为80.00%(20/25),阴性表达组生存率为50.91%(28/55),阳性表达组生存率高于阴性表达组,差异有统计学意义(P<0.05)。见图2(见本期第125页)。
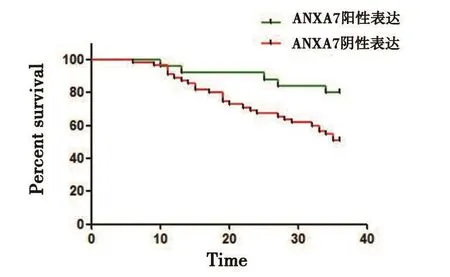
图2 ANXA7表达与肾癌患者预后生存分析
2.4 平板克隆实验检测ANXA7对786-O细胞增殖的影响 平板克隆实验结果如图3(见本期第125页)所示,过表达ANXA7后,与NC组相比,ANXA7组细胞克隆数明显减少(P<0.05);敲低ANXA7后,与NC组相比,sh-ANXA7组细胞克隆数明显增多(P<0.05),提示ANXA7能够抑制肾癌786-O细胞增殖。
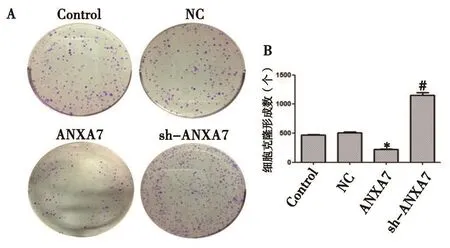
图3 ANXA7的表达对786-O细胞增殖能力的影响
2.5 流式细胞术检测ANXA7对786-O细胞凋亡的影响 流式细胞术结果如图4(见本期第125页)所示,过表达ANXA7后,与NC组相比,ANXA7组细胞凋亡率显著升高(P<0.05);敲低ANXA7后,与NC组相比,sh-ANXA7组细胞凋亡率显著下降(P<0.05),提示ANXA7能够促进肾癌786-O细胞的凋亡。
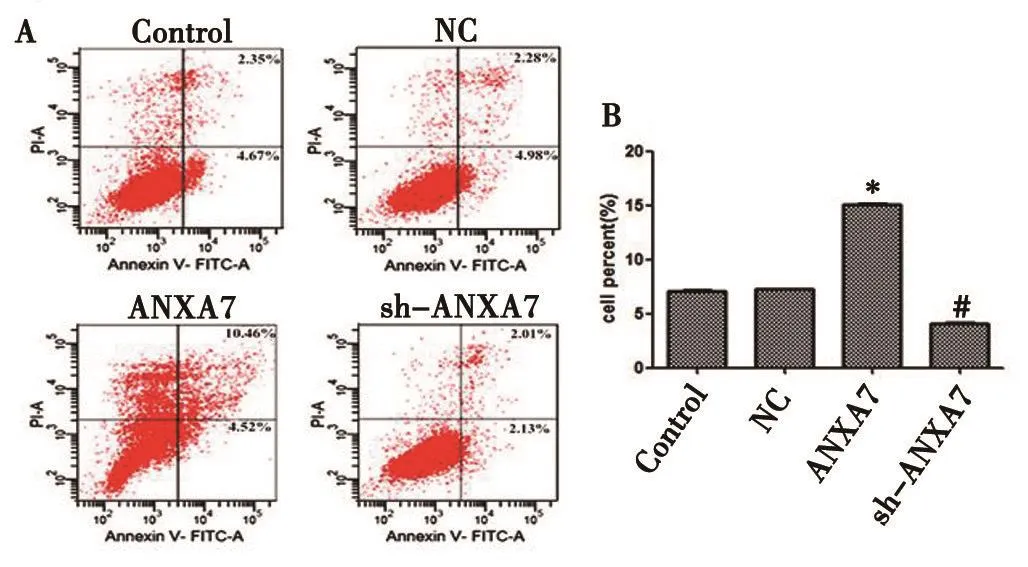
图4 ANXA7的表达对786-O细胞凋亡的影响
2.6 ANXA7与EGFR的相互作用关系 通过GENEMANIA网站预测分析发现,ANXA7与EGFR存在相互作用关系,分别用ANXA7和EGFR抗体进行正向和反向免疫共沉淀实验,结果如图5所示,EGFR蛋白能与含ANXA7的抗体磁珠结合;相反,ANXA7蛋白也能与含EGFR的抗体磁珠结合,表明两者在肾癌786-O细胞中存在结合作用。
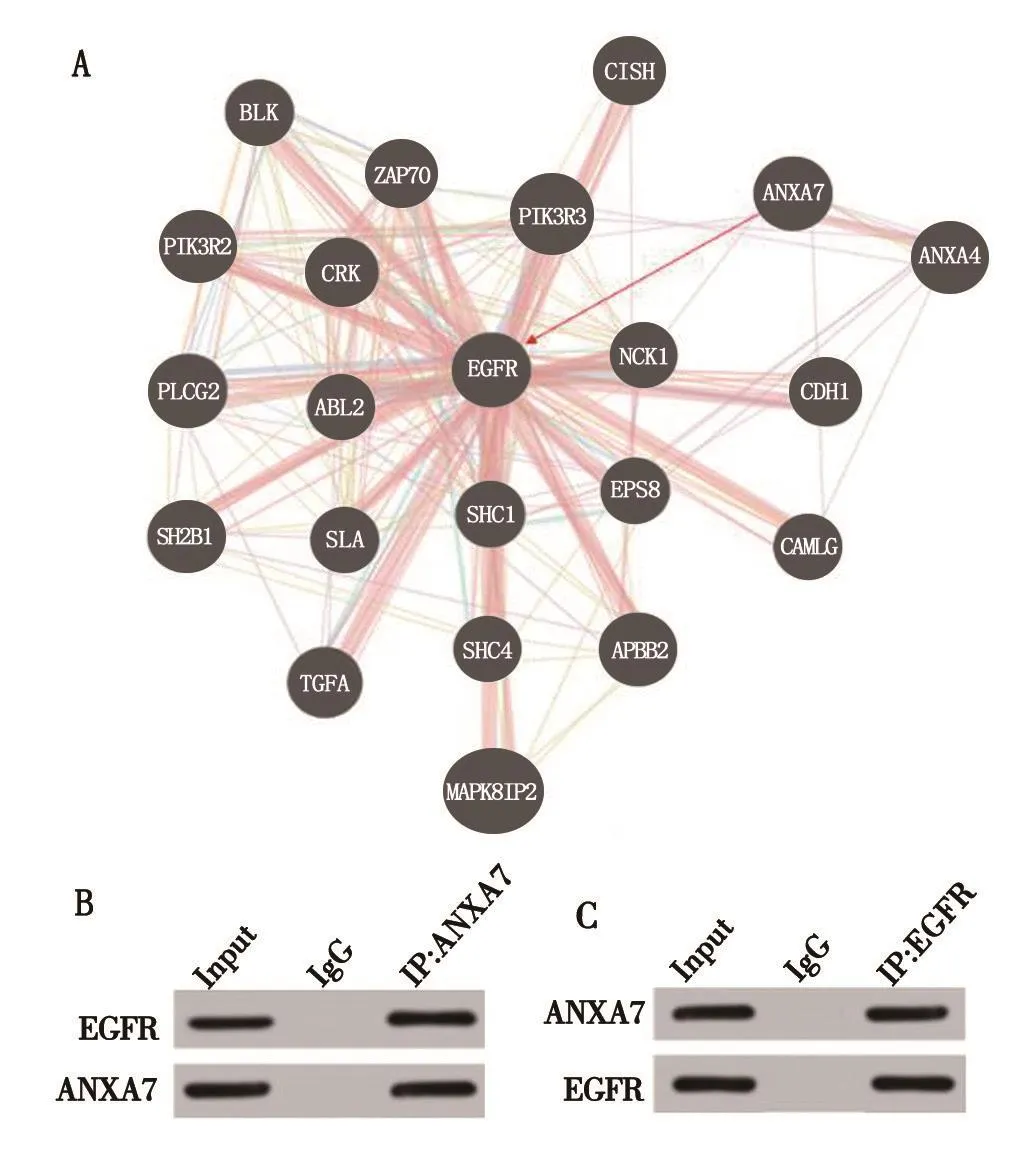
图5 ANXA7相互作用于EGFR
2.7 ANXA7经EGFR参与对PI3K/AKT信号通路的调节 Western Blot检测结果如图6所示,与NC组相比,过表达EGFR后,786-O细胞中PI3K和P-AKT表达升高(P<0.05);EGFR与ANXA7共表达后,细胞比仅表达EGFR的细胞PI3K和P-AKT表达水平降低(P<0.05);相反,在EGFR表达的基础上抑制ANXA7的表达,会进一步升高PI3K和P-AKT的表达,表明ANXA7可通过EGFR抑制PI3K/AKT细胞信号通路相关蛋白的表达。
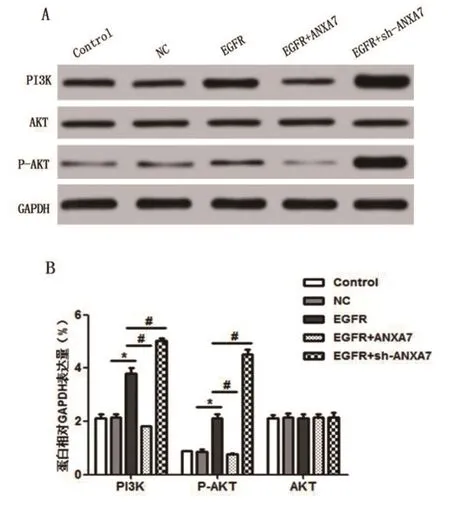
图6 EGFR和ANXA7的表达对PI3K/AKT信号通路蛋白的影响
3 讨论
目前,多数类型的肾癌由于其多重耐药性,对放疗和化疗均不敏感[9],而现有的治疗手段较难获得良好的治疗效果,因此研究肾癌发生发展中的分子机制,寻找有效的分子靶点成为近年来研究的重点。
ANXA7编码基因位于人类染色体10q21,是膜联蛋白家族中的一员[10]。研究表明,ANXA7作为一种肿瘤抑制因子,其表达水平下调与多种肿瘤的恶性程度、侵袭能力及远处转移能力等密切相关[11-13],可能成为进一步探索肿瘤发生发展及治疗的生物学标志物。本研究通过对肾癌患者癌组织及其癌旁组织进行RT-qPCR和免疫组化检测,发现与癌旁组织相比,ANXA7在肾癌组织中阳性表达明显降低(P<0.05)。将ANXA7蛋白表达情况与我院80例肾癌患者的临床病理参数进行相关性分析发现,ANXA7的表达与不同Fuhrman分级、淋巴结转移和肿瘤TNM分期均显著相关(P<0.05)。Kaplan-Meier生存分析结果表明,ANXA7阳性表达组生存率显著高于阴性表达组,提示ANXA7的阳性表达能够抑制肾癌的发展,提高肾癌患者的生存率。
ANXA7的低表达可在肿瘤细胞中通过影响细胞增殖及凋亡相关基因表达,造成基因组不稳定,从而促进肿瘤发展[14-15]。本研究分别在肾癌786-O细胞中过表达和敲低ANXA7的表达,通过克隆形成实验和流式细胞术检测ANXA7对786-O细胞增殖和凋亡的影响,发现过表达ANXA7能明显抑制786-O细胞增殖,促进细胞凋亡;而敲低ANXA7则得到相反的结果,表明ANXA7可能通过抑制癌细胞增殖,甚至促进其凋亡而抑制肾癌的发展。
EGFR是细胞膜表面的糖蛋白受体,具有酪氨酸激酶活性,当与配体表皮生长因子结合,可使酪氨酸残基磷酸化,激活EGFR[16],EGFR二聚化后激活Ras蛋白,产生磷酸化级联反应,进而激活PI3 K/AKT信号通路,使肿瘤细胞无法启动程序性死亡,并促进肿瘤细胞增殖,抑制凋亡[17]。MAULE等[18]研究发现,ANXA7能够通过下调EGFR的活化,进而抑制PI3 K信号通路的活化,从而负向调控胶质瘤进展。NAIR[19]等研究表明ANXA7的缺失会激活EGFR信号而促进致癌性,而恢复ANXA7的表达会降低EGFR水平,激活下游通路,降低致癌性。本研究首先通过GENEMANIA网站预测发现ANXA7与EGFR存在相互作用,并通过正向和反向免疫共沉淀验证ANXA7与EGFR在786-O细胞内能相互结合,表明ANXA7与EGFR存在相互作用关系。通过Western Blot实验发现EGFR在肾癌中能激活PI3K/AKT信号通路,在此基础上进一步分析了ANXA7是否通过EGFR参与对PI3K/AKT信号通路的调节。结果显示在EGFR存在的情况下,过表达ANXA7能够抑制PI3K/AKT信号通路相关蛋白的表达,而敲低ANXA7能够进一步促进PI3K的表达及AKT的磷酸化,提示ANXA7在肾癌中能够通过抑制EGFR的表达调节PI3K/AKT信号通路,进一步实现对肾癌的抑制作用。
综上所述,ANXA7的阳性表达有利于延长肾癌患者的生存期,并初步探讨了其对肾癌影响的分子机制,为肾癌的研究找到新的分子靶点。后续研究将对EGFR进行干预,深入研究ANXA7与EGFR的作用关系,以期为肾癌的临床治疗提供更有效的理论依据。

