BIND评分、B/A及AABR对新生儿急性胆红素脑病预后不良的早期预测价值
张瑞丽,徐发林,李文华
(郑州大学第三附属医院 新生儿科,河南 郑州 450052)
新生儿高胆红素血症非常普遍,严重者可导致急性胆红素脑病(acute bilirubin encephalopathy,ABE)或慢性胆红素脑病[1]。胆红素神经毒性的发生与高水平的游离胆红素透过血脑屏障沉积在脑内,使神经细胞出现复杂的功能变化,引起细胞凋亡或坏死有关[2]。我国一项关于胆红素脑病的多中心研究[3]显示,胆红素脑病患儿的病死率为16.1%,42.2%的患儿遗留后遗症。胆红素诱导的神经功能障碍(bilirubin-induced neurologic dysfunction,BIND)评分从精神状态、肌张力、哭声3个方面对ABE患儿进行评分,得分越高,表示胆红素神经毒性越重[4],然而对于ABE患儿预后的预测价值国内报道较少。血清总胆红素与白蛋白比值(bilirubin-albumin ratio,B/A)与ABE的严重程度密切相关,可作为不良预后的预测指标[5],自动听觉脑干诱发电位技术(automatic auditory brainstem response,AABR)可用于评估胆红素毒性所致神经后遗症[6]。本研究不仅着重于单一指标,还将通过ROC曲线综合性评估BIND评分、B/A、AABR这3项指标对ABE患儿发生不良预后的早期预测价值。
1 材料和方法
1.1 研究对象选取2015年1月至2019年12月于郑州大学第三附属医院新生儿重症监护室收治的ABE的患儿,纳入标准:(1)符合ABE的诊断标准[7-8],包括①高胆红素血症,同时出现典型神经系统症状,例如昏睡、进食差、肌张力增高/减低、易激惹、尖叫、角弓反张、抽搐、甚至死亡等;②头颅磁共振成像(magnetic resonance imaging,MRI)显示特征性对称性T1、T2加权图像中的苍白球高信号,符合①或②诊断即可成立;(2)胎龄≥35周。排除标准:(1)合并染色体病,遗传性或代谢性疾病等导致的先天性脑损伤;(2)合并化脓性脑膜炎、低血糖脑病,缺氧缺血性脑病、Ⅲ~Ⅳ级颅内出血、脑软化;(3)耳聋家族病史及耳源性听力损伤;(4)临床资料不完整。该研究获得郑州大学第三附属医院医学伦理委员会批准[2020(095)],患儿家属均知情同意。
1.2 方法
1.2.1临床资料收集及随访 收集资料包括患儿性别、出生体质量、胎龄、分娩方式、入院体质量、入院时BIND评分、是否存在ABO溶血、RH溶血、败血症,总胆红素(serum total bilirubin,TSB)达峰值日龄等。入院后完善实验室检查,记录TSB峰值、血浆白蛋白(albumin, ALB)、B/A,出院前或换血后1周进行头颅MRI及AABR检查,并记录结果。T1加权苍白球对称性高信号为MRI异常,AABR仪器筛查听觉功能,单耳/双耳检查未通过为AABR异常。每隔3个月定期随访1次,采用Bayley婴幼儿发育量表(第2版)评估12个月月龄时患儿生长发育情况,根据随访结果,分为预后正常组和预后不良组。不良预后包括死亡,或存活但遗留以下任一并发症,包括脑瘫、运动障碍、听力丧失(需佩戴助听器)、眼球运动障碍、牙釉质发育不良。
1.2.2相关定义 (1)胆红素脑病是胆红素神经毒性的慢性和永久性的临床后遗症;(2)BIND评分[7],包括精神状态、肌张力、哭声3个方面进行神经功能评估,每个类别包括0~3分,总分0~9分,总分1~3分提示轻度ABE,4~6分提示中度ABE,7~9分提示重度ABE;(3)体质量下降≥10%指入院体质量比出生体质量下降≥10%。

2 结果
2.1 研究对象特征5 a内胎龄≥35周ABE患儿共126例,其中3例合并缺氧缺血性脑病,1例合并化脓性脑膜炎,2例临床资料缺失,故纳入120例ABE患儿,住院期间死亡4例。失访11(9.2%)例,成功随访105(87.5%)例。7例院外死亡,故总有11(9.2%)例死亡。随访发现有26(21.7%)例有神经系统后遗症,其中脑瘫(cerebral palsy,CP)2例,听力丧失5例,运动障碍4例,脑瘫合并听力丧失13例,运动障碍合并听力丧失2例。故预后不良组共37(30.8%)例,预后正常组共72(60.0%)例。
2.2 两组患儿临床资料比较两组患儿在胎龄、出生体质量、性别、分娩方式、TSB达峰值日龄、MRI异常、ABO溶血、RH溶血、是否换血方面差异无统计学意义(P>0.05)。预后不良组体质量下降≥10%、AABR异常、败血症、TSB峰值、B/A、BIND评分明显高于预后正常组(P<0.05),预后不良组ALB明显低于预后正常组(P<0.05)。见表1。
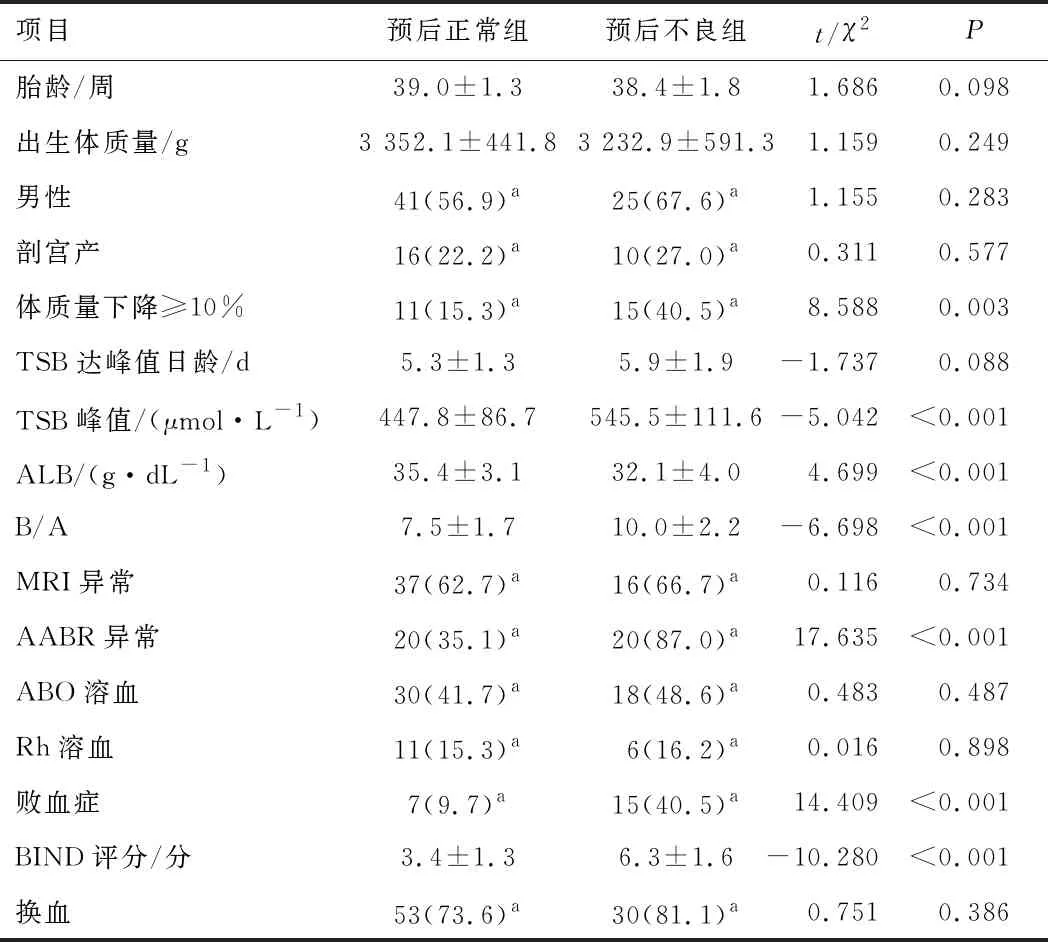
表1 两组患儿临床资料比较
2.3 BIND评分、B/A、AABR及三者联合预测ABE不良预后的ROC曲线结果ROC曲线(图1)表明,BIND评分、AABR 、B/A及三者联合预测ABE不良预后的ROC曲线下面积分别为0.883、0.753、0.869、0.925,均>0.7,提示均有预测价值,其中三者联合预测不良预后的ROC曲线下面积最大,预测价值更高,见表2,在最佳临界点上,对应的敏感性和特异性分别为73.9%、92.7%,87%、63.6%,91.3%、78.2%,95.7%、87.3%,见表3。这表明BIND评分、B/A比AABR能够更好地预测ABE不良预后,而3项指标联合预测效果最好。
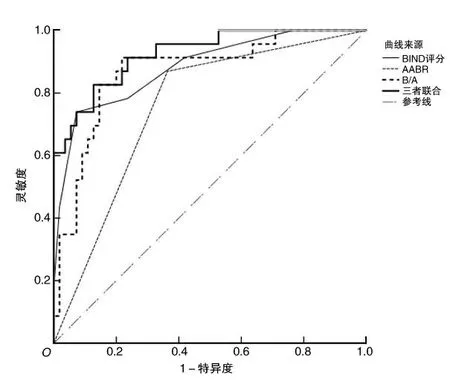
BIND为胆红素诱导的神经功能障碍;AABR为自动听觉脑干诱发电位技术;B/A为总胆红素/白蛋白。

表2 BIND评分、B/A、AABR及三者联合预测ABE不良预后的曲线下面积比较

表3 BIND评分、B/A、AABR及三者联合预测ABE不良预后的参数分析
3 讨论
ABE病死率高,可遗留严重神经后遗症,严重危害患儿生长发育[9]。胆红素脑病是高胆红素血症造成的严重的可预防的永久性脑损伤,即使是在拥有先进医疗水平的发达国家,这个问题仍不容忽视,尤其是在发展中国家,仍是较严峻的公共卫生问题[10]。
本研究显示预后不良组败血症发生率比预后正常组更高,差异有统计学意义。败血症会使血脑屏障通透性扩大,更多血浆胆红素进入中枢神经系统[11]。研究[12]表明,败血症和Rh溶血病使得新生儿胆红素脑病风险显著增加。本研究中,预后不良组体质量下降超过10%发生率也更高,有研究指出生后48 h后体质量下降率超过8%或72 h后体质量下降率超过11%可以作为发生严重高胆红素血症的预测指标[13]。这可能与摄入不足有关,能量不足和脱水会加快肠肝循环,导致黄疸加重,因此,早期开奶、监测血糖变化及维持能量供应对于这类新生儿尤其重要。
本研究ROC曲线分析显示,BIND评分≥6分可以较好地预测ABE不良预后,且敏感性为73.9%,特异性为92.7%,根据随访结果,37例预后不良患儿中27例BIND评分≥6分,可证实上述观点。这与既往研究[14-15]基本一致。本研究结果显示,预后不良组TSB峰值比预后正常组更高。TSB水平越高,游离胆红素水平越高,游离胆红素较TSB和B/A可更敏感准确地预测不良预后[16],但是游离胆红素测量困难,因此,TSB是新生儿高胆红素血症治疗和评价治疗效果的首选指标,TSB能够较好预测新生儿胆红素脑病的发生风险[17],但是TSB平时受胎龄、出生体质量、日龄等多方面影响,无法单独作为预后不良的预测指标,这与文献[18]一致。而B/A能够间接反映游离胆红素水平,与ABE的发生密切相关[19],目前已经作为胆红素神经毒性的评估指标[20]。本研究发现B/A≥8.3可预测ABE不良预后,且敏感性为91.3%,特异性为78.2%,这与先前研究[18]基本一致。
头颅MRI是ABE的诊断方法之一,表现为苍白球T1加权高信号,是ABE的重要标志。胆红素脑病时MRI表现为信号从T1加权序列上的高信号转变为苍白球和丘脑基底核T2加权对称性双侧高信号[19]。研究[21]发现,当苍白球与壳核T1WI信号强度比值大于1.29时,表明ABE患儿预后不良。本研究中,预后不良组的MRI异常率稍高于预后不良组,差异无统计学意义,这可能是因为在预后分析的109例患儿中,行MRI检查的患儿仅53例,数量较少,且新生儿髓鞘发育时MRI-T1WI亦可表现为高信号,可能会与异常高信号混淆,不利于预测价值分析。胆红素毒性反应最敏感部位是听觉系统,听觉脑干诱发电位或AABR能够较好预测ABE不良预后[22]。本研究发现AABR异常预测ABE不良预后的AUC为0.753,敏感性为87%,特异性为63.6%,有一定的预测价值,但单独预测效果低于BIND和B/A,应3项指标联合使用,敏感性更高,预测价值更好。
综上所述,BIND、B/A相较于AABR能够更好地预测新生儿急性胆红素脑病发生不良预后,而三者联合预测效果最好,这有助于临床医师积极快速采取干预措施,减少神经系统后遗症的发生。

