彩色多普勒超声联合血清glactin-3,HMGB-1和TSGF水平检测在甲状腺腺瘤诊断中的临床意义
赵白信,于慧娟,焦方杰,邢丽丽,黄 蕾,姚辉梅
(郑州市第七人民医院功能科,郑州 450000)
甲状腺癌(thyroid carcinoma,TC)是临床常见恶性肿瘤,其发病率在头颈部肿瘤中已跃居首位[1-2]。由于该病早期症状隐匿且无特异性,易与甲状腺肿、甲状腺腺瘤等混淆,误诊率、漏诊率高[3]。因此,探寻更为准确的TC 诊断方式广受临床关注。目前彩色多普勒超声是诊断TC 的常用方式,既可定位肿瘤位置,也能定性肿瘤,整体效果满意,但TC 表现的复杂性及多样性使得其单独应用受到一定限制。近年来血清标志物诊断肿瘤疾病的价值逐渐被挖掘。半乳糖血凝素-3(galactose hemagglutinin-3,glactin-3)、高迁移率族蛋白B-1(high mobility group box B-1,HMGB-1)和肿瘤特异性生长因子(tumor specific growthFanctor,TSGF)异常表达于小细胞肺癌、骨癌、TC 等多种恶性肿瘤[4-6],提示上述因子与肿瘤发生、发展相关,但目前鲜有关于三者与彩色多普勒超声联合诊断TC 价值的研究。本研究以156 例高度怀疑为TC的甲状腺腺瘤患者为研究对象,评价彩色多普勒超声联合血清glactin-3,HMGB-1 和TSGF 检测诊断TC 的价值。详述如下。
1 材料与方法
1.1 研究对象 从2017年7月~2019年7月本院高度怀疑为TC 的甲状腺腺瘤患者中抽取156 例,男性51 例,女性105 例,年龄35~71 岁,平均年龄52.17±7.26 岁;体质量指数(body mass index,BMI)18.01~28.12 kg/m2,平均23.05±1.13kg/m2。另从同期本院体检人群中随机抽取73 例设为健康组,男性18 例,女性55 例,年龄32~74 岁,平均年龄51.96±7.04 岁;BMI 18.12~27.64 kg/m2,平均23.34±1.38kg/m2。纳入标准:156 例患者经影像学检查证实存在甲状腺腺瘤,且至少符合以下1 项:①女性;②高辐射环境暴露史;③碘摄入量过多;④恶性肿瘤家族史。健康组经体检甲状腺各项指标正常;所有受试者沟通与理解能力均正常。排除标准:①已被确诊为甲状腺癌;②具有头颈部放疗史或(和)相关治疗史;③肝、肾等主要器官功能异常;④其他恶性肿瘤发生转移的患者;⑤妊娠期、哺乳期女性。该研究获得医院伦理委员会批准,受试者签署研究知情同意书。
1.2 仪器与试剂 glactin-3,HMGB-1 和TSGF酶联免疫吸附法(enzyme linked immunoserbent assay,ELISA)试剂盒由德国SIEMENS 股份公司提供;ACUSON Oxana Series 彩色多普勒超声诊断仪由德国SIEMENS 股份公司提供;AMR-100 全自动酶标分析仪由江苏盛蓝仪器制造有限公司提供。
1.3 方法
1.3.1 彩色多普勒超声诊断:选用彩色多普勒超声诊断仪,探头频率9~13 MHz。受试者保持仰卧体位,颈后放垫以垫高颈部,涂抹耦合剂于颈部皮肤,选用凸形探头,直接接触皮肤并将其置于甲状腺位置。顺甲状腺行横切、纵切十字交叉位检查,再行左右纵向扫查,观察结节回声,仔细记录结节位置、体积、数量、形态,并测量其收缩期峰值流速(peak systolic velocity,PSV)、阻力系数(resistance index,RI),观察其周围及内部血流分布。血流分级:病灶周围或内部未显示血流信号为0 级;病灶周围血流信号分布≤1/3 病灶周长或病灶内部血流信号分布≤1/3 病灶面积为I 级;病灶周围血流信号分布>1/3 病灶周长或病灶内部血流信号分布>1/3病灶面积为II 级;病灶周围信号基本占据全部周长或病灶内部血流信号极为丰富为III 级。由2 位具备相关资质的超声诊断医师评价检查结果。阳性判断标准:以钙化灶,RI >0.70,血流分级≥II 级[9]。
1.3.2 血清glactin-3,HMGB-1 和TSGF 水平测定:晨起空腹抽取受试者静脉血4 ml,采用ELISA法检测血清glactin-3,HMGB-1,TSGF 水平,检测步骤完全依照试剂盒说明书进行。采用全自动酶标分析仪测定450 nm 位置吸光光度值,重复测定3 次取平均值。血清指标阳性判断标准:glactin-3>16.03 ng/ml,HMGB-1 >11.00 ng/ml,TSGF >71.00 U/ml。彩色多普勒超声联合血清glactin-3,HMGB-1 和TSGF 检测采用平行检测方式,即≥1项为阳性则整体结果判定为阳性。
1.3.3 病理诊断:156 例高度怀疑为TC 的甲状腺腺瘤患者均经腔镜手术切除,其中腔镜下甲状腺腺瘤切除术74 例,甲状腺腺叶切除术41 例,甲状腺腺叶次全切除术22 例,双侧甲状腺次全切除术19 例。于手术过程中规范化采集病灶组织块(体积为2.0 cm×2.0 cm×0.3 cm),尽快置入液体固定剂中固定;采用乙醇脱水后将石蜡浸入组织中,后置入融化石蜡中完成包埋;石蜡切片,厚度4~6μm,经HE 染色后观察病理结果。以《甲状腺·甲状旁腺外科学》为诊断依据[8],术后对肿瘤标本进行病理诊断,固定染色后以胞浆或胞核中显示淡黄色、黄色或棕褐色颗粒为阳性判断标准。
1.4 统计学分析 采用SPSS 26.0 统计学软件分析数据,计量资料以均数±标准差(±s)表示,采用单因素方差分析行多样本计量资料检验,采用LSD-t检验进一步两两比较;计数资料以率(%)表示,采用χ2检验;通过Med Calc 9.3.0 绘制受试者工作曲线(receiver operating curve,ROC),基于曲线下面积(area under curve,AUC)判断该模型诊断甲状腺腺瘤的价值,AUC >0.5 提示该模型有诊断价值。P<0.05 为差异有统计学意义。
2 结果
2.1 病理诊断结果156 例高度怀疑为TC 的甲状腺腺瘤患者经病理诊断,64 例确诊为TC,占41.03%,其中32 例为乳头状癌,14 例为滤泡状癌,9 例为髓样癌,6 例为未分化癌,3 例为混合癌。
2.2 三组彩色多普勒超声诊断结果比较 见表1。114 例为单发结节,42 例为多发结节;54 例为实质性结节,且内部回声减低;49 例病灶边缘模糊,形态不规则,内部存在砂砾样钙化灶;42 例结节存在明显毛刺状不规则边界;18 例颈部发现淋巴结转移。51 例综合确诊为TC,占32.69%。三组PSV,RI 及血流分级0~I 级,Ⅱ~Ⅲ级构成比比较,差异均有统计学意义(均P<0.05);TC 组PSV,RI及血流分级Ⅱ~Ⅲ级构成比均大于良性组(t=5.487,8.684,χ2=45.271)、健康组(t=11.095,12.384,χ2=89.290),良性组上述指标均大于健康组(t=5.869,6.790,χ2=19.173),差异均有统计学意义(均P<0.05)。

表1 三组彩色多普勒超声诊断结果比较
2.3 三组血清glactin-3,HMGB-1 和TSGF 水平比较 见表2。三组血清glactin-3,HMGB-1和TSGF 水平比较,差异均有统计学意义(均P<0.05);TC 组上述指标水平高于良性组(t=11.509,7.761,8.999)、健康组(t=22.346,26.979,15.220,P<0.001),良性组上述指标均高于健康组(t=15.979,25.145,7.042,P<0.001),差异均有统计学意义。
表2 三组血清glactin-3,HMGB-1 和TSGF 水平比较(±s)

表2 三组血清glactin-3,HMGB-1 和TSGF 水平比较(±s)
项 目TC 组(n=64)良性组(n=92)健康组(n=73)F 值P 值glactin-3(ng/ml)26.47±4.9119.05±3.1411.83±2.52287.767<0.001 HMGB-1(ng/ml)14.97±2.8611.92±2.055.37±0.97395.316<0.001 TSGF(U/ml)79.56±9.0366.97±8.4058.16±7.42114.259<0.001
2.4 彩色多普勒超声、血清glactin-3,HMGB-1,TSGF 单独及联合诊断TC 的效能 见表3,图1。ROC 结果显示,血清glactin-3,HMGB-1 和TSGF诊断甲状腺腺癌的最佳截断点分别为22.15 ng/ml,13.62 ng/ml,73.46 U/ml,彩色多普勒超声、血清glactin-3,HMGB-1 和TSGF 单独诊断的AUC 分别为7.843,6.953,7.210,7.433,联合诊断的AUC为8.126。

表3 四者单独、联合诊断TC 的效能(%)
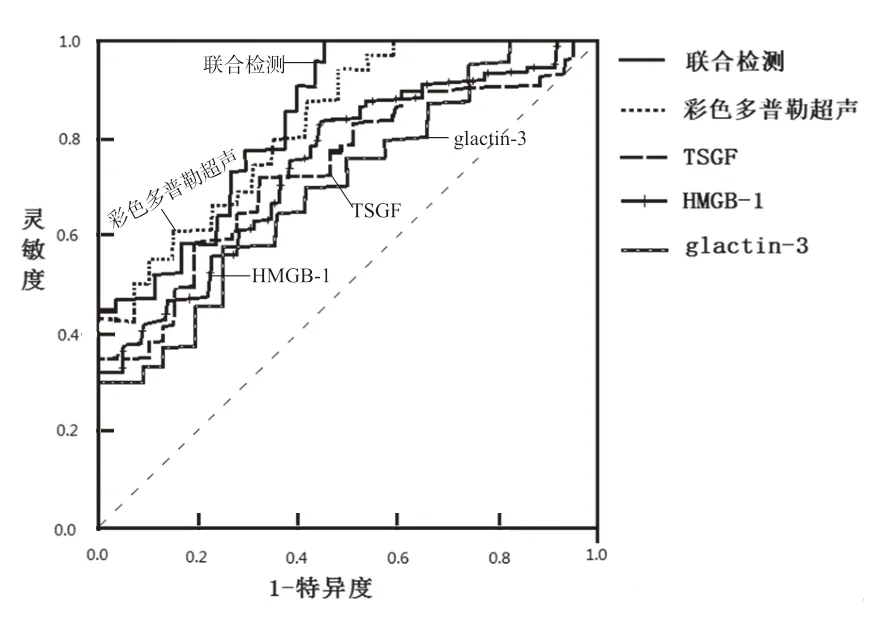
图1 彩色多普勒超声、血清glactin-3,HMGB-1,TSGF单独及联合诊断TC 的ROC 曲线
3 讨论
TC 为高发甲状腺恶性肿瘤,其发病率随年龄增长而持续上升[9],且女性患者多于男性。研究显示[10],内分泌紊乱、碘摄入量、良性疾病病变及遗传因素等均为TC 发生的危险因素。该病早期可通过触诊发现甲状腺中表面不平、质地坚硬的肿块,晚期则可出现呼吸及吞咽障碍、声音嘶哑等症状,且部分患者可发生远处转移或腺内扩散,严重威胁其生命安全。早期确诊对TC 患者尽早开展手术切除、延长其生存期限至关重要。目前临床触诊、CT检查、磁共振及穿刺活检等TC 诊断技术均有一定缺陷,如准确度不足、创伤大、不具有重复性等[11]。因此,探究有效、安全、操作简便的诊断方式是医学领域重点研究课题。
本研究显示,TC 组、良性组和健康组PSV,RI 及血流分级II~III 级构成比依次降低,提示TC患者PSV,RI 及血流分级II~III 级构成比异常升高。彩色多普勒超声可显示出甲状腺内部微小病灶,并可反映病灶边界及内部钙化、血流特征,进而辅助判断肿瘤性质。恶性肿瘤的持续生长对新生血管生成依赖性极强,故TC 病灶中血管丰富、血流速度快,树枝状、网状血管分布紊乱,而良性肿瘤通常由宿主为其提供血液,血流大部分为抱球样,且速度较慢、走向规律,因此PSV,RI 及血流分级可作为鉴别良恶性的参考依据。本研究还显示,TC组、良性组和健康组血清glactin-3,HMGB-1 和TSGF 水平依次降低,提示TC 患者血清glactin-3,HMGB-1 和TSGF 水平异常升高。glactin-3 在正常组织、肿瘤细胞中均有分布,经非经典途径分泌至细胞外,根据所处生理、病理条件发挥对应生物学功能,以调节细胞生长、分化为主要作用,广泛参与肿瘤细胞黏附、增殖及迁移过程。HMGB-1 属于非组蛋白染色质蛋白,通常存在于细胞核参与调控基因转录,并可维持染色质结构与功能的稳定[12]。其可与纤溶酶原系统结合,增强基质金属蛋白酶活性,促进肿瘤进展、转移。研究认为[13-14],宫颈癌、非小细胞肺癌血清HMGB-1 水平均显著高于正常群体,提示该因子可作为恶性肿瘤诊断的参考指标之一。TSGF 与多种肿瘤的增殖、侵袭等生物学活动有关[15-17],对肿瘤生长及周边血管增生有促进作用,且随肿瘤细胞的分化被持续释放入血液,导致血清水平异常升高。
本研究通过绘制ROC 曲线发现,彩色多普勒超声和血清glactin-3,HMGB-1 和TSGF 单独诊断TC 的AUC 分别为7.843,6.953,7.210,7.433,联合诊断的AUC 为8.126,表明四者联合诊断TC的价值高于单独诊断。甲状腺腺瘤可在一定条件下发生癌变,多个腺瘤患者的每个腺瘤生长状态均存在差异,因此甲状腺腺瘤并发TC 在临床较为常见[18-19]。彩色多普勒超声对单独甲状腺腺瘤或TC 诊断准确率较高,但两者并发时常发生误诊或漏诊问题。血清glactin-3,HMGB-1 和TSGF 检测操作简单,患者接受度高,但在2 型糖尿病并发脑梗死、宫颈癌、原发性肝癌等其他恶性肿瘤中同样异常表达[14,20-21],单独检测特异度不足,且不能反映出腺体自身形态学及血流动力学的变化,故需与彩色多普勒超声联用,相互弥补,促进TC诊断效能的提升。
综上所述,彩色多普勒超声联合血清glactin-3,HMGB-1 和TSGF 检测可作为TC 的有效诊断方式。本研究尚有不足,如受客观条件限制所选病例数较少、未对良性甲状腺腺瘤患者继续随访等,在今后研究中需针对性改进。

