急性胰腺炎患者血清C1q补体水平与疾病严重程度的相关性研究
陈 颖,王伟佳,胡 婷,黄福达,缪丽韶,唐 凤,罗楚君
(中山大学附属中山医院检验医学中心,广东中山 528403)
急性胰腺炎(acute pancreatitis,AP)是多种病因共同作用导致胰酶在胰腺内被激活,继而诱发胰腺水肿、出血甚至坏死的急性炎症性疾病,伴或不伴其他器官衰竭[1-2]。AP 按严重程度分为轻症AP(mild acute pancreatitis,MAP)、中度重症AP(moderately severe acute pancreatitis,MSAP)和重症AP(severe acute pancreatitis,SAP),其中SAP 预后差,因过度全身炎症反应和胰腺坏死可进一步引起持续性多器官功能衰竭,病死率可达15%∼30%[1,3]。因此,对AP 重症病例进行早期准确预测和有效评估仍然是研究热点。
免疫平衡失调和炎症过度反应是AP 的主要发病机制之一,AP 的病情发展和转归与机体的免疫状态密切相关[4]。既往已有研究报道AP 动物模型及SAP 患者血清中的C3 和C4 等多种补体水平明显降低,且在坏死性AP 降低更为明显[5-6]。补体1q(complement 1q,C1q)是补体系统经典途径重要的启动分子,可清除循环免疫复合物、衰老和凋亡细胞、参与局部炎症反应等[7-8];然而血清C1q水平与AP 患者严重程度的关系缺乏系统研究与分析。因此,本研究通过分析不同严重程度AP 患者血清C1q 水平变化对SAP 的诊断及预测价值,以期为临床AP 患者的病情监测及风险评估提供新的途径与方法。
1 材料与方法
1.1 研究对象 连续选取2019年11月~2020年10月于中山大学附属中山医院住院的AP 患者104例,男性69 例,女性35 例,年龄46.10±12.62岁,收集患者基线资料;所有患者均符合中华医学会胰腺疾病学组制定的《中国急性胰腺炎诊治指南(2019,沈阳)》的诊断标准[9]。所有患者均是首次发作,排除AP 以外的其他器质性疾病造成的病变及近3 个月使用激素或免疫抑制者。按照2012年新的亚特兰大分类标准,其中MAP 组47 例,无器官功能衰竭和局部或全身并发症;MSAP 组32例,存在局部的或全身并发症或一过性的器官功能衰竭(<48h);SAP 组25 例,存在持续性器官功能衰竭(>48h)。另选取同期健康体检者52 例作为对照组,其中男性33 例,女性19 例,年龄44.44±9.25。
1.2 仪器与试剂 采用酶联免疫吸附测定法测定C1q,试剂盒为上海江莱生物科技有限公司提供,仪器为MK3 酶联仪(Thermo Fisher 公司)。采用比色法测定三酰甘油(triglyceride, TG)、酶法测定血清肌酐(serum creatinine, SCr)和胶乳法测定超敏C 反应蛋白(hyper-sensitive C-reactive protein, hs-CRP)水平,测定仪器为德国Roche 公司CobasP8000 全自动生化分析仪;电化学发光法测定降钙素原(procalcitonin, PCT),测定仪器为德国Roche 公司E602 全自动化学发光分析仪。检测项目均有其配套试剂、校准品及质控品。
1.3 方法
1.3.1 标本采集与处理:采用真空干燥管采集静脉血3ml;疾病组发作入院即可采集,对照组禁食12h 以上空腹采集。标本采集后完成部分指标检测,剩余血清按编号分装于2 个EP 管(用于C1q 项目检测和复检),置于-80℃冰箱保存并于6 个月之内完成检测。
1.3.2 临床参数计算:急性生理学与慢性健康状况评分系统Ⅱ(acute physiology and chronic health evaluation Ⅱ, APACHE Ⅱ)=急性生理评分+年龄指标+慢性并发症,其中急性生理评分包括入院24 h 内的体温、心率、呼吸频率、平均动脉血压、全血白细胞值、红细胞比容值、动脉血pH 值、氧分压、血清钾钠、肌酐及昏迷指数共12 项,评分≥8 为重症。评分分值越高,病情越重,预后越差。
1.4 统计学分析 应用SPSS 23.0 和medcalc19.5分析软件。计量资料采用单样本K-S 正态分布检测数据的正态性。正态分布数据以均数±标准差(±s)表示,多组间比较采用ANOVA 方差分析,两组间的比较采用独立样本t检验;偏态分布数据以中位数(四分位数间距)表示,多组间比较采用Kruskal-Wallis 分析,两组间的比较采用Mann-WhitneyU检验。计数资料采用百分率(%)表示,多组间比较采用χ2或Fisher 精确概率法检验。使用多元线性回归分析各因素对C1q 水平的影响。联合诊断采用二元Logistic 回归分析;ROC 曲线评价C1q 对疾病诊断及预测严重程度,并采用Z 检验比较不同指标曲线下面积(area under the cure,AUC)。P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象基线资料及生化参数比较 见表1。AP 组和健康对照组间年龄、性别差异无统计学意义(P>0.05);与健康对照组相比,AP 组血清TG,SCr,PCT 和hs-CRP 水平显著升高,差异均有统计学意义(P<0.05)。AP 各组性别、年龄、高血压史及糖尿病史差异均无统计学意义(P>0.05),病因以胆源性AP 最多,其次是高脂血症和其他,分别占AP 患者的66.34%,26.92%和6.74%。SAP 组血清TG,PCT 和hs-CRP 水平明显高于MAP 组和MSAP 组,差异均有统计学意义(均P<0.05),而MAP 组和MSAP 组比较,差异无统计学意义(P>0.05);随着AP 严重程度的增加,SCr 水平和APACHE Ⅱ评分逐渐增加,三组两两比较差异均有统计学意义(均P<0.05)。

表1 对照组与AP 各组的基线资料比较[中位数(四分位数间距)]
2.2 AP 各组血清C1q 水平比较 见表1。与对照组(233.28±14.08µg/ml)相比,AP 组(208.24±23.09µg/ml)C1q 水平显著降低,差异有统计学意义(t=-8.317,P<0.05)。单因素方差分析显示,AP 各组血清C1q 水平不完全相同(F=19.343,P<0.05)。进一步两两比较发现,与MAP 组(217.43±16.81µg/ml)和MSAP 组(211.10±18.90µg/ml)相比,SAP组(186.48±24.63µg/ml)血清C1q 水平显著降低,差异均有统计学意义(t=5.624,4.132,均P<0.05);MAP 组和MSAP 组血清C1q 水平相比,差异无统计学意义(t=1.528,P=0.132)。
2.3 各因素对AP 患者血清C1q 水平的影响 见表2。以C1q 水平为因变量,针对AP 患者构建多元线性回归模型,结果显示校正了年龄、性别、病因、病史及其他生化指标的影响后,血清C1q 水平与APACHE Ⅱ评分(β=-0.587,P<0.05),hs-CRP(β=-0.279,P<0.05)呈负相关,其余指标无明显的相关性;APACHE Ⅱ评分和hs-CRP 仍然是血清C1q 水平的独立影响因素。

表2 多元逐步线性回归分析AP 患者血清C1q 水平的影响因素
2.4 C1q 诊断及预测AP 患者严重程度的临床价值 ROC 曲线结果显示:血清C1q 诊断AP 患者的AUC 为0.854(95%CI:0.788 ∼0.905,P<0.05),利用约登指数求得最高敏感度为78.85%,特异度为88.46%,对应C1q 截断值为224.40µg/ml。血清C1q诊断SAP的AUC为0.822(95%CI:0.735∼0.890,P<0.05),利用约登指数求得最高敏感度为80.00%,特异度为82.28%,对应C1q 截断值为203.56µg/ml。APACHE Ⅱ评分诊断SAP 的AUC 为0.944(95%CI:0.880∼0.979,P<0.05),诊断效能优于C1q,二者比较差异有统计学意义(Z=2.975,P=0.003),见图1。hs-CRP 诊断SAP 的AUC 为0.833(95%CI:0.747 ∼0.899,P<0.05),与APACHE Ⅱ评分相比,二者差异有统计学意义(Z=1.966,P=0.033)。用二元Logistic 回归求出C1q 和hs-CRP 联合诊断SAP 的预测概率值,将预测概率值做ROC 曲线分析,AUC 为0.926(95%CI:0.857 ∼0.968,P<0.05),敏感度、特异度分别为84.00% 和88.61%,与APACHE Ⅱ评分相比,二者差异无统计学意义(Z=0.582,P=0.560),见图2。

图1 C1q 和APACHE Ⅱ评分诊断SAP 的ROC 曲线
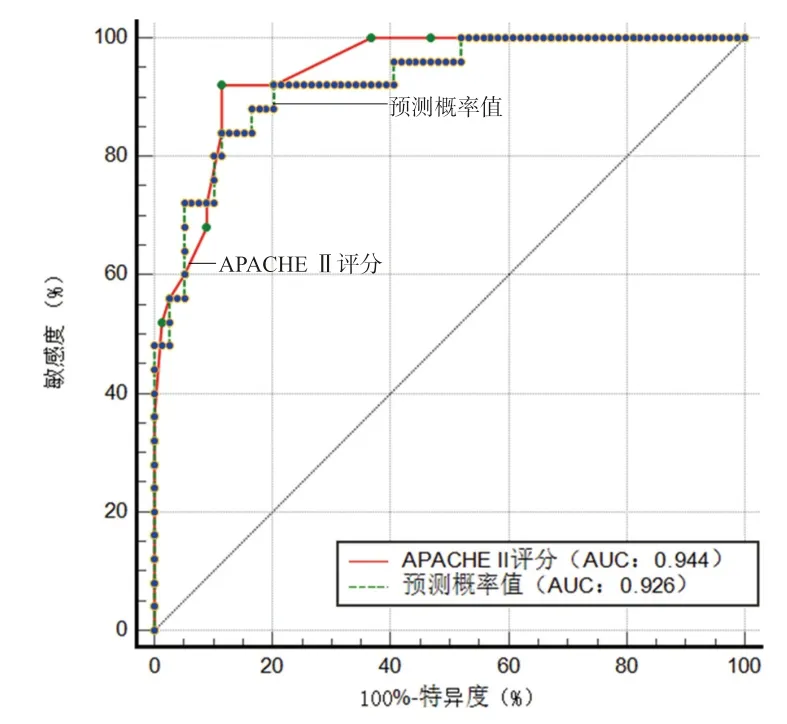
图2 C1q 与hs-CRP 两者联合预测概率值和APACHE Ⅱ评分诊断SAP 的ROC 曲线
3 讨论
AP 是常见的消化系统急腹症之一,而一旦并发器官功能衰竭,与之相关的病死率可达30%~50%[10-11]。早发现、早诊断和早治疗仍然是改善SAP 患者预后的关键。目前用于预测AP 患者严重程度的临床评分系统主要包括APACHE Ⅱ标准、Ranson 标准及Imrie 标准等,其中APACHE Ⅱ评分标准优于其他系统[12-13]。这些评分系统的敏感度和特异度相对较高,但各类量表和评分系统操作复杂耗时以及不可控制的主观干扰性,其临床应用仍受限。单因素生物学指标中,目前应用最多的有C反应蛋白、PCT,TG 和SCr 等,单因子预测指标具有应用简单的优点,但其效力常常受到疾病类型的影响[14-15]。大多数情况下,临床主要依靠患者临床指标、实验室检查和影像学检查的综合分析来判断SAP 的发生;探索可预测SAP 病情的有效指标,仍是该类疾病研究领域亟待解决的重要问题[16-17]。
本研究结果显示,AP 组血清C1q 水平显著低于对照组,与MAP 组和MSAP 组相比,SAP 组血清C1q 水平显著降低。推测AP 发病后,由于大量的炎症介质释放使淋巴细胞和中性粒细胞活化并黏附于内皮细胞致C1q 等补体系统被激活。被过度激活的补体不但参与启动机体防御病原体的第一道防线,同时介导单核巨噬系统清除凋亡细胞和循环免疫复合物等,从而大量被消耗掉。本研究还发现,随着病情的加重,SCr 水平明显升高,SAP 升高最为明显,提示AP 患者C1q 水平明显降低,可能与AP 引起的急性肾损伤密切相关,具体机制有待进一步研究。C1q 在AP 的发病及病情发展中可能起一定的作用,补体参与早期疾病可能是AP 致病机制的一个原因。
多项前瞻性研究表明,单因素生物学指标中C 反应蛋白预测SAP 具有较高的敏感度和特异度[13-15]。本研究结果发现,校正其他影响因素后,AP 患者血清C1q 水平与APACHE Ⅱ评分和hs-CRP 呈现良好的负相关性,说明血清C1q 水平是反映AP 患者严重程度的新指标,这与先前报道补体C3 和C4水平可以预测AP 患者的严重程度结果一致[6,18]。进一步应用ROC 曲线分析,ROC 显示血清C1q 诊断AP 患者和SAP 患者时AUC 均大于0.80,说明血清C1q 水平诊断及预测AP 患者和SAP 患者有一定的临床参考价值。我们进一步将血清C1q 和APACHE Ⅱ评分诊断SAP 相比,APACHE Ⅱ评分诊断效能优于C1q。目前为止,评分系统预测SAP具有较高的敏感度和特异度,独立的单因素生物学指标是无法相比的。此外,我们将C1q 和hs-CRP联合诊断SAP 患者,与APACHE Ⅱ评分相比,二者诊断效能相仿。APACHE Ⅱ评分能有效评估AP患者的病情严重程度及预后,但其评分计算繁杂,使用并不方便;从检测成本、检测速度和诊断敏感度、特异度等方面综合考虑,C1q 和hs-CRP 联合检测可能是SAP 诊断及预测的较好实验室检测指标。
综上所述,AP 患者血清C1q 水平明显降低,可作为辅助诊断AP 的潜在指标;血清C1q 水平与hs-CRP 联合检测对SAP 具有较高的诊断及预测价值。但本研究也存在一定的不足之处,如单中心临床研究、疾病组例数较少、可能存在选择性偏倚样本量较少、未动态观察C1q 水平变化以及未能跟踪随访患者的临床结局等,还需通过大规模的队列研究,明确血清C1q 作为AP 患者病情监测评估指标的临床应用潜能,为该类疾病的评估体系提供新的参考依据。

