基于网络药理学的补阳还五汤治疗阿尔兹海默症的作用机制研究
薛慧 安丽凤 曲岩 陈巧云 杨柳 崔劭瑜 沃佳美雪 张丽宏 刘斌


摘要 目的:運用网络药理学的研究方法,初步探讨补阳还五汤治疗阿尔兹海默症(AD)的作用机制。方法:借助中药系统药理学数据库与分析平台(TCMSP)、OMIM、DrugBank、TTD数据库检索和收集AD的相关靶点;利用TCMSP和TCM@TAIWAN数据库检索和筛选补阳还五汤组方药物的活性成分,并通过PharmMapper服务器预测化合物潜在作用靶点;通过与收集的AD靶点比对获得活性成分作用的AD靶点,并利用STRING数据库和Cytoscape软件构建和分析AD靶点的PPI网络图和“组方药物-活性成分-AD靶点”网络图;分别通过DAVID系统、KOBAS 3.0数据库对AD靶点进行基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)通路富集分析。结果:从补阳还五汤中筛选出92个活性成分,其中来自赤芍的芍药内酯苷、4-乙基芍药苷、4-氧-甲基-芍药苷可能是重要的多效活性成分;活性成分经靶点预测和比对后确定33个抗AD靶点,其中CASP3、MAPK14、BCHE、BACE1可能是抗AD的关键靶点。活性成分通过作用上述AD靶点调控MAPK、PI3K/AKT、Rap1、Ras等信号通路,影响蛋白水解、蛋白磷酸化、雌激素应答等生物过程,抑制Aβ的生成,降低神经元炎症反应和神经细胞凋亡,减弱胆碱酯酶活性,进而达到治疗AD的目的。结论:通过网络药理学方法研究补阳还五汤治疗AD的活性成分和作用机制,揭示了补阳还五汤在治疗AD方面具有多成分、多靶点、多途径的优点,为补阳还五汤的后期实验提供新思路。
关键词 补阳还五汤;阿尔兹海默症;网络药理学;活性成分;靶点;通路
Abstract Objective:To explore the mechanism of Buyang Huanwu Decoction in the treatment of Alzheimer′s Disease(AD) with the method of network pharmacology.Methods:We retrieved and collected AD targets with the help of TCMSP,OMIM,DrugBank and TTD databases.Searched and screened the active compounds in Buyang Huanwu Decoction through the TCMSP and TCM@TAIWAN databases,and predicted potential targets of compounds through the PharmMapper server.Obtained the AD targets that interact with Buyang Huanwu Decoction by comparing with the collected AD targets.Constructing and analyzing the protein-protein interaction network of targets of Buyang Huanwu Decoction against AD and the network of “herbs-active compounds-AD targets” with STRING database and Cytoscape software separately.GO functional annotation and KEGG pathway enrichment analysis were performed on AD targets through DAVID system and KOBAS 3.0 database.Results:A total of 92 active compounds were screened from Buyang Huanwu Decoction,among which paeoniflorin,4-ethylpaeoniflorin and 4-O-methyl-paeoniflorin from the Radix Paeoniae Rubra may be the important multiple activity ingredients.After targets prediction and comparison,33 AD targets were determined,among which CASP3,MAPK14,BCHE and BACE1 may be the key targets of Buyang Huanwu Decoction against AD.The AD targets were affected by active components to regulate proteolysis,protein phosphorylation,estrogen response and other biological processes,to inhibit the production of Aβ,decrease neuronal inflammation and apoptosis of nerve cells,and reduce the activity of cholinesterase by participating in MAPK,PI3K/AKT,Rap1,Ras and other signaling pathways,to achieve the purpose of treating AD.Conclusion:Research on the active ingredients and mechanism of Buyang Huanwu Decoction in the treatment of AD through network pharmacology methods,revealing that Buyang Huanwu Decoction has the advantages of multiple components,multiple targets and multiple pathways in the treatment of AD,which provides a new idea for the later experiment of Buyang Huanwu Decoction.
Keywords Buyang Huanwu Decoction; Alzheimer′s disease; Network pharmacology; Active components; Targets; Pathway
中图分类号:R285文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.11.009
阿尔兹海默病(Alzheimer Disease,AD)是一种记忆能力逐渐衰退的中枢神经系统退行性疾病,发病过程复杂,受多因素共同作用、相互影响、综合调控,具体病机尚未明确[1]。目前AD的临床治疗多以Tacrine、Memantine及Donepezil等西药为主,由于作用靶点单一,易产生耐药性和不良反应,治疗效果并不理想。
补阳还五汤出自清代名医王清任的《医林改错》,由生黄芪、当归尾、赤芍、川芎、地龙、桃仁、红花组成,兼具补气、活血、通络之功效,现代临床医学主要用于脑血管类疾病[2]。目前,越来越多的基础研究和临床研究发现补阳还五汤可有效提高学习记忆能力,改善认知行为功能[3-8]。但补阳还五汤药效物质组成复杂,其抗AD的潜在作用靶点及途径仍需深入挖掘,并进一步证明其药理作用机制。
网络药理学是基于系统生物学理论建立起来的药物研发新模式。通过借助各類生物信息数据库,建立“疾病-基因-靶点-药物”相互作用网络,采用专业软件和算法分析,从整体角度探究药物与疾病的关系。其整体性、系统性的特点为揭示中药复杂药效成分协同作用机制提供了新策略[9]。因此本研究以补阳还五汤中具有抗AD作用的活性成分为研究对象,应用网络药理学的优势建立研究方法,通过构建“组方药物-活性成分-靶点-通路”之间的关系,探究该方多成分、多靶点、多途径治疗AD的作用机制,为补阳还五汤的后续研究提供新思路。
1 材料与方法
1.1 材料
本研究所使用的数据库及平台信息如下:中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,http://lsp.nwu.edu.cn/tcmsp.php),在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM,https://www.omim.org),DrugBank数据库(http://www.drugbank.ca/),治疗靶标数据库(Therapeutic Target Database,TTD,https://db.idrblab.org/ttd/),中医药资料库@Taiwan(Traditional Chinese Medicine Database@Taiwan,TCM@TAIWAN,http://tcm.cmu.edu.tw/zh-tw/review.php),UniProt数据库(http://www.uniprot.org),SwissADME平台(http://www.swissadme.ch/index.php#top),PharmMapper服务器(http://lilab.ecust.edu.cn/pharmmapper/index.php),STRING在线数据库(http://string-db.org/),DAVID生物分子功能注释系统(The Database for Annotation,Visualization and Integrated Discovery,DAVID,https://david.ncifcrf.gov/summary.jsp),KOBAS 3.0数据库(http://kobas.cbi.pku.edu.cn/index.php)。
1.2 AD相关靶点的收集
分别登陆TCMSP、OMIM、DrugBank、TTD数据库,以“Alzheimer Disease”为关键词筛选和收集AD相关靶点。利用UniProt数据库的UniProtKB功能将收集到的靶点校正为官方名称(Official GeneSymbol)。
1.3 补阳还五汤活性成分筛选
利用TCMSP数据库分别对补阳还五汤中的黄芪、当归、赤芍、川芎、桃仁、红花6味药材进行化学成分检索,并以口服生物利用度(OB)≥30%,类药性(DL)≥0.18作为活性成分的筛选条件。另外借助TCM@TAIWAN数据库检索地龙化学成分,并利用SwissADME进行药物动力学分析。对于符合筛选条件的化合物通过上述数据库下载其*.mol格式分子结构式。
1.4 补阳还五汤活性成分抗AD作用靶点的预测
登陆PharmMapper服务器,上传活性成分*.mol文件,设置返回靶点数为100,提交进行反向靶点预测。将预测靶点与1.2筛选出的AD靶点进行比对取交集,进而得到补阳还五汤活性成分抗AD作用靶点。
1.5 构建补阳还五汤抗AD作用靶点的蛋白质-蛋白质相互作用(PPI)网络图
通过STRING在线数据库对1.4补阳还五汤抗AD作用靶点进行PPI网络的构建和分析。
1.6 构建补阳还五汤“组方药物-活性成分-AD靶点”网络图
应用网络可视化软件Cytoscape 3.7.1中的Merge功能,将1.3补阳还五汤“组方药物-活性成分”和1.4“活性成分-AD靶点”预测结果合并,构建“组方药物-活性成分-AD靶点”网络图,并通过软件的network analysis功能计算网络参数,分析相互关系。
1.7 靶点功能及通路注释分析
分别登陆DAVID平台和KOBAS 3.0数据库,对1.4获取的AD靶点进行基因本体(Gene Ontology,GO)富集分析(选择BP、CC、MF)及京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。
2 结果
2.1 AD相关靶点筛选结果
通过检索OMIM、TCMSP、TTD和DrugBank 4个数据库,分别获得134、30、30和6個AD靶点。将所有靶点进行汇总,最终整理出140个非重复AD靶点。
2.2 补阳还五汤活性成分和抗AD作用靶点筛选结果
通过TCMSP检索的6味组方药物中符合筛选条件的化合物数量分别为:黄芪20个、当归2个、赤芍29个、川芎7个、桃仁23个、红花22个。利用TCM@TAIWAN检索出的地龙化学成分Xanthinin其ADME预测结果为:Lipinski′s Rule:Suitable,Lead like Rule:Suitable,CMC-like rule:Qualified,MDDR-like Rule:Midstructure,WDI-like Rule:In 90% Cutoff,Human Intestinal Absorption(HIA,%):96.91,可作为候选化合物。将所有活性成分汇总去重后最终得到92个,其中90个活性成分通过PharmMapper数据库成功预测出潜在作用靶点,靶点涉及373个种类,与收集的AD靶点比对后确定其中33种为AD靶点。补阳还五汤活性成分个数及抗AD作用靶点。见表1。
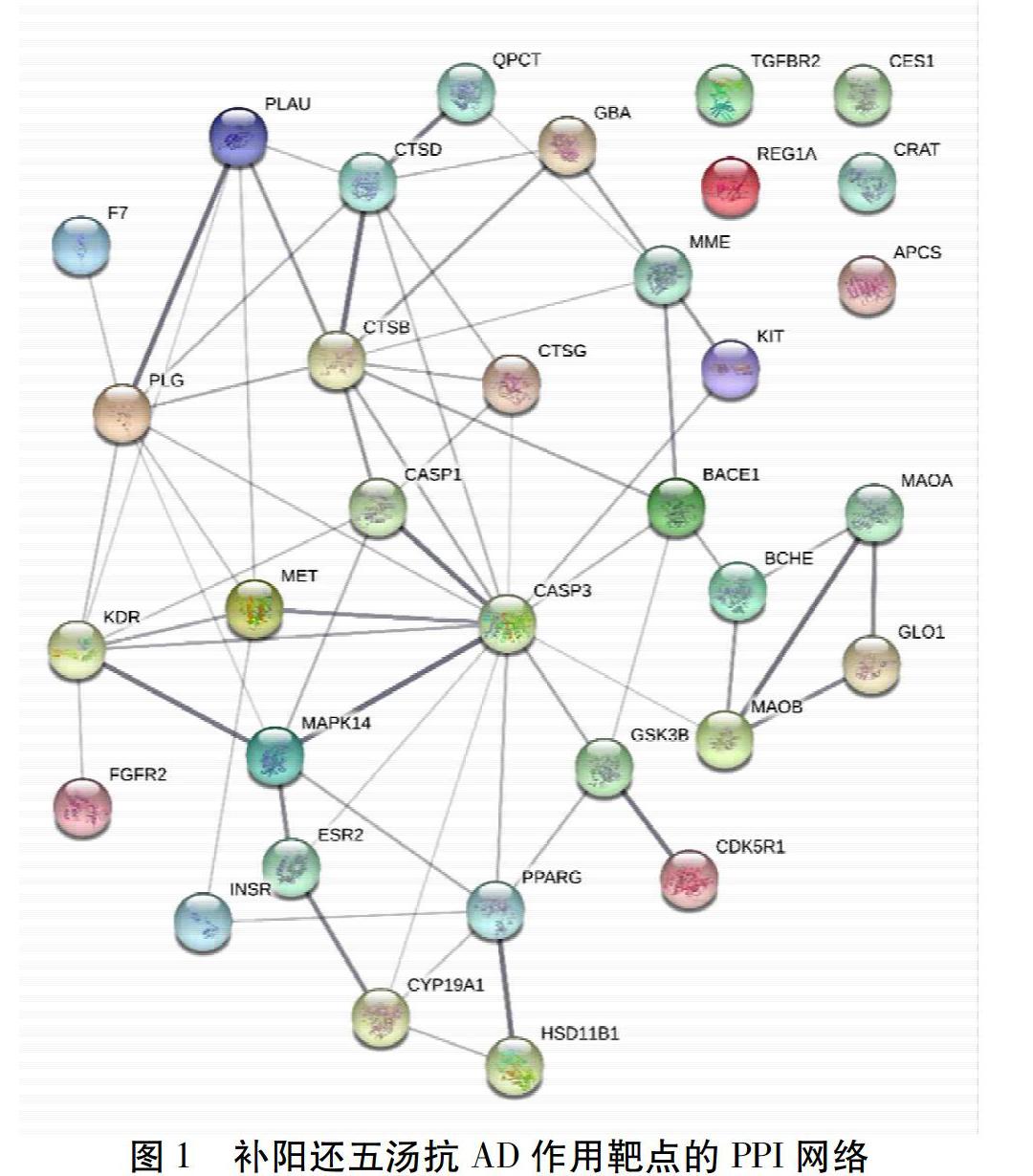
2.3 补阳还五汤抗AD作用靶点的PPI网络图解析
通过STRING在线数据库构建的补阳还五汤抗AD作用靶点的PPI网络图。见图1。33个靶点中有28个相互连接,形成62种相互作用关系。其中与细胞凋亡密切相关的CASP3靶点最为活跃,可能是补阳还五汤防治AD的潜在核心靶点。
2.4 补阳还五汤“组方药物-活性成分-AD靶点”网络图解析
可视化构建的补阳还五汤“组方药物-活性成分-AD靶点”网络图包含130个节点(Node),即7个组方药物,90个活性成分和33个AD靶点。见图2。组方药物与活性成分间有102条边(Edge),药物的平均节点分支数(Average Number of Neighbors)为14。活性成分与AD靶点间有1 087条边,二者的平均节点分支数分别为12和32。化合物中来自赤芍的芍药内酯苷(MOL007004)、4-乙基芍药苷(MOL007008)、4-氧-甲基-芍药苷(MOL007012)度值(degree)最高为16,它们可能是补阳还五汤重要的多效活性成分。AD靶点中MAPK14、BCHE、
BACE1度值位列前三,分别为87、79、77,它们可能是补阳还五汤抗AD的关键靶点。该结果表明补阳还五汤化学成分复杂,同一化合物可作用多个AD靶点,而同一个AD靶点又会受到多个化合物影响。
2.5 靶点GO富集分析及KEGG通路富集分析结果
通过DAVID系统对补阳还五汤作用的33个AD靶点进行GO功能注释,共得到102个反馈条目。根据P值(P<0.01)确定41个GO功能注释结果。其中生物学过程有24个,涵盖蛋白水解、蛋白磷酸化、雌激素应答、缺氧应答等方面;分子功能结果有9个,主要包括各类酪氨酸激酶活性、内肽酶活性、酶结合等活性;细胞组成结果有8个,包括胞外、膜筏、细胞外泌体、细胞表面等。见图3。
经KEGG富集分析后共得到137条信号途径,取P值最小的前20个条目(P<0.01)进行绘图分析。见图4。其中包含1条AD通路;5条细胞信号通路(MAPK信号通路、PI3K/AKT信号通路、Rap1信号通路、Ras信号通路、催乳素信号通路);5条生物系统相关功能通路(EGFR酪氨酸激酶抑制剂抗性、溶酶体、多巴胺能神经突触、黏着连接、补体和凝血级联);5条癌症通路(癌症通路、癌症蛋白聚糖、癌症转录调控失调、癌症中心碳代谢、胃癌)、4条其他疾病通路(可卡因成瘾、肌萎缩型脊髓侧索硬化症、幽门螺杆菌感染中的上皮细胞信号转导、百日咳)。
3 讨论
AD是以进行性记忆力衰退、认知行为障碍及其他精神症状为临床表现的神经退行性疾病,病理特点为脑皮质萎缩、神经元丢失、老年斑、神经元纤维缠结[1]。现代医学对AD的病机尚无统一认识,涉及胆碱能缺失、Aβ沉积、Tau蛋白过度磷酸化、氧化应激和自由基损伤等诸多学说[1]。长期以来临床治疗AD多以干预单一靶点的西药为主,但收效欠佳。因此探寻AD发病机制、研发抗AD安全有效药物成为全球医药领域面临的重要挑战。中医学认为AD属于“呆病、健忘、虚劳、善忘”等范畴,利用中药复方多成分、多靶点、多通路综合调控的优势,辨证与辨病相结合,在防治AD方面有潜在应用价值。
补阳还五汤为气虚血瘀病症的代表方,由生黄芪、当归尾、赤芍、川芎、地龙、桃仁、红花七味药组成。黄芪补气,当归尾活血,其他药物辅以化瘀、通络的作用[2]。黄芪作为君药已在现代药理学研究中证实了其在治疗AD方面的潜在价值[10-12]。本研究通过网络药理学的方法筛选出的黄芪活性成分也被证实具有抗AD的作用。如槲皮素(MOL000098)、刺芒柄花素(MOL000392)和毛蕊异黄酮(MOL000417)可以抑制Aβ产生,增加细胞内谷胱甘肽浓度,降低活性氧(ROS)水平,抑制炎症反应和氧化应激诱导的神经细胞凋亡,保护神经细胞,增加细胞活力,进而改善认知功能,提供学习记忆力[13-15]。当归作为臣药,虽然本次只筛选出β-谷固醇(MOL000358)、豆甾醇(MOL000449)2个生物碱类化合物,但二者均可通过作用于膜筏来调控AD过程。β-谷固醇可保持膜胆固醇稳态,阻止高胆固醇诱导的Aβ释放;增强对氧化应激和脂质过氧化的抵抗力[16]。豆甾醇可降低β-分泌酶的活性,并防止其内化到胞吞区室参与β-淀粉样蛋白前体蛋白(APP)分解;减少与APP裂解相关的脂筏中胆固醇和早老素的分布[17]。上述2种活性成分同样存在于赤芍中。赤芍也是补阳还五汤中活性成分最多的组方药物,其中芍药内酯苷、乙基芍药苷、4-氧-甲基-芍药苷具有多效活性。如芍药内酯苷可降低Aβ引起的毒性作用和ROS水平,维持细胞内Ca2+水平[18];当与芍药苷配伍后可以防止神经元损伤和小胶质细胞异常激活,提高AD小鼠学习记忆功能[19]。此外,川芎、地龙、桃仁、红花也可通过抗炎、抗凝血、抗氧化、调节细胞内外钙离子等功能发挥抗AD的作用[20-23]。因此,七味中药相互配伍构成的补阳还五汤复杂药物体系,为该方多靶点、多途径治疗AD提供了物质基础。
本研究运用网络药理学方法从分子层面对补阳还五汤的92个活性成分进行靶点预测和分析,确定33个AD治疗靶点,筛选出CASP3、MAPK14、BCHE、BACE1可能是补阳还五汤防治AD的潜在核心靶点。CASP3即Caspase-3来自半胱氨酸天冬氨酸特异性蛋白酶(Cysteine-Containing Aspartate-Specific Proteases,Casepse)家族,激活其活性,可触发下游的凋亡级联反应,使细胞发生不可逆转地凋亡[24]。在AD病程中,Caspases-3通过直接切割APP生成Aβ;特异性调节Tau磷酸化;选择性切割早老素蛋白,促进APP裂解产生更多Aβ,导致神经元细胞的凋亡[25]。MAPK14属于丝裂原激活的蛋白激酶(Mitogen-Activated Protein Kinases,MAPKs)家族,通过介导细胞内信号转导调控多种细胞活动,如细胞增殖、分化、凋亡和转化。MAPK信号通路在受到细胞内外信号分子刺激时被激活,通过调节神经元凋亡、β-和γ-分泌酶活性以及APP和Tau蛋白的磷酸化来促进AD的发病[26]。BCHE即丁酰胆碱酯酶(Butyrylcholinesterase)通过水解乙酰胆碱参与胆碱能神经传递。在AD病理过程中,基底前脑区的胆碱能神经元缺失,乙酰胆碱转移酶和胆碱酯酶活力减弱,乙酰胆碱(ACh)的生成、释放和摄取降低,致使学习能力和记忆功能减退[1]。BACE1即β分泌酶(Beta-secretase 1),其作用是切割APP形成Aβ的N端,以启动Aβ生成,而抑制其活性可从根本上减少Aβ的产生[27]。因此,补阳还五汤通过调控CASP3、MAPK14、BCHE、BACE1等AD靶点,减少Aβ的生成,降低神经元炎症反应,抑制神经细胞凋亡,下调胆碱酯酶活性来治疗AD,该结果与目前补阳还五汤治疗AD的相关研究结果一致[2]。
补阳还五汤作用的AD靶点经GO富集分析后,明确这些靶点主要分布在胞外、膜筏、细胞表面等部位,具有酪氨酸激酶、内肽酶活性,与蛋白水解、蛋白磷酸化、雌激素应答和缺氧应答等生物过程密切相关。分布于大脑皮质、海马、杏仁核和下丘脑中的雌激素受体,与突触可塑性、学习记忆、认知和神经保护密切相关[28-29]。来自中药的活性成分如毛蕊异黄酮、刺芒柄花素作为雌激素的替代物通过作用于雌激素受体发挥抗AD的作用[13-15]。AD病变过程中ROS表达逐渐升高,导致蛋白质被氧化修饰、多肽链折叠异常、DNA突变、糖类被氧化修饰等,促使Aβ和Tau蛋白积聚、神经元细胞凋亡、神经组织受损[1]。而具有抗氧化活性的物质如槲皮素、芍药苷内酯可通过降低ROS水平,防止神经元受损[13,18]。
在KEGG生物途径富集分析中,MAPK、Rap1、PI3K/AKT、Ras、催乳素信号通路被显著富集,其中MAPK信号通路显著度最高。而ERK、JNK/SAPK及p38MAPK是哺乳类细胞中并行的3条MAPKs信号通路[30]。补阳还五汤可通过调控p38MAPK/NF-κB通路抑制AD小鼠脑组织炎症反应,减少神经细胞凋亡[4];还可调节内皮细胞p38MAPK、ERK1/2通路,减少细胞骨架的变化,阻止细胞通透性变大,防止内皮细胞损伤[31]。此外诸多用于治疗AD的中药方剂如地黄饮子、补益脾胃元气方药也被证实与MAPK信号通路有关[32-33]。PI3K/AKT信号通路也可通过经调节下游靶点,来有效抑制神经元细胞的凋亡,发挥脑保护作用。有研究表明,远志散和益智治呆方通过调控PI3K/AKT/GSK-3β信号途径,抑制Aβ引起的Tau蛋白磷酸化表达,弱化Aβ神经毒性,阻止神经元细胞凋亡,改善AD大鼠学习记忆能力[34-35]。补阳还五汤中的活性物质如阿魏酸、藁本内酯和芍药苷还可通过PI3K/AKT信号通路下调炎症介质的表达,保护神经细胞以治疗AD[36-38]。
我们利用网络药理学的方法研究补阳还五汤治疗AD的多成分、多靶点、多途径的作用机制。发现补阳还五汤活性成分复杂,通过作用相應靶点来调控蛋白水解、蛋白磷酸化、雌激素应答、缺氧应答等生物过程,抑制Aβ的生成,降低神经元炎症反应和神经细胞凋亡,减弱胆碱酯酶活性,进而达到治疗AD患者的目的。其作用机制可能与MAPK、PI3K/AKT、Rap1、Ras信号通路有关。由于网络药理学本身的局限性,不能对补阳还五汤所有成分、作用靶点及通路进行更全面的分析,今后需要结合体内体外实验进行更深入的挖掘以及验证。
参考文献
[1]余茂强,吴绍长,杨华.阿尔茨海默病的病机相关性研究概况[J].中国现代医生,2020,58(17):183-187.
[2]费洪新,姜波,张英博,等.补阳还五汤对脑组织作用机制的研究进展[J].中医药信息,2015,32(1):125-127.
[3]黄洋,孙英新,曾妙,等.补阳还五汤及其组分治疗阿尔茨海默病的研究进展[J].中国实验方剂学杂志,2019,25(19):212-218.
[4]董晓红,王悦阳,贾佩华,等.基于炎症反应探讨补阳还五汤对AD模型小鼠的神经保护作用及机制[J].现代中药研究与实践,2020,34(4):15-18.
[5]于修芳,雷霞,曹玲,等.补阳还五汤对阿尔茨海默病小鼠海马凋亡因子及学习记忆能力的影响[J].中国实验方剂学杂志,2018,24(3):109-113.
[6]费洪新,周忠光,刘斌.补阳还五汤对阿尔茨海默病小鼠NF-κBp65蛋白的影响[J].中国老年学杂志,2015,35(19):5369-5371.
[7]张春梅.补阳还五汤治疗阿尔茨海默病的疗效及对MMSE积分、ADL评分的影响研究[J].中国现代医生,2016,54(31):126-128.
[8]张丽,黄伟钢,祁风.补阳还五汤联合手指健智操治疗阿尔茨海默病疗效观察[J].新中医,2017,49(8):148-151.
[9]刘志华,孙晓波.网络药理学:中医药现代化的新机遇[J].药学学报,2012,47(6):696-703.
[10]高立威,单铁英,董洋,等.黄芪提取物对老年痴呆大鼠NF-kB信号通路相关蛋白表达的影响[J].职业与健康,2017,33(1):44-47.
[11]赵启跃,姚遥,郑萍,等.黄芪甲苷对阿尔茨海默症小鼠脑内氧化应激和NADPH氧化酶蛋白表达的影响[J].宁夏医科大学学报,2018,40(11):1241-1244,1249.
[12]苏国华,刘立海,陈慧丽,等.黄芪多糖对AD大鼠模型氧化应激反应与Wnt信号通路的影响[J].中国煤炭工业医学杂志,2020,23(1):21-26.
[13]全传升,张淑芬.槲皮素对神经细胞的保护作用研究[J].中国基层医药,2016,23(19):2992-2995.
[14]Fei HX,Zhang YB,Liu T,et al.Neuroprotective effect of formononetin in ameliorating learning and memory impairment in mouse model of Alzheimer′s disease[J].Biosci Biotechnol Biochem,2018,82(1):57-64.
[15]Song L,Li X P,Bai X X,et al.Calycosin improves cognitive function in a transgenic mouse model of Alzheimer′s disease by activating the protein kinase C pathway[J].Neural Regen Res,2017,12(11):1870-1876.
[16]Shi C,Wu F,Zhu XC,et al.Incorporation of beta-sitosterol into the membrane increases resistance to oxidative stress and lipid peroxidation via estrogen receptor-mediated PI3K/GSK3beta signaling[J].Biochim Biophys Acta,2013,1830(3):2538-2544.
[17]Burg V K,Grimm H S,Rothhaar T L,et al.Plant sterols the better cholesterol in Alzheimer′s disease?A mechanistical study[J].J Neurosci,2013,33(41):16072-16087.
[18]Ho SL,Poon CY,Lin C,et al.Inhibition of β-amyloid Aggregation By Albiflorin,Aloeemodin And Neohesperidin And Their Neuroprotective Effect On Primary Hippocampal Cells Against β-amyloid Induced Toxicity[J].Curr Alzheimer Res,2015,12(5):424-433.
[19]閆蓉.JD-30主要成分芍药苷和芍药内酯苷的神经保护作用及机制研究[D].广州:广州中医药大学,2014.
[20]李芊,吴效科.川芎化学成分及药理作用研究新进展[J].化学工程师,2020,34(1):62-64,44.
[21]黄敬文,高宏伟,段剑飞.地龙的化学成分和药理作用研究进展[J].中医药导报,2018,24(12):104-107.
[22]赵永见,牛凯,唐德志,等.桃仁药理作用研究近况[J].辽宁中医杂志,2015,42(4):888-890.
[23]田志伟.红花药理分析及临床应用研究[J].临床医药文献(连续型电子期刊),2017,4(80):15833.
[24]陈雪,孙婧霞,蒋常文.Bcl-2、Caspase-3与阿尔茨海默病关系的研究进展[J].临床医学工程,2013,20(9):1177-1179.
[25]Chu J,Lauretti E,Praticò D.Caspase-3-dependent cleavage of AKT modulates tau phosphorylation via GSK3β kinase:implications for Alzheimer′s disease.[J].Mol Psychiatr,2017,22(7):1002-1008.
[26]Kim EK,Choi EJ.Pathological roles of MAPK signaling pathways in human diseases[J].Biochim Biophys Acta,2010,1802(4):396-405.
[27]王健辉,程肖蕊,周文霞,等.β分泌酶生物学特性的研究进展[J].国际药学研究杂志,2014,41(4):400-406,423.
[28]赵元,郑红霞,徐颖,等.中药植物雌激素的研究进展[J].中国中药杂志,2017,42(18):3474-3487.
[29]张雪姣,季晖,唐苏苏,等.雌激素受体在中枢神经系统疾病中的作用[J].药学研究,2018,37(4):221-225,248.
[30]王一夫,刘爽.MAPKs信号通路与阿尔兹海默病的研究进展[J].世界中医药,2016,11(9):1929-1931.
[31]刘志勇,游宇,刘玉晖,等.补阳还五汤通过调节MAPK信号通路抗内皮细胞损伤的作用[J].中国临床药理学杂志,2016,32(22):2098-2103.
[32]朴钟源,魏亚芬,宋琳,等.地黄饮子对Aβ诱导的SH-SY5Y细胞RAGE/p38 MAPK/NF-κB信号通路的影响[J].中华神经医学杂志,2017,16(10):1022-1027.
[33]温晓强,第五永长,岳涛,等.补益脾胃元气方药对Aβ诱导的海马神经元JNK及p38MAPK信号通路相关蛋白及其磷酸化表达的影响[J].四川中医,2019,37(6):25-28.
[34]谢沛俊,郝彦伟,郭静,等.基于PI3K/AKT/GSK-3β通路探讨远志散调控阿尔兹海默病大鼠tau蛋白磷酸化的研究[J].中华中医药学刊,2020,38(11):167-170,280-286.
[35]赵翠霞,江钰,省格丽.基于PI3K/AKT/GSK-3β信号通路探讨益智治呆方对AD模型大鼠学习记忆能力的影响及其作用机制[J].中医药导报,2020,26(13):18-22,26.
[36]章鹏轩.阿魏酸和一氧化氮供体偶联物的合成与抗肿瘤活性研究[D].南京:南京中医药大学,2016.
[37]杜俊蓉,旷喜,陈娅姝,等.I3K/AKT信号通路在藁本内酯治疗老年性痴呆有效性中的作用[J].中国药理学与毒理学杂志,2012,26(3):421-422.
[38]曾嘉豪,杨承佑,文军,等.芍药苷对APP/PS1小鼠的神经细胞保护作用及机制研究[J].中国病理生理杂志,2018,34(6):1049-1054.
(2020-10-30收稿 责任编辑:魏庆双,徐颖)

