油茶果壳原花青素的提取及抑制α-淀粉酶活性的研究
刘承毅,吴雪辉
(1.华南农业大学 食品学院,广州 510642;2.广东省油茶工程技术研究中心,广州 510642)
原花青素(proanthocyanidins),是一类植物中广泛存在的黄烷醇单体及其聚合体的多酚类化合物[1]。其单体主要包括儿茶素、表儿茶素、表没食子儿茶素等[2],单体通过聚合形成二聚体至多聚体,其中以C6-C4或C8-C4连接形成的多聚体为B型原花青素,以C2-O-C5或C2-O-C7等方式连接形成的多聚体为A型原花青素[3]。原花青素是一种天然的强抗氧化剂,常常作为添加剂应用于饮料、酒等中[4]。此外,有研究表明原花青素还具有降血糖、预防心血管疾病等作用[5-6]。
通过抑制口腔及肠道中α-淀粉酶的活性,可以减少对淀粉类食物的分解,降低人体对糖类的吸收,来达到降低血糖及防治糖尿病的目的[7]。原花青素具有较好的抑制α-淀粉酶活性的效果,Ann Barrett等[8]研究了可可、石榴、蔓越莓、葡萄中原花青素对α-淀粉酶活性的抑制作用,结果显示:4种原花青素对α-淀粉酶活性均有一定的抑制作用;刘睿等[9]也发现高粱原花青素能够有效抑制α-淀粉酶活性。
油茶果壳(Camelliaoleiferashell)是油茶籽果实的外种皮,占鲜果重量的50%~60%,因对其利用方式有限,果壳常常被作为废弃物丢掉,造成了资源的浪费[10]。油茶果壳中含有丰富的原花青素[11],目前,从果壳中提取原花青素及对α-淀粉酶活性抑制方面的研究较少,因此本文以油茶果壳为原料,采用溶剂提取法,利用响应面试验优化原花青素的提取工艺,并探究对α-淀粉酶活性的抑制作用,以期为油茶果壳的高值化利用提供参考。
1 材料与方法
1.1 材料与仪器
油茶果:采自东莞市樟木头林场。
无水乙醇(分析纯):天津市富宇精细化工有限公司;浓硫酸、香草醛、酒石酸钾钠、亚硫酸钠(分析纯):广州化学试剂厂;可溶性淀粉:天津市科密欧化学试剂有限公司;3,5-二硝基水杨酸(纯度≥98%):国药集团化学试剂有限公司;原花青素标准品(纯度≥95%):上海如吉生物科技发展有限公司;猪胰α-淀粉酶(10 U/mg):美国Sigma-Aldrich公司;阿卡波糖:上海伊卡生物技术有限公司。
UV-5200型紫外可见分光光度计 上海元析仪器有限公司;BJ-150型多功能粉碎机 德清拜杰电器有限公司;JJ1000型电子天平 常熟市双杰测试仪器厂;HWS24型电热恒温水浴锅 广州航信科学仪器有限公司;101-2A型电热鼓风干燥箱 天津市泰斯特仪器有限公司。
1.2 试验方法
1.2.1 样品预处理
将油茶果壳洗净后切块,于45 ℃的烘箱中烘干至恒重,粉碎过40目筛,密封、避光储存于干燥箱中备用。
1.2.2 原花青素含量的测定
原花青素含量的测定参考孙芸等[12]的方法并略做修改。
1.2.2.1 原花青素标准曲线的制作
分别加入0.50 mL浓度为0.05,0.10,0.15,0.20,0.25,0.30 mg/mL的原花青素标准溶液于试管中,依次加入2.50 mL 1%香草醛-甲醇溶液、2.50 mL 30%浓硫酸-甲醇溶液,在30 ℃温度下避光水浴30 min。反应结束后,摇匀,用紫外分光光度计测500 nm 处的吸光值。以原花青素浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
1.2.2.2 样品中原花青素含量的测定
取0.50 mL甲醇稀释后的原花青素样液按照1.2.2.1的方法进行反应,反应结束后用紫外分光光度计测500 nm处的吸光值。根据标准曲线计算样品中原花青素浓度,并利用下式计算原花青素得率:
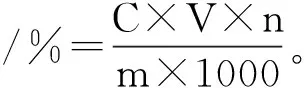
(1)
式中:C为测得的原花青素浓度,mg/mL;V为样液体积,mL;n为样品稀释倍数;m为油茶果壳粗粉质量,g。
1.2.3 单因素试验
1.2.3.1 油茶果壳中原花青素的提取
称取5组,每组2.00 g的果壳粗粉,加入体积分数为40%的乙醇溶液,控制料液比为1∶20 (g/mL);置于恒温水浴锅中,在50 ℃温度下提取1 h,抽滤得滤液,提取1次,按照1.2.2.2的方法测定并计算原花青素的得率。
1.2.3.2 单因素试验设计
根据1.2.3.1中原花青素的提取方法,在控制其他条件相同的情况下,仅改变其中一个条件,分别考察乙醇体积分数(0%、20%、40%、60%、80%)、提取温度(30,40,50,60,70,80,90 ℃)、提取时间(2,4,8,12,20,30,60 min)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50,g/mL)和提取次数(1,2,3,4,5次)对原花青素得率的影响。
1.2.4 响应面试验设计
综合单因素试验,选取对原花青素得率影响较大的3个因素,即:乙醇体积分数、料液比和提取时间,分别以A,B,C表示。以A,B,C为自变量,以原花青素得率为响应值(Y)进行试验。采用Design-Expert 10对试验数据进行回归分析。每一自变量的低、中、高试验水平分别以-1,0,1进行编码。
1.2.5 α-淀粉酶活性抑制作用测定
参考丁华杰等[13]的方法并略做修改,向25.00 mL具塞刻度试管中依次加入0.50 mL 2.00 mg/mL α-淀粉酶溶液、0.50 mL 0.20 mol/L磷酸缓冲液、0.50 mL不同浓度的原花青素溶液,于37 ℃水浴锅中反应10 min,然后加入0.50 mL在37 ℃预热过的1%淀粉溶液,反应6 min后加入1.00 mL DNS溶液,并立即放入沸水中加热5 min,加热完毕后放入流水中冷却至室温,定容至25.00 mL,于540 nm处测吸光度值。试验以相同浓度阿卡波糖作阳性对照,绘制不同浓度抑制剂对α-淀粉酶活性的抑制曲线,用下式计算α-淀粉酶活性的抑制率:

(2)
式中:A1、A2、A3、A4分别是空白管、空白对照管、样品管、背景对照管的吸光度值。
1.3 数据统计及分析
2 结果与分析
2.1 原花青素标准曲线的绘制
由图1可知,原花青素标准曲线方程为:y=2.63x+0.0394(R2=0.9991),在0.05~0.30 mg/mL范围内时,原花青素浓度与吸光值线性关系良好。

图1 原花青素标准曲线Fig.1 The standard curve of proanthocyanidins
2.2 单因素试验结果
2.2.1 乙醇体积分数对原花青素得率的影响
乙醇体积分数对原花青素得率的影响见图2。

图2 乙醇体积分数对原花青素得率的影响Fig.2 Effect of ethanol volume fraction on the yield of proanthocyanidins
由图2可知,乙醇体积分数在0%~40%范围内时,随着乙醇浓度增大,原花青素得率增大;当乙醇体积分数达到40%时,得率达到最高值,随着乙醇体积分数的进一步增大,原花青素得率开始下降。原花青素是一种多酚类化合物,含有较多酚羟基,因而具有一定极性,依据相似相溶的原理,当溶剂极性和原花青素极性相当时,溶解度达到最大,得率最高[14]。
2.2.2 提取温度对原花青素得率的影响
提取温度对原花青素得率的影响见图3,图中A和B分别为80 ℃和90 ℃提取液冷却后的状态。
由图3可知,当提取温度在30~80 ℃范围内时,原花青素得率随着温度的升高而增大,80 ℃时达到最大值;超过80 ℃后,原花青素得率下降。温度升高,会加速原花青素的溶出,但高温同样也能加快原花青素的氧化破坏[15],最终,在80 ℃时得率达到最大值。在试验中发现,80 ℃时提取液冷却后会出现少量凝胶,90 ℃时则会出现大量凝胶。有研究表明,油茶果壳中含有较多胶类物质[16],此类物质经过高温后冷却会形成凝胶,由于这种不利反应会影响后续的纯化过程,所以选择70 ℃作为最佳提取温度。
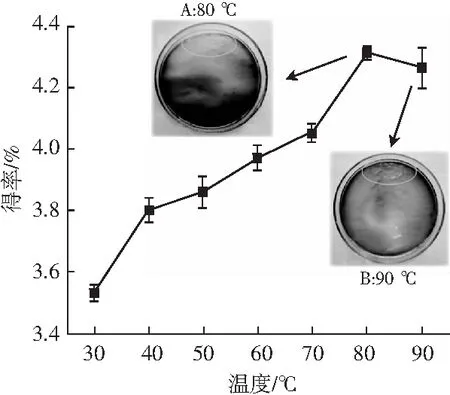
图3 提取温度对原花青素得率的影响Fig.3 Effect of extraction temperature on the yield of proanthocyanidins
2.2.3 提取时间对原花青素得率的影响
提取时间对原花青素得率的影响见图4。
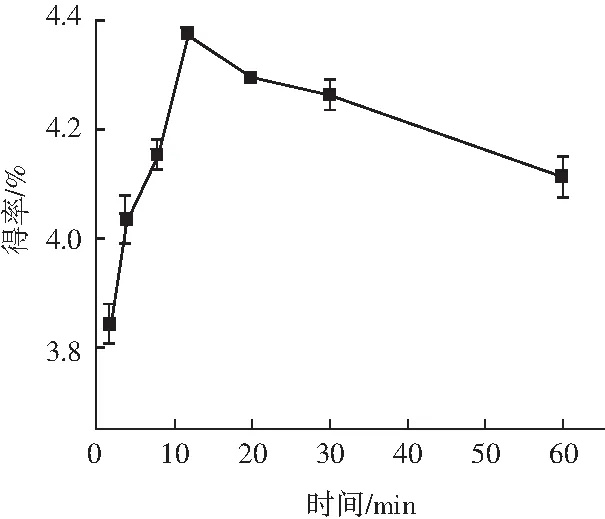
图4 提取时间对原花青素得率的影响Fig.4 Effect of extraction time on the yield of proanthocyanidins
由图4可知,提取时间为2 min时就可以提取到很大部分的原花青素,并且随着时间的增加,得率持续增大,到12 min时得率达到最大值,超过12 min后,原花青素得率下降。原因是随着时间的增加,果壳中原花青素溶解越来越充分,得率增加,但时间过长也会导致酚类物质遭到破坏[17],不利于原花青素的提取,因此选择提取时间为12 min。此外,相比于从葡萄籽[18](提取时间为4 h)和板栗壳[19](提取时间为1.5 h)中提取原花青素,从油茶果壳中提取原花青素的时间很短,这可能与果壳材料特性有关,油茶果壳结构呈多孔状[20],且易吸水膨胀,使果壳内物质容易与溶剂接触并溶解,因此采用直接溶剂提取能够在较短时间内完成果壳中原花青素的提取。
2.2.4 料液比对原花青素得率的影响
料液比对原花青素得率的影响见图5。
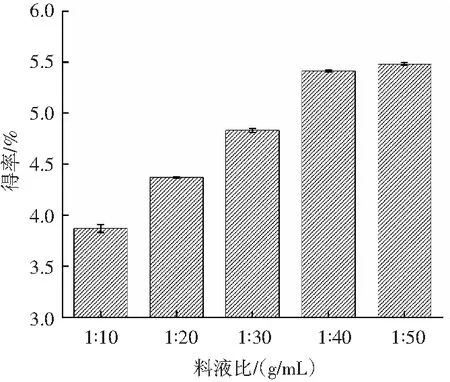
图5 料液比对原花青素得率的影响Fig.5 Effect of solid-liquid ratio on the yield of proanthocyanidins
由图5可知,料液比在1∶10~1∶50 (g/mL)范围内时,原花青素得率随着溶剂的增加而增加。增大溶剂量可以加大溶剂与物料的接触面积[21],使原花青素的得率增加,当料液比为1∶40 (g/mL)后,部分与油茶果壳结合较紧密的原花青素已很难被提取出来,得率趋于稳定。考虑得率和成本,选择料液比为1∶40 (g/mL)。
2.2.5 提取次数对原花青素得率的影响
提取次数对原花青素得率的影响见图6。

图6 提取次数对原花青素得率的影响Fig.6 Effect of extraction times on the yield of proanthocyanidins
由图6可知,提取2次时,原花青素得率显著降低,提取3~5次时,可以发现提取液中原花青素已经很少,说明提取1次就能在很大程度上提取出果壳中的原花青素。综合考虑能源消耗、材料成本,选择提取次数为1次。
2.3 响应面试验结果与分析
2.3.1 响应面试验设计及结果
根据Box-Benhnken的中心组合试验设计原理,综合单因素试验结果,选取对原花青素得率影响较大的3个因素,即:乙醇体积分数、料液比、提取时间,分别以A,B,C表示,试验因素和水平设计见表1。试验方案及结果见表2,试验共17个试验点,其中4,7,10,14,17是中心试验,其余为析因试验。

表1 响应面试验设计因素与水平Table 1 The factors and levels of response surface test design
表2 响应面分析结果Table 2 The results of response surface analysis
2.3.2 模型的建立与显著性检验
采用Design-Expert 10对所得的试验结果进行多元回归分析,分析结果见表3。由于各因素对原花青素得率的影响不是简单的线性关系,为了明确各因子对响应值的影响,对表2中原花青素得率进行回归拟合,获得二次多项回归方程:R1=5.410+0.056A+0.360B+0.120C+0.042AB+0.035AC-0.060BC-0.330A2-0.130B2- 0.190C2。

表3 回归分析结果Table 3 The results of regression analysis
由表3可知,整体模型的P值<0.01,表明该二次方程模型达到极显著水平。失拟项为0.30>0.05,表明该项不显著,说明未知因素干扰很小。模型相关系数R2=0.9907,校正决定系数RAdj2=0.9788,说明该模型对试验拟合较好,可以用于原花青素得率的理论值预测。乙醇体积分数、提取时间、料液比的P值均小于0.05,说明各条件对原花青素得率均有显著性影响。由F值可知,各因素对原花青素得率的影响次序为:料液比>提取时间>乙醇体积分数。
2.3.3 响应面分析
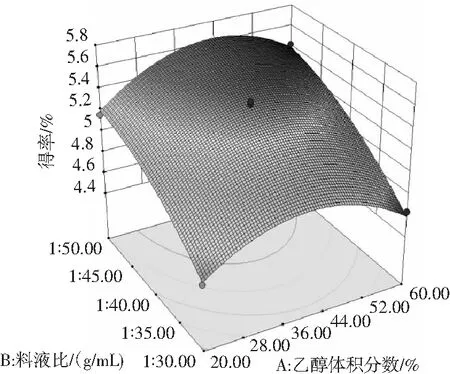
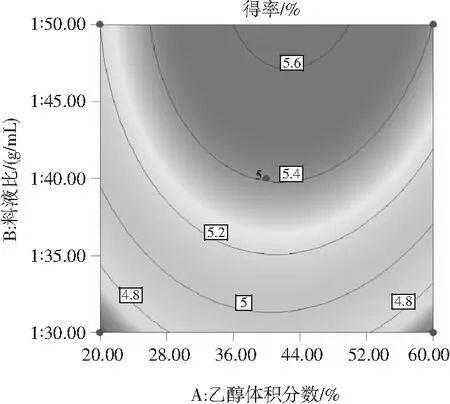
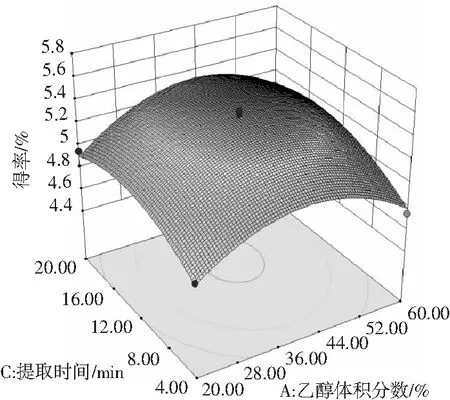

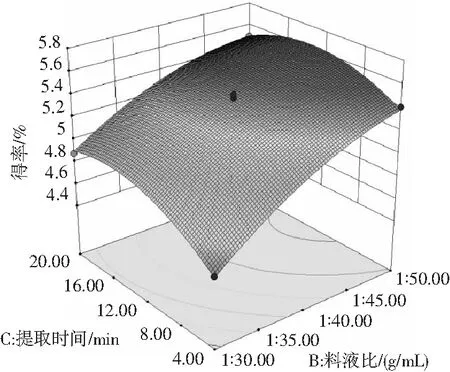
使用Design-Expert 10软件绘制得到等高线图和响应面图(见图7),分别反映了乙醇体积分数、料液比和提取时间的交互作用。其中等高线图呈圆形,表示交互作用不显著,呈椭圆形则表示交互作用显著[22],由图7可知,各因素等高线图均接近圆形,表明各因素之间的交互作用不明显。
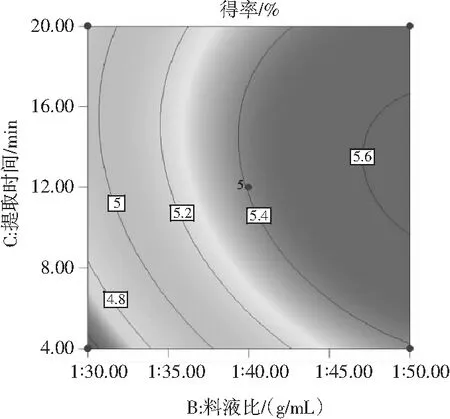
图7 各因素交互作用对原花青素得率影响的响应面图和等高线图Fig.7 Response surface and contour maps of the interaction of various factors on the yield of proanthocyanidins
2.3.4 提取条件的优化及验证试验
结合回归模型的数学分析可知,油茶果壳原花青素的最佳提取工艺参数为:提取时间13.27 min,乙醇体积分数43.12%,料液比1∶50(g/mL)。实际中,调整参数为:提取时间13 min,乙醇体积分数43%,料液比1∶50(g/mL),在此工艺条件下油茶果壳原花青素的理论得率为5.64%。为检验响应面法的可靠性,采用最佳提取条件进行3次重复试验,实际测得的平均原花青素得率为5.58%,接近于理论预测值。此结果说明实际试验值与软件预测值吻合度良好,证明此优化方案可行。
2.4 原花青素对α-淀粉酶活性的抑制作用
原花青素对α-淀粉酶活性的抑制曲线见图8。
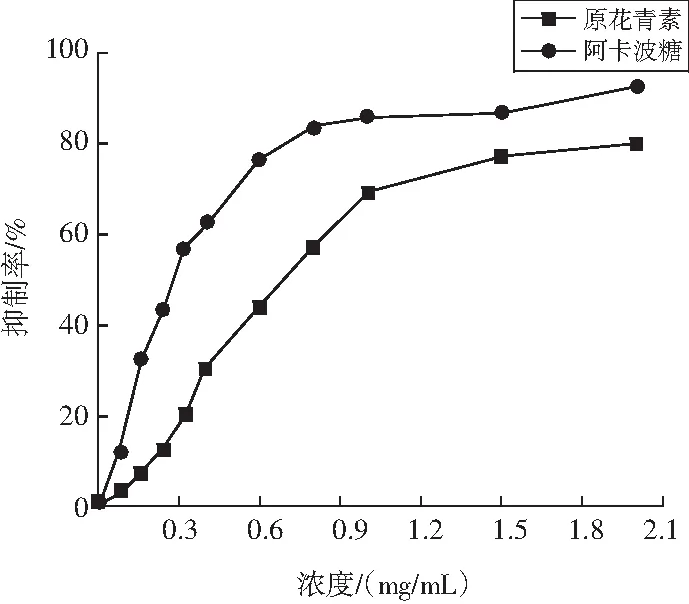
图8 油茶果壳原花青素对α-淀粉酶活性的抑制曲线Fig.8 Inhibition curves of proanthocyanidins from Camellia oleifera shell on α-amylase activity
由图8可知,在0.08~1.50 mg/mL浓度范围内,原花青素对α-淀粉酶活性的抑制率快速增加,超过1.5 mg/mL后,抑制率增加趋于平缓。周培羽等[23]研究了原花青素对α-淀粉酶的抑制作用及抑制机理,结果显示:不同聚合度的原花青素均能够插入α-淀粉酶的活性位点,占据催化中心,阻碍α-淀粉酶与底物的结合。当原花青素浓度低于1.5 mg/mL时,α-淀粉酶的结合位点未饱和,抑制率快速升高;浓度超过1.5 mg/mL后,结合位点趋于饱和,抑制率缓慢增加。结果显示:油茶果壳原花青素对α-淀粉酶的活性抑制呈现一定的剂量依赖关系,当浓度为2.00 mg/mL时,α-淀粉酶活性的抑制率达到79.64%,低于对照物阿卡波糖的92.06%。
分别对图8中原花青素和阿卡波糖浓度和抑制率的关系进行多元非线性拟合,计算得出原花青素的半抑制浓度为0.71 mg/mL,对照物阿卡波糖的半抑制浓度为0.30 mg/mL。原花青素粗提物对α-淀粉酶活性的抑制效果弱于阿卡波糖,可能是粗提物中含有较多杂质,后期对原花青素的纯化过程有利于进一步提升抑制效果[24]。
3 结论
通过单因素试验结合响应面分析法优化油茶果壳中原花青素的提取工艺,并探究原花青素对α-淀粉酶活性的抑制作用。结果显示:油茶果壳中原花青素的最佳提取工艺条件为提取时间13 min,乙醇体积分数43%,料液比1∶50(g/mL),原花青素含量达到极大值5.58%,与理论预测值接近。测定了不同浓度下原花青素对α-淀粉酶活性的抑制作用,抑制率可达到79.64%,半抑制浓度为0.71 mg/mL,表明油茶果壳原花青素具有较好的抑制α-淀粉酶活性效果,有望作为膳食添加剂应用于血糖控制及糖尿病的防治。

