花椒总多酚的提取工艺优化及其抑菌作用
王文杰,焦士蓉,孙博瑞,包善思
(西华大学 食品与生物工程学院,成都 610039)
花椒是我们常见的调味品, 放在食物中不仅有特殊的芳香气,花椒还具有抗菌、温中散寒、除湿、止痛、杀虫、解鱼腥毒的功效,治积食停饮、心腹冷痛、呕吐、齿痛、蛔虫病、蛲虫病、阴痒、疮疥,在食品和药品领域具有很大潜力[1]。利用植物中活性物质制备农药是当今热点之一,对食品安全方面跨出了重要的一步,而花椒中总多酚物质具有不错的杀菌效果[2-3],抑菌作用是花椒的重要功能活性之一[4]。天然防腐领域具有广阔的应用前景[5-6]。近年来对花椒的研究主要集中在其精油和生物碱的提取利用[7],花椒多酚类物质研究相对较少,本文主要以花椒为原料,优化多酚提取工艺并对其抑制病原真菌的能力做出了探索。
1 材料与方法
1.1 材料与仪器
花椒(ZanthoxylumbungeanumMaxim.):市售;福林-酚试剂(AR):上海如吉生物科技发展有限公司;硫酸链霉素原药(Amresco-0382);90%多菌灵原药(Carbendazim):陕西先农生物科技有限公司;其余试剂均为分析纯。
供试菌株:玉米小斑病菌(Helminthosporiummaydisbio-12080)、小麦赤霉菌(GibberellazeaeACCC 39334)、番茄灰霉菌(灰葡萄孢菌BotrytiscinereaPers. ACCC 36034)、葡萄白腐菌(白腐盾壳霉菌ConielladiplodiellaPetrak et Sydow ACCC 36140)、油菜菌核病菌(核盘菌Sclerotiniasclerotiorum(Lib.) de Bary ACCC 36083)、柑橘绿霉菌(Penicilliumdigitatum(Pers.)Sacc ACCC 30389)、马铃薯晚疫病菌(Phytophthorainfestans(Mont.) de Bary)均购自中国农业微生物菌种保藏管理中心,于4 ℃保存备用。
PDA培养基[8]。
DHG-9070A型电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;MP17C-KE美的家用微波炉 佛山市顺德区北滘镇三洪奇工业区;UV-2600型紫外可见分光光度计 上海尤尼柯仪器有限公司。
1.2 实验方法
1.2.1 标准曲线的绘制
称取0.1 g没食子酸,放入100 mL容量瓶中,加入100 mL蒸馏水定容。取不同体积的母液定容至50 mL,加入2 mL的福林-酚摇至均匀,静置5 min,滴入4 mL 10%的碳酸钠溶液,放入25 ℃恒温水浴中,2 h后进行吸光度测定[9-10]。于760 nm处测定吸光度,绘制标准曲线,见图1。

图1 多酚标准曲线图Fig.1 The standard curve of polyphenols
由图1可知,其相关系数为R2=0.9998,说明此回归方程的拟合度高,可准确计算出多酚的质量浓度。
1.2.2 多酚的提取实验
称取10 g花椒于烧瓶中,倒入60%乙醇浸泡10 min,之后定容至100 mL,在恒温水浴中回流提取,取样100 μL,计算其中多酚的质量浓度。
1.2.3 多酚含量的测定
花椒的干燥环境设置为50 ℃,干燥后进行粉碎,称取1 g粉碎后的花椒粉末,放入50 mL溶剂中进行提取,抽滤并收集提取液。准确吸取0.1 mL提取液进行反应,根据标准曲线计算多酚质量浓度,并按照公式(1)计算多酚收率。
(1)
式中:P为总多酚收率,mg/g;C为多酚的质量浓度,μg/mL;V为花椒提取液的体积,mL;n为稀释倍数;W为花椒质量,g。
1.2.4 单因子实验
参照李利华[11]的方法,对目数、乙醇浓度、料液比、微波功率和提取时间进行单因素实验:准确称取相同批次的备用花椒粉1.0 g,设置不同目数(<40,40~60,60~80,80~100,>100)、提取液乙醇浓度(0%、20%、40%、60%、80%)、不同料液比(1∶10、1∶20、1∶30、1∶40、1∶50,g/mL)、微波功率(136,264,440,616,800 W)、提取时间(20,40,60,80,100 s)。根据单因素水平实验结果进行极差分析,最终选出3个最主要的影响因素,通过设计响应曲面进行优化实验。
1.2.5 响应曲面优化实验设计
通过对单因素实验进行极差分析后,响应值选用多酚含量,选取对收率影响最大的料液比、乙醇浓度、微波时间这3个提取参数为研究对象,设计响应面Box-Behnken实验[12]。采用Design Expert 8.05b软件辅助实验,实验因素水平及编码值见表1。

表1 Box-Behnken设计实验因素水平及编码Table 1 The factors and levels of Box-Behnken design experiment
1.2.6 花椒总多酚物质抑菌活性的初筛
参考朱奇奇等[13]的平板生长速率法,并做适当修改。通过下式计算其相对抑菌率:

2 结果与分析
2.1 单因素实验结果
2.1.1 目数对花椒多酚收率的影响
由图2可知,花椒多酚的提取量随着目数的增加先提高后下降,当目数为80~100目时,多酚收率达到最高。

图2 目数对花椒多酚收率的影响Fig.2 The effect of mesh number on the yield of polyphenols from Zanthoxylum bungeanum Maxim.
2.1.2 乙醇浓度对花椒多酚收率的影响
由图3可知,花椒的多酚收率呈先上升后下降的趋势,当乙醇浓度达到60%时有较高的收率65.36 mg/g。这可能是60%乙醇的极性使糖类等水溶性物质浸出量不大,且达到断裂化学键的浓度。乙醇液价格低廉、安全性高且有利于清洁生产[14],所以将乙醇作为提取的溶剂选择。

图3 乙醇浓度对花椒多酚收率的影响Fig.3 Effect of ethanol concentration on the yield of polyphenols from Zanthoxylum bungeanum Maxim.
2.1.3 料液比对花椒多酚收率的影响
适当的料液比使得物料与溶剂间有好的浓度差,有利于提高多酚的提取速率,能够降低成本。由图4可知,花椒的多酚收率随着溶剂用量的增加先增大后降低,其下降的原因可能是其中的多酚物质已经大部分溶出,溶剂用量已经不会对收率有促进作用,继续增加溶剂用量干扰多酚测量。

图4 料液比对花椒多酚收率的影响Fig.4 Effect of solid-liquid ratio on the yield of polyphenols from Zanthoxylum bungeanum Maxim.
2.1.4 微波功率对花椒多酚收率的影响
微波产生的电磁场加速了被萃取成分由物料内部向萃取溶剂界面的扩散速率,从而缩短了萃取时间[15]。由图5可知,随着微波功率提高,花椒多酚收率不断增高,当功率达到600 W之后,多酚收率开始下降,这是由于微波功率过高导致不均匀或急速受热,使花椒多酚发生分解,导致收率下降。

图5 微波功率对花椒多酚收率的影响Fig.5 Effect of microwave power on the yield of polyphenols from Zanthoxylum bungeanum Maxim.
2.1.5 微波提取时间对花椒多酚收率的影响
不同的提取时间同样也影响着多酚收率。由图6可知,在60 s内多酚收率不断上升,之后开始下降,可能是由于在60 s内多酚已经提取完成,随着时间的延长,溶出的多酚物质变少。
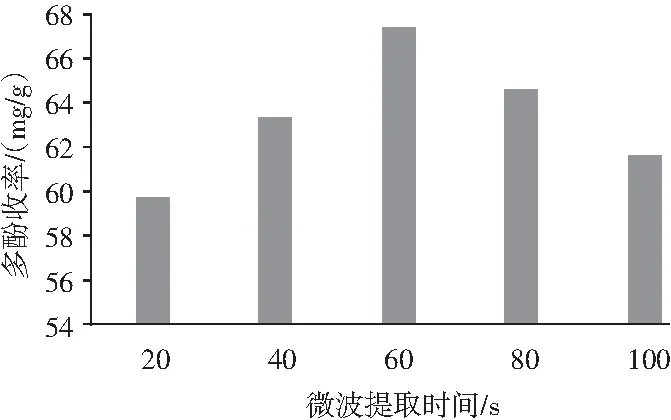
图6 微波提取时间对花椒多酚收率的影响Fig.6 Effect of microwave extraction time on the yield of polyphenols from Zanthoxylum bungeanum Maxim.
2.2 响应面实验结果及分析
通过单因素实验,选取对多酚收率影响较大的料液比(B)、乙醇浓度(A)、微波提取时间(C)这3个因素做Box-Behnken设计,并且以花椒多酚收率(R)作为响应值,设计及结果见表2。
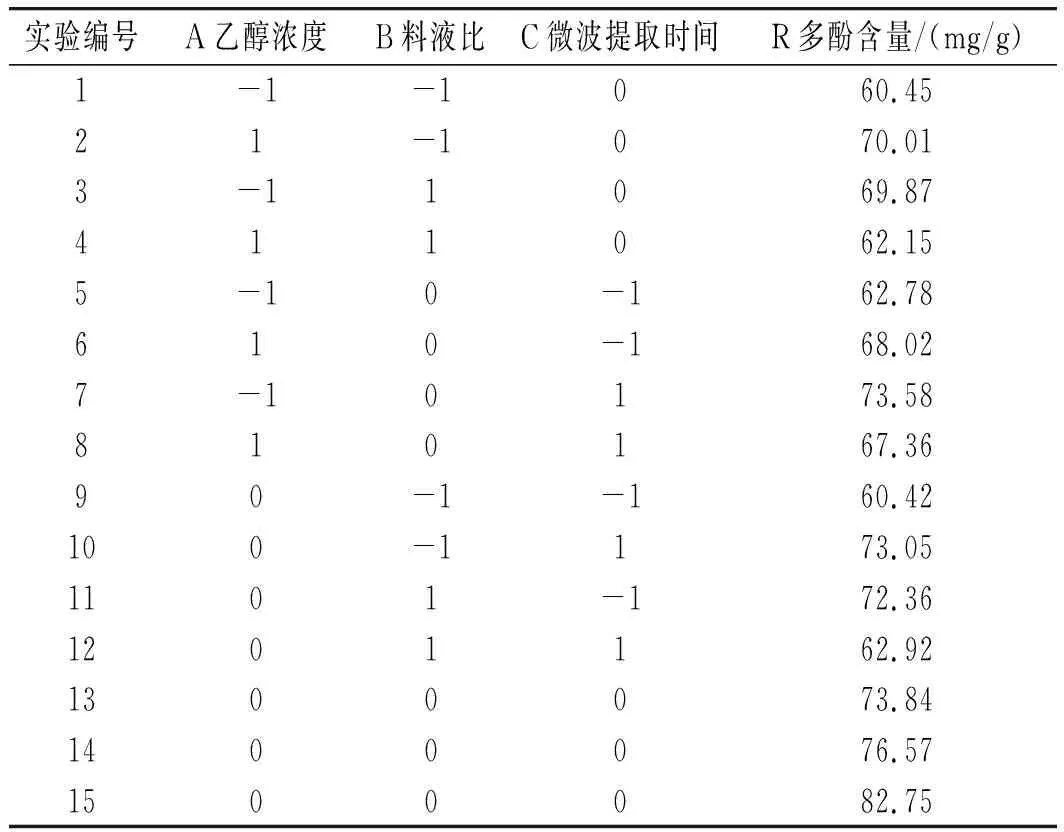
表2 Box-Behnken响应面实验设计及结果Table 2 Box-Behnken response surface design and results
利用Design Expert 8.05b软件对表2的结果进行分析,得到回归模型方差,见表3。

表3 回归模型方差分析Table 3 The variance analysis of regression model
经过Design Expert回归拟合分析,得到多酚收率(R)对乙醇浓度(A)、料液比(B)和微波时间(C)的二次多项回归方程为:R=77.72+0.11A+0.42B+0.67C-4.32AB-2.86AC—5.52BC-5.68A2-6.42B2-4.11C2。
由表3可知,回归模型P=0.0292<0.05,即具有一定的显著性。失拟项P=0.9451>0.05,不显著,说明方程对实验的拟合程度很高。R2=0.9179,表明实际值与采用该方法的预测值有着很高的相关性。说明该方法具有可靠性,选用该方法对不同条件下的多酚收率进行预测是有效的。回归方程各项方差分析表明,3个影响因素对花椒总多酚提取率的影响依次是:C(提取时间)>B(料液比)>A(乙醇浓度)。因素AB、BC、A2、B2对花椒总多酚的提取有显著影响(P<0.05)。
2.3 因子间交互作用分析

由图7可知,在微波时间水平为0,即微波时间为60 s时,料液比与微波提取时间对花椒多酚收率的交互效应。响应面曲线平滑,即乙醇浓度对花椒总多酚的提取率影响较小,而料液比的影响则较大,表现为曲线较为陡峭。由等高线图可知,当料液比为1∶40(g/mL)时,等高线明显呈椭圆形,说明料液比与乙醇浓度对花椒总多酚含量的交互效应比较显著。

图7 料液比和乙醇浓度交互作用的响应面图和等高线图Fig.7 Response surface and contour plots of the interaction between solid-liquid ratio and ethanol concentration

由图8可知,在乙醇浓度水平为0,即乙醇浓度为60%时,料液比与乙醇浓度对花椒多酚收率的交互影响。由响应面图可知,微波时间对花椒总多酚提取影响较大,表现为曲线较陡峭,而料液比影响相对较小。等高线图表现为明显的椭圆形,可以得到总多酚的提取率受料液比和微波时间交互作用的影响较为显著。

图8 料液比和微波时间交互作用的响应面图和等高线图Fig.8 Response surface and contour plots of the interaction between solid-liquid ratio and microwave time

由图9可知,在料液比水平为0的情况下,即料液比为1∶40时,乙醇浓度与微波时间对花椒多酚收率的交互影响。由响应面图可知,图像呈现马鞍形,说明乙醇浓度与微波时间对多酚提取的影响较接近。乙醇浓度与微波时间对花椒总多酚提取的影响比较,乙醇浓度的影响较为显著,等高线更接近乙醇浓度。

图9 乙醇浓度与微波时间交互作用的响应面图和等高线图Fig.9 Response surface and contour plots of the interaction between ethanol concentration and microwave time
2.4 验证实验
通过实验辅助软件Design Expert优化提取条件得到理论的最佳提取条件和响应值:料液比为1∶ 37.3 (g/mL),乙醇浓度为67.3%,微波提取时间为67.3 s,花椒总多酚含量为63.95 mg/g。
模型的验证:综合考虑和分析实验的好操作性,以及溶剂浓度高对多酚测量带来的干扰,选取料液比为1∶40(g/mL),乙醇浓度为60%,微波提取时间为60 s,微波功率为616 W的条件下进行实验结果为63.11 mg/g;通过理论方程计算花椒总多酚含量为64.27 mg/g,相对误差为1.84%,小于10%,证明响应面优化花椒总多酚提取工艺是可行的,该模型有效。
2.5 花椒总多酚提取物抑菌活性的初筛结果
将从花椒提取中的总多酚物质配制成浓度为100 mg/mL的培养基,按照上述的实验方法,用花椒提取物对7种植物病原真菌进行抑菌活性的初筛,初筛的结果见表4。

表4 花椒总多酚提取物对7种植物病原真菌的抑菌率Table 4 The antibacterial rates of total polyphenol extracts from Zanthoxylum bungeanum Maxim. against seven plant pathogenic fungi
由表4可知,花椒总多酚对7种植物病原菌抑制率相对较小,对番茄灰霉菌的抑菌率相对较高,达到73.81%。
2.6 不同浓度花椒总多酚提取物对番茄灰霉菌的抑菌结果

表5 不同浓度总多酚对番茄灰霉素的抑菌率Table 5 The antibacterial rates of total polyphenols with different content against Botrytis cinerea

图10 不同浓度总多酚对番茄灰霉菌的抑菌效果Fig.10 The antibacterial effect of total polyphenols with different content against Botrytis cinerea
采用不同浓度的花椒总多酚对番茄灰霉菌进行抑菌实验,实验结果表明花椒总多酚浓度与对番茄灰霉菌的抑菌率呈线性相关,可以得到线性回归方程Y=1.1920X+3.2072,相关系数r=0.9539,EC50=31.91 mg/L,经卡方检验,卡方值X2=0.294,其结果可靠。
3 结论
通过Box-Behnken响应曲面法实验,确定了花椒总多酚提取的最佳实验条件:料液比为1∶40 (g/mL),提取剂乙醇浓度为60%,所用的微波提取时间为60 s。在该优化条件下进行实验,80~100目花椒粉末,在微波功率为616 W时提取的多酚含量能够达到63.11 mg/g。
通过活性初筛和稳定性的实验分析,得出花椒总多酚物质对7种病原真菌的抑制率相对较小,其中花椒总多酚提取物对番茄灰霉菌的抑制率最高,为73.81%,达到50%以上。分析花椒总多酚对番茄灰霉菌稳定性实验结果,得到回归方程是Y=1.1920X+3.2072,相关系数为0.9539,EC50=31.91 mg/L,经卡方检验(X2=0.294,df=3,P>0.05),其结果可靠。

