基于高通量测序对不同散装宜宾芽菜的细菌群落结构分析
王新惠,孙劲松,丁悦,刘力嘉,潘攀,张雅琳,刘洋*
(1.成都大学 食品与生物工程学院,成都 610106;2.宜宾学院固态发酵资源利用四川省重点实验室,四川 宜宾 644000)
芽菜是我国的一种传统腌制菜,可搭配各种家常菜食用,因其方便食用、鲜香可口、营养丰富受到广大消费者的青睐。芽菜由芥菜的嫩茎划成丝后晒干,加盐和香料,装坛密封,自然发酵而成。芽菜又分为甜芽菜和咸芽菜,发酵前加入红糖的属于甜芽菜,不加红糖的是咸芽菜,而宜宾芽菜属于甜芽菜。传统工艺发酵生产的宜宾芽菜具有发酵周期长[1]、含盐量较高、风味不稳定等缺点[2]。值得注意的是在芽菜发酵中微生物起着至关重要的作用,芽菜质地和风味的变化高度都依赖于发酵环境微生物,发酵菌群会赋予芽菜风味的形成,并且有助于亚硝酸盐降解等。目前,已有学者对芽菜中微生物群落的结构和组成进行初步的研究,左勇等[3]通过高通量测序技术检测出宜宾芽菜发酵过程中优势菌属是芽孢杆菌属(Bacillusspp.);白光剑等[4]通过高通量测序技术分析发现在芽菜中的优势菌门为变形菌门(Proteobacteria)和硬壁菌门(Firmicute);尹曦[5]通过非培养方法发现宜宾芽菜中主要的乳酸菌为植物乳杆菌(Lactobacillusplantarum)、坚强肠球菌(Enterococcusdurans)和戊糖片球菌(Pediococcuspentosaceus),可见研究学者对芽菜中的菌群有了初步的研究,但是对于不同芽菜之间微生物结构的差异性研究较少。
为了解成品散装宜宾芽菜之间的微生物群落结构组成的差别,通过高通量测序技术对同一市场上出售的3种不同品牌的散装宜宾芽菜进行研究,以期能锚定不同品牌散装芽菜中的优势菌群,并且探究成品散装芽菜的微生物安全性,为后续进一步深入研究宜宾芽菜奠定了理论基础。
1 材料与方法
1.1 实验材料
散装芽菜采购自成都市十陵镇久贸综合市场,取3种不同品牌的散装宜宾芽菜样品,分别命名为M1、M2和M3。所有样品均为无菌采样,使用无菌塑封袋包装后置于-80 ℃冰箱中保存待用。
1.2 试剂与仪器
无水乙醇和液氮:成都新金山化工有限公司;乙二胺四乙酸(EDTA)、盐酸、磷酸三钠、氯化钠、氯仿、异戊醇等:均购于成都市科隆化学品有限公司。
E.Z.N.ATMMag-Bind Soil DNA Kit提取试剂盒 美国Omega公司;QIAquick Gel Extraction Kit (QIAGEN)凝胶回收试剂盒;Qubit 2.0荧光计 ThermoFisher公司;HiSeq Rapid SBS Kit v2 (FC-402-4023 500 Cycle)测序试剂盒、HiSeq测序仪 美国Illumina公司;Applied Biosystems®Gene Amp®PCR System 9700 PCR仪;台式冷冻离心机 德国Eppendorf公司。
1.3 样品DNA提取和PCR扩增
使用特定的DNA提取试剂盒进行基因组DNA提取后,使用0.8%琼脂糖凝胶电泳检测DNA。16S 引物使用:515F(5'-GTGCCAGCMGCCGCGGTAA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')[6]。以稀释后的基因组 DNA 为模板,根据测序区域的选择,使用带 Barcode 的特异引物进行PCR扩增。 每一个25 μL的扩增体系包括1×PCR buffer、1.5 mmol/L MgCl2、0.4 μmol/L dNTPs、正向和反向引物各1.0 μmol/L、0.5 U KOD-Plus-Neo酶(TOYOBO)和10 ng模板。 PCR程序包括起始 94 ℃ 1 min,然后30个循环(变性 94 ℃ 20 s,退火 54 ℃ 30 s 和延伸72 ℃ 30 s),最后 72 ℃ 5 min。每个样本进行3个PCR技术重复。PCR 1/6体积的 6× loading buffer 混合,使用2%琼脂糖凝胶电泳检测。取目的条带用来回收,回收使用 QIAquick Gel Extraction Kit(QIAGEN)。使用Qubit 2.0 Fluorometer (Thermo Scientific)定量,最后等摩尔量混合。根据 PCR 扩增图谱,扩增后的条带比较清晰明显且条带位置一致,背景干净,DNA浓度达到了扩增要求。建库使用 TruSeq DNA PCR-Free Sample Prep Kit,构建好的文库经过定量和文库检测合格后,使用HiSeq 2500平台PE250模式测序。
1.4 数据分析
使用FLASH[7]拼接双端序列。基于Barcode从reads中拆分出各样品序列。截去Barcode序列得到原始数据,然后使用Trimmomatic[8]进行质控。嵌合体去除使用Uchime算法[9],得到有效数据Clean Reads。基于Usearch 软件,使用UPARSE 算法[10]在97%的一致性水平上进行OTU聚类,挑选每个OTU中出现频数最高的序列作为OTU的代表序列。利用UCLUST分类法[11]和SILVA数据库[12]进行注释分析,对各样本做均一化处理,以样品中数据量最少的为标准进行重抽样。使用R语言[13]进行群落组成分析、Alpha多样性分析、Beta分析、相关性分析等,使用ggplot2作图。
2 结果与分析
2.1 散装芽菜中细菌群落α-多样性分析
Alpha指数用来表征样本的物种丰富程度[14]。3种芽菜中细菌群落多样性和丰度见表1。ACE和Chao1指数常用来估算细菌菌落的丰富度,结果表明样本M2的细菌菌群丰度最低,而样本M1和M3中细菌菌群丰度相差较小。Shannon香衣指数和辛普森指数表示的是细菌菌群多样性,辛普森指数值越大,说明细菌菌落多样性越低,结果表明对比可得样本M2的细菌群落多样性最低。研究结果可知,不同芽菜间细菌群落的多样性和丰度存在差异,主要源于芽菜发酵环境的差异性。
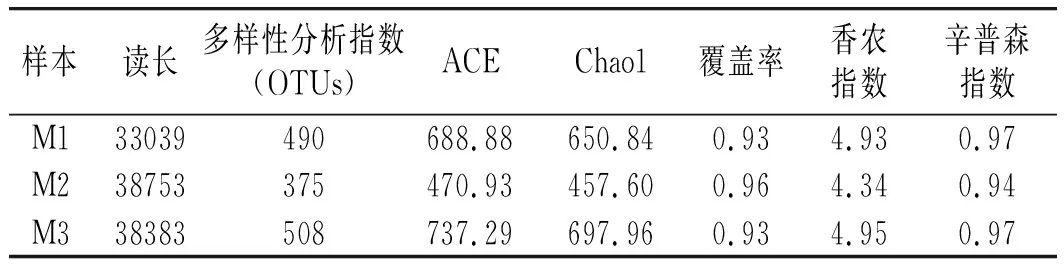
表1 3种散装芽菜中细菌群落丰度和多样性Table 1 Bacterial community abundance and diversity of three kinds of sprouts in bulk
2.2 细菌菌群韦恩图分析
对3种样品之间的OTU种类进行分析比较得到韦恩图见图1。样品M1、M2、M3一共得到791个OTUs,M1中有490个OTUs,M2中有375个OTUs,M3中有508个OTUs,其中共有的OTUs为176,表明3种不同品牌的散装芽菜之间细菌菌落结构差异较大。
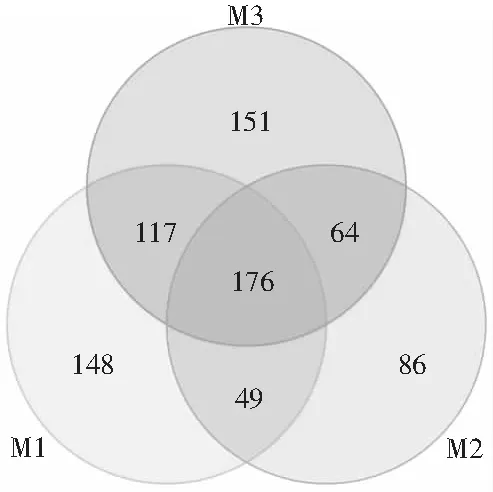
图1 3种散装芽菜的OTU韦恩图分析Fig.1 OTU Venn diagram analysis of three kinds of sprouts in bulk
2.3 细菌群落在门水平的结构分析
3种散装芽菜的细菌群落在门水平上的结构见图2。样本M1共检测出18个门,其中厚壁菌门(Firmicutes,44.93%)在细菌中占比最多,此外,拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和广古菌门(Euryarchaeota)在细菌中总占比为39.9%,样本M2共检测出14个门,丰度排名前三的是厚壁菌门(63.09%)、拟杆菌门(17.29%)和变形菌门(8.83%),样本M3共检测出19个门,优势菌门是厚壁菌门(Firmicutes)40.26%、拟杆菌门(Bacteroidetes)20.90%、广古菌门(Euryarchaeota)14.26%、变形菌门(Proteobacteria)8.24%。厚壁菌门是3种样品中的优势菌门,拟杆菌门次之。同时,M2中厚壁菌门的相对丰度远远高于其他两个样品。
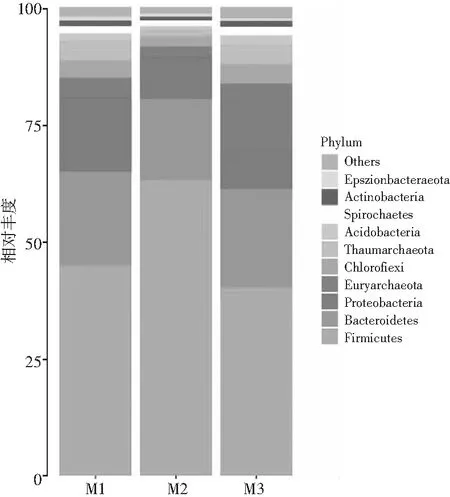
图2 3种散装芽菜的细菌群落在门水平的分布Fig.2 Distribution of bacterial communities in three kinds of sprouts in bulk at the phylum level
2.4 细菌群落在属水平的结构分布
从属的水平对3种散装芽菜的细菌群落结构进行分析,见图3。样本M1中丰度较高的菌属有乳酸杆菌属(Lactobacillusspp.,27.57%)、甲烷短杆菌属(Methanobrevibacterspp, 3.68%)、拟杆菌属(Bacteroidesspp.,2.92%)、明串珠菌属(Leuconostocspp.,2.74%)。样本M2中丰度较高的菌属有乳酸杆菌属(41.61%)、明串珠菌属(5.11%)、拟杆菌属(3.76%)。样本M3中丰度较高的菌属为乳酸杆菌属(25.64%)、甲烷短杆菌属(4.05%)、拟杆菌属(3.54%)、Lachnospiraceae NK4A136 group(2.77%)。结果表明,乳酸杆菌属是3种散装芽菜中的优势菌属,乳酸杆菌属具有嗜酸的特点,所以广泛存在发酵腌制的蔬菜中[15],并且能缩短发酵时间,提高产品的风味和营养价值。明串珠菌属也存在于3种散装芽菜中,有研究学者发现在芽菜自然发酵过程中,明串珠菌属在发酵初期是优势菌属[16],随着发酵时间的增加,其含量逐渐降低,乳杆菌属成为最优势菌属。魏斯氏菌属(Weissellaspp.)是参与食品发酵的重要微生物,在M1中占比1.20%,在M2中占比2.12%,在M3占比为0.26%,可以产生有机酸、酯类等,能赋予产品独特的风味,此外还可以提高发酵食品的安全性[17]。样本M3中存在的纳白菌属(Natrialbaspp.,1.97%)、盐球菌属(Halococcusspp.,1.93%)、盐红菌属(Halorubrumspp., 0.62%)和Halostagnicolaspp.(0.4%)是必须在高盐环境下生存的古菌[18],可能是因为样品M3的盐含量较高。值得注意的是,3种芽菜中也发现了致病腐败菌,样本M1中假单胞菌属(Pseudomonasspp.)含量较高,一般用来制作泡菜的新鲜蔬菜表面都附着假单胞菌属,有研究表明假单胞菌属可产生生物胺,还能还原硝酸盐产生亚硝酸盐等有害物质,影响发酵蔬菜的安全性[19]。其次发现了嗜冷杆菌属(Psychrobacterspp.),是一种典型的腐败菌属,在低温下能大量繁殖,导致食品腐败[20]。同时,3种芽菜中都检测出了肠杆菌属(Enterobacterspp.),肠杆菌属中细菌大部分属于致病菌,比如阴沟肠杆菌(Enterobactercloacae)、产气肠杆菌(Enterobacteraerogenes)、聚团肠杆菌(Enterobacteragglomerans)等,常在土壤、污水、腐烂蔬菜和乳制品中被发现,会危害人体健康。葡萄球菌属(Staphylococcusspp.)中的金黄色葡萄球菌(Staphylococcusaureus)会产生肠毒素,导致食品中毒[21]。样本M1中还检测出肠球菌属(Enterococcusspp.,0.04%),具有致病性,容易在年老及虚弱人群身上产生感染,导致败血症[22]。

图3 3种散装芽菜在属水平丰度热图Fig.3 Heat map of abundance of three kinds of sprouts in bulk at genus level
传统的制作芽菜工艺中,通过自然发酵的芽菜风味差、发酵周期长、微生物质量差,主要是因为发酵环境中优势菌属不明显,并且原辅料中附有的腐败致病菌会导致有害物质亚硝酸盐、生物胺的积累,影响产品的食用安全性。
2.5 PCA主成分分析
对3种芽菜中的细菌菌群进行PCA主成分分析,结果见图4。第一轴(PC1)和第二轴(PC2)的物种累计百分比方差分别为57%和43%,相加为100%。3种样本之间的距离较远,说明3种芽菜中的细菌菌群结构有较大的差异。

图4 PCA分析Fig.4 PCA analysis
3 结论
本研究通过高通量测序分析三种不同品牌的散装芽菜中细菌群落的结构差异。结果表明,样本M2中细菌菌群丰度最低,但是细菌菌群多样性最高。M1、M2、M3一共得到791个OTUs,其中共有的OTUs为176。从门水平上对3种芽菜中的细菌群落结构进行分析,发现3种样品中的优势菌门为厚壁菌门;从属水平上进行分析,乳酸杆菌属在3种芽菜中均为优势菌属,且M2中乳酸杆菌属的相对丰度远远高于其他两个样品。同时发现了一些腐败致病菌属,如假单胞菌属、嗜冷杆菌属、葡萄球菌属等。
芽菜中细菌群落结构的差异性可能是因为生产过程、原材料和保存环境的差异造成的。在3种芽菜中均发现了腐败致病菌属,结果表明在传统工艺下制作的芽菜的微生物安全较差,以期通过本文的研究为后续进一步提升产品质量和食用安全性奠定基础,从而保障消费者的权益。

