丹参酮ⅡA减轻棕榈酸诱导的心肌细胞凋亡及内质网应激
王亚丹, 艾景雪, 高瑞, 李运丽, 张海波
(河南大学第一附属医院心内三科,河南开封475000)
肥胖可造成系统性代谢紊乱,是循环系统疾病的重要危险因素[1]。富含高脂肪食物的饮食,尤其是饱和脂肪,会加重肥胖和脂毒性心肌病的风险[2],且脂质积累程度与心脏功能障碍有关[3]。如何干预脂毒性心肌病对心血管疾病的预防具有重要的研究意义。丹参为唇形科植物丹参Salvia miltiorrhizaBge.的干燥根及根茎,味苦、性微寒,入心、肝经,具有活血祛瘀、通经止痛、清心除烦、凉血消痈功效,是常用的改善心血管疾病的中药[4-5]。丹参酮ⅡA是从丹参中提取的天然活性成分。已有研究表明:丹参酮ⅡA对心肌组织的缺血-再灌注损伤具有显著的修复作用[6-7];丹参酮ⅡA预处理1周后的心肌缺血大鼠模型中,梗死面积明显减小[8];丹参酮ⅡA可防止缺氧诱导的H9c2心肌细胞线粒体功能障碍[9],可通过上调microRNA-133和激活蛋白激酶B(Akt)保护H9c2细胞免受氧化应激诱导的细胞死亡[10],也可通过磷酸腺苷活化蛋白激酶(AMPKs)/哺乳动物雷帕霉素靶蛋白(mTOR)依赖的自噬途径保护心肌梗死后心衰[11];丹参酮ⅡA可以通过减轻内质网应激抑制心肌细胞的凋亡[12-13]。鉴于丹参酮ⅡA具有较为明确的心肌保护作用,本研究进一步探讨丹参酮ⅡA对棕榈酸诱导的H9c2心肌细胞脂毒性损伤模型的保护作用及机制,现将研究结果报道如下。
1 材料与方法
1.1 细胞大鼠胚胎心肌细胞H9c2(CM-0089),购自武汉普诺赛生命科技有限公司。
1.2 药物、试剂与仪器丹参酮ⅡA(CAS:568-72-9,分子量:294.33)购自上海源叶生物科技有限公司,批号:B20257。棕榈酸购自上海源叶生物科技有限公司,批号:JS688093;细胞计数试剂盒8(CCK-8)、胰蛋白酶、膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)双染细胞凋亡检测试剂盒、10%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)试剂、聚偏氟乙烯(PVDF)膜、辣根过氧化物酶(HRP)标记的羊抗兔IgG、电化学发光(ECL)检测试剂盒(北京索莱宝科技有限公司);10 mg/mL RNaseA(上海翊圣生物科技有限公司);RNA纯化系统(Qiagen公司);SuperScript RNase H-逆转录酶(美国Invitrogen公司);随机六聚体(美国Sigma-Aldrich公司);SYBR Green Master Mix(美国Thermo Fisher公司);葡萄糖调节蛋白78(GRP78)、转 录 激 活因 子4(ATF4)、CCAAT/增强子结合蛋白同源蛋白(CHOP)、Caspase-3、Caspase-9、Caspase-12、蛋白激酶R样内质网激酶(PERK)、磷酸化PERK(p-PERK)、真核生物翻译起始因子2α(eIF2α)、磷酸化eIF2α(p-eIF2α)、甘油醛-3-磷酸脱氢酶(GAPDH)(美国CST公司)。Multiskan Sky酶标仪购自美国Thermo Fisher公司;FACSCalibur流式细胞仪购自美国Becton Dickinson公司;ABI Prism 7000 PCR系统购自Applied Biosystems公司;ChemiDoc XRS+高灵敏化学发光成像系统购自美国Bio-Rad公司。
1.3 CCK-8法测定细胞活力用胰酶消化对数期H9c2细胞后,收集并计数,重悬细胞并接种于96孔板,分6组。即:①对照组:不做任何处理;②棕榈酸(400 μmol/L)组:H9c2细胞培养24 h后,用400 μmol/L棕榈酸诱导细胞;③丹参酮ⅡA 20 μmol/L组:H9c2细胞培养24 h后,用20 μmol/L丹参酮ⅡA诱导细胞;④棕榈酸(400 μmol/L)+丹参酮ⅡA(5、10、20 μmol/L)3个浓度组:H9c2细胞培养24 h后,用400 μmol/L棕榈酸诱导细胞,24 h后,分别加入不同浓度(5、10、20 μmol/L)的丹参酮ⅡA处理细胞。按照CCK-8试剂盒的操作说明,在含对应药物的100 μL培养基中培养22 h,加入10 μL CCK-8继续培养2 h,用酶标仪检测每个孔在450 nm波长处的吸光度,然后检测各组的H9c2细胞存活率。每组设置3个复孔进行实验。
1.4 流式细胞术测定细胞凋亡情况分组同“1.3”项。用体积分数70%乙醇4℃过夜固定H9c2细胞,然后加入RNaseA和PI 4℃染色过夜,再按照Annexin V-FITC细胞凋亡检测试剂盒说明书的方法操作,最后应用流式细胞仪测定细胞凋亡率。AnnexinV-FITC(-)/PI(-)(左下)为正常细胞,AnnexinV-FITC(+)/PI(-)细胞(右下)为早期凋亡细胞,AnnexinV-FITC(+)/PI(+)(右上)为晚期凋亡细胞,AnnexinV(-)/PI(+)(左上)为坏死细胞。实验重复3次。
1.5 实时定量聚合酶链反应(RT-qPCR)法检测心肌细胞GRP78、ATF4、CHOP mRNA表达分组同“1.3”项。用RNA纯化系统提取总RNA。用SuperScript RNase H-逆转录酶和随机六聚体合成cDNA。在ABI Prism 7000系统中,使用SYBR Green Master Mix反应体系和引物在优化浓度下进行PCR反应。GRP78、ATF4、CHOP和管家基因GAPDH的序列如下:GRP78正向引物序列为5’-GAAACTGCCGAGGCGTAT-3’,反向引物序列为5’-ATGTTCTTCTCTCCCTCTCTCTTA-3’;ATF4正向引物序列为5’-TCCGAATGGCTGGCTGTGG-3’,反向引物序列为5’-AGTGTAGTCTGGCTTCCTATC TCC-3’;CHOP正向引物序列为5’-GGAAACAGA GTGGTCATTCCC-3’,反向引物序列为5’-CTGCT TGAGCCGTTCATTCTC-3’;GAPDH正向引物序列为5’-GGGTGTGAACCACGAGAAAT-3’,反向引物序列为5’-ACTGTGGTCATGAGCCCTTC-3’。反应条件:95℃5 min;95℃30 s,60℃30 s,重复40个循环。每个基因均生成标准曲线,扩增效率为90%~100%。通过阈值比较,确定基因表达的相对定量。结果以2ΔΔCt法计算。所有结果均以GAPDH为内参进行归一化。
1.6 蛋白免疫印迹(Western Blotting)法检测心肌细胞GRP78、ATF4、CHOP、Caspase-3、Caspase-9、Caspase-12、PERK、p-PERK、eIF2α、p-eIF2α蛋白表达分组同“1.3”项。收集细胞,与细胞裂解缓冲液、蛋白酶抑制剂、去磷酸化酶抑制剂在冰上混合20 min,收集裂解液,以4℃以13 000×g离心5 min,取上清。使用BCA蛋白定量试剂盒测量蛋白质的浓度。取30 μg蛋白,加热变性,经10%SDS-PAGE分离后转移到PVDF膜。使用体积分数2%牛血清白蛋白(BSA)室温封闭1 h。加入GRP78抗体4℃孵育过夜。加入羊抗兔IgG-HRP孵育1 h。最后,采用ECL化学发光检测试剂盒显色,用高灵敏化学发光检测仪观察电泳 条 带。ATF4、CHOP、Caspase-3、Caspase-9、Caspase-12、PERK、p-PERK、eIF2α、p-eIF2α、GAPDH检测方法同上。
1.7 统计方法采用SPSS 19.0统计软件进行数据分析,所有计量资料均以均数±标准差(±s)表示,以单因素方差分析(One-way ANOVA)方法进行多组比较,两两比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 丹参酮ⅡA逆转了棕榈酸诱导的H9c2细胞存活率的降低图1结果显示:与对照组比较,丹参酮ⅡA 20 μmol/L组的细胞存活率无显著性差异(P>0.05),而棕榈酸(400 μmol/L)组的细胞存活率显著降低(P<0.01);与棕榈酸(400 μmol/L)组比较,不同浓度丹参酮ⅡA(5、10、20 μmol/L)与棕榈酸共处理组的细胞存活率以剂量依赖性方式回升,且棕榈酸+丹参酮ⅡA 10 μmol/L组(P<0.05)和棕榈酸+丹参酮ⅡA 20 μmol/L组(P<0.01)细胞存活率回升有统计学意义。

图1 丹参酮ⅡA对棕榈酸诱导的H9c2细胞存活率的影响Figure 1 Effects of tanshinoneⅡA on survival rate ofpalmitic acid-induced H9c2 cells
2.2 丹参酮ⅡA缓解了棕榈酸诱导的H9c2细胞内质网应激图2-A结果显示:与对照组比较,丹参酮ⅡA 20 μmol/L组细胞的GRP78、ATF4和CHOP的mRNA水平无显著性差异(P>0.05),而棕榈酸(400 μmol/L)组细胞的GRP78、ATF4和CHOP的mRNA水平显著升高(P<0.01);与棕榈酸(400 μmol/L)组比较,不同浓度丹参酮ⅡA(5、10、20 μmol/L)与棕榈酸共处理组细胞的GRP78、ATF4和CHOP的mRNA水平以剂量依赖性方式回降,且棕榈酸+丹参酮ⅡA 10 μmol/L组(P<0.05)和棕榈酸+丹参酮ⅡA 20 μmol/L组(P<0.01)细胞的GRP78、ATF4和CHOP的mRNA水平回降显著。
图2 -B结果显示:与对照组比较,丹参酮ⅡA 20 μmol/L组细胞的GRP78、ATF4和CHOP的蛋白水平无显著性差异(P>0.05),而棕榈酸(400 μmol/L)组细胞的GRP78、ATF4和CHOP的蛋白水平升高显著(P<0.01);与棕榈酸(400 μmol/L)组比较,不同浓度丹参酮ⅡA(5、10、20 μmol/L)与棕榈酸共处理组细胞的GRP78、ATF4和CHOP的蛋白水平以剂量依赖性方式回降,且棕榈酸+丹参酮ⅡA 10 μmol/L组(P<0.05)和棕榈酸+丹参酮ⅡA 20 μmol/L组(P<0.01)细胞的GRP78、ATF4和CHOP的蛋白水平回降显著。

图2 丹参酮ⅡA对棕榈酸诱导的H9c2细胞内质网应激的影响Figure 2 Effects of tanshinoneⅡA on endoplasmic reticulum stress in palmitic acid-induced H9c2 cells
2.3 丹参酮ⅡA抑制了棕榈酸诱导的心肌细胞的凋亡图3-A结果显示:与对照组比较,丹参酮ⅡA 20 μmol/L组细胞的凋亡率无显著性差异(P>0.05),而棕榈酸(400 μmol/L)组细胞凋亡率显著升高(P<0.01);与棕榈酸(400 μmol/L)组比较,不同浓度丹参酮ⅡA(5、10、20 μmol/L)与棕榈酸共处理组细胞的凋亡率以剂量依赖性方式回降,且棕榈酸+丹参酮ⅡA 10 μmol/L组(P<0.05)和棕榈酸+丹参酮ⅡA 20 μmol/L组(P<0.01)细胞的凋亡率回降显著。
图3 -B结果显示:与对照组比较,丹参酮ⅡA 20 μmol/L组 细 胞 的Caspase-3、Caspase-9和Caspase-12的蛋白表达水平无显著性差异(P>0.05),而棕榈酸(400 μmol/L)组的这3种蛋白表达水平显著升高(P<0.01);与棕榈酸(400 μmol/L)组比较,不同浓度丹参酮ⅡA(5、10、20 μmol/L)与棕榈酸共处理组细胞的Caspase-3、Caspase-9和Caspase-12蛋白表达水平以剂量依赖性方式回降,且棕榈酸+丹参酮ⅡA 10 μmol/L组(P<0.05)和棕榈酸+丹参酮ⅡA 20 μmol/L组(P<0.01)细胞的凋亡率回降显著。

图3 丹参酮ⅡA对棕榈酸诱导的H9c2细胞凋亡的影响Figure 3 Effects of tanshinoneⅡA on apoptosis of palmitic acid-induced H9c2 cells
2.4 丹参酮ⅡA阻碍了棕榈酸诱导的H9c2细胞PERK信号通路的磷酸化图4结果显示:与对照组比较,丹参酮ⅡA 20 μmol/L组细胞的p-PERK/PERK和p-eIF2α/eIF2α比例无显著性变化(P>0.05),而棕榈酸(400 μmol/L)组细胞p-PERK/PERK和peIF2α/eIF2α比例显著增大(P<0.01);与棕榈酸(400 μmol/L)比较,不同浓度丹参酮ⅡA(5、10、20 μmol/L)与棕榈酸共处理组细胞p-PERK/PERK和p-eIF2α/eIF2αs比例以剂量依赖性方式回降,且棕榈酸+丹参酮ⅡA 10 μmol/L组(P<0.05)和棕榈酸+丹参酮ⅡA 20 μmol/L组(P<0.01)细胞p-PERK/PERK和p-eIF2α/eIF2α比例回降显著。
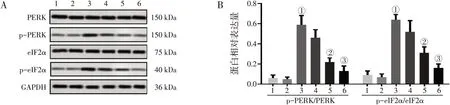
图4 丹参酮ⅡA对棕榈酸诱导的H9c2细胞PERK信号通路磷酸化的影响Figure 4 Effects of tanshinoneⅡA on phosphorylation of PERK signaling pathway in palmitic acid-induced H9c2 cells
2.5 丹参酮ⅡA通过调节PERK信号通路缓解棕榈酸诱导的心肌细胞凋亡和内质网应激为了进一步验证丹参酮ⅡA对PERK信号通路的影响,本研究引入PERK通路激活剂CCT020312进行实验,增加棕榈酸(400 μmol/L)+CCT020312(3 μmol/L)组与棕榈酸(400 μmol/L)+CCT020312(3 μmol/L)+丹参酮ⅡA(20 μmol/L)组。图5-A结果显示:与对照组比较,棕榈酸组细胞的p-PERK/PERK和p-eIF2α/eIF2α比例显著增大(P<0.01);与棕榈酸组比较,棕榈酸+丹参酮ⅡA 20 μmol/L组细胞的p-PERK/PERK和p-eIF2α/eIF2α比 例 显 著 减 小(P<0.01),而棕榈酸+CCT020312组细胞的p-PERK/PERK和p-eIF2α/eIF2α比 例 显 著 回 升(P<0.05);与棕榈酸+CCT020312组和棕榈酸+丹参酮ⅡA组比较,棕榈酸+CCT020312+丹参酮ⅡA组的p-PERK/PERK和p-eIF2α/eIF2α比例显著回降(P<0.05)。同样,我们也考察了细胞凋亡率(图5-B)和内质网应激相关的GRP78、ATF4和CHOP的mRNA表达水平(图5-C),得到了与上述信号通路结果相一致的结果。这些实验进一步证实了丹参酮ⅡA通过调节PERK信号通路缓解棕榈酸诱导的心肌细胞凋亡和内质网应激。
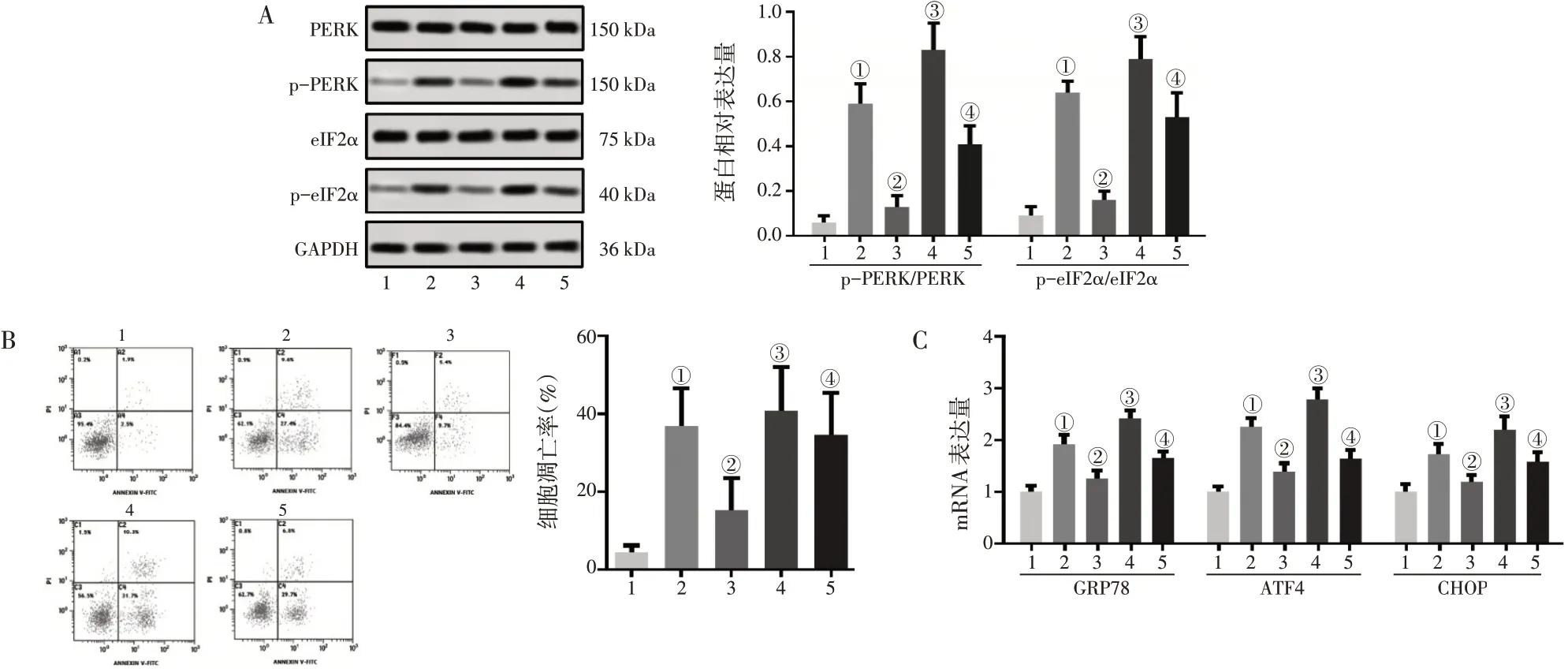
图5 丹参酮ⅡA通过调节PERK信号通路对棕榈酸诱导的H9c2细胞凋亡和内质网应激的影响Figure 5 Effects of tanshinoneⅡA on apoptosis and endoplasmic reticulum stress in palmitic acid-induced H9c2 cells by modulating the PERK signaling pathway
3 讨论
肥胖是包括代谢综合征和心肌病等在内一系列疾病的危险因素,其脂毒性是一个重要方面[14]。肥胖和脂质积累会加快心血管系统的非脂肪细胞中过多脂质的积累,导致细胞功能障碍和细胞死亡,造成脂毒性心肌病[14]。棕榈酸是最常见的饱和长链脂肪酸,在包括心肌细胞在内的许多细胞类型中都能触发细胞凋亡[15]。故本研究选择棕榈酸400 μmol/L刺激H9c2心肌细胞构建心肌细胞脂毒性损伤模型。在此细胞模型上,流式细胞术检测发现,与对照组比较,棕榈酸400 μmol/L组心肌细胞存活率、凋亡率明显升高(P<0.01),说明在体外环境中棕榈酸可通过诱导心肌细胞凋亡而发挥脂毒性作用。
内质网是脂代谢密切相关的细胞器[16]。内质网稳态的破坏使大量错误或者未折叠蛋白质在内质网中聚集,激活相应的信号通路,引起一系列的细胞反应,即内质网应激。一方面,内质网应激通过调节参与脂质合成或修饰关键酶的表达水平来影响脂质代谢;另一方面,内质网应激诱导的细胞凋亡或细胞膜组件的异常合成可介导心肌细胞脂毒性损伤。有研究发现,以棕榈酸为代表的心肌脂毒性诱导过程中,发生的内质网应激激活了葡萄糖调节蛋白78(GRP78)、真核生物翻译起始 因 子2α(eIF2α)、蛋 白 激 酶R样 内 质 网 激酶(PERK)、CCAAT/增强子结合蛋白同源蛋白(CHOP)和Caspase蛋白等相关凋亡通路[2]。由此推测,内质网应激信号通路的激活及其相关蛋白的表达调控可能是心肌细胞脂毒性损伤的机制之一,减轻心肌细胞内质网应激有望延缓脂毒性心肌病的发生发展。本研究结果显示,与对照组比较,棕榈酸组细胞内质网应激相关蛋白GRP78、ATF4、CHOP mRNA和蛋白表达水平显著升高(P<0.01),p-PERK/PERK和p-eIF2α/eIF2α比例也显著增大(P<0.01),凋亡相关蛋白Caspase-3、Caspase-9和Caspase-12蛋白表达水平显著升高(P<0.01)。不同浓度丹参酮ⅡA作用后,H9c2细胞的存活率升高,H9c2细胞的凋亡率降低,内质网应激凋亡相关蛋白的表达水平降低(均P<0.01)。加 入PERK通 路激 活剂CCT020312作 用后,与棕榈酸组比较,棕榈酸+CCT020312组的p-PERK/PERK和p-eIF2α/eIF2α比例,细胞凋亡率,GRP78、ATF4、CHOP的mRNA和蛋白表达水平均显著升高(P<0.05);再经过丹参酮ⅡA处理,与棕榈酸+CCT020312组比较,棕榈酸+CCT020312+丹参酮ⅡA组的p-PERK/PERK和p-eIF2α/eIF2α比例,细胞凋亡率,GRP78、ATF4、CHOP的mRNA和蛋白表达水平均显著回降(P<0.05)。提示丹参酮ⅡA通过抑制内质网应激通路蛋白PERK和eIF2α的磷酸化下调了棕榈酸诱导的H9c2细胞内质网应激相关蛋白CRP78、ATF4和CHOP的表达,起到抑制棕榈酸诱导的H9c2细胞凋亡的作用。结果表明,丹参酮ⅡA可修复棕榈酸刺激的心肌细胞损伤,其作用机制与减轻棕榈酸引起的内质网应激性凋亡有关。
综上所述,本课题体外研究结果证明了棕榈酸能启动内质网应激,激活PERK信号通路,诱导心肌细胞凋亡,引起心肌细胞脂毒性损伤,而丹参酮ⅡA可阻断该通路,抑制心肌细胞脂毒性损伤。本研究初步通过体外实验探讨了丹参酮ⅡA抗心肌细胞脂毒性作用,为今后在体内和动物实验环境中研究丹参酮ⅡA对脂毒性心肌病的干预机制提供了可靠的实验依据。
——疾病防治的新靶标

