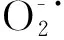Leukamenin E诱导人宫颈癌HeLa细胞胞质骨架重排和迁移抑制的研究
杜世龙,宁秀梅,何 苗,李翡翡,张 会,丁 兰
西北师范大学生命科学学院,兰州 730070
真核细胞内的微丝、微管和中间纤维通过与其结合蛋白相互连接,形成了高度有序的三维网络状的胞质骨架系统,它们参与细胞内物质运输、信息传递、细胞分裂、细胞迁移以及细胞形态维持等关键性细胞生命过程。细胞骨架的动力学过程受到高度调控以服务于细胞生命活动的需求,其组装失调将导致细胞生长抑制,细胞分裂停滞,甚至细胞凋亡发生[1]。一些抗肿瘤药物可通过改变细胞骨架的解聚和聚合作用,破坏微管的动态平衡,进而抑制细胞增殖,发挥抗肿瘤作用。植物源性抗癌药物长春花生物碱和紫杉烷类药物可与β-tubulin结合,干扰微管骨架的动力学过程,用于治疗多种肿瘤,包括乳腺癌、肺癌、神经母细胞瘤、横纹肌肉瘤、急性白血病等[2]。以细胞骨架及其相关蛋白为靶点的抗肿瘤药物的研究与发现已成为非常活跃的前沿研究领域[1]。
活性氧(reactive oxygen species,ROS)作为细胞内的信号分子,参与细胞增殖和分化等重大细胞生命过程[3]。在肿瘤细胞中由于代谢通路发生改变,ROS的含量增多,特别是H2O2显著增加,使肿瘤细胞对ROS水平的变化更为敏感,因而ROS生成和抗氧化防御对细胞内组分的特定修饰被确定为癌症治疗的靶点[4]。研究显示,由NADPH氧化酶和其他来源产生的ROS可直接修饰微丝、微管和中间丝蛋白而对其组装-解组装的动态过程产生影响[5],或通过相关信号通路活化细胞骨架上游Rho GTP酶而重塑细胞骨架[6]。NADPH氧化酶介导的胞内氧化应激还对细胞骨架相关疾病有重要的调节作用[6]。近年来,研究者对ROS参与细胞骨架动力学调节产生了广泛兴趣。
香茶菜属植物在我国分布90余种,供药用的约有30余种,其中冬凌草(Isodonrubescens)曾被收入《中国药典》,主要用于抗菌消炎及抗肿瘤等疾病的治疗[7]。冬凌草素(oridonin)作为冬凌草的主要活性成分,其抗癌机制已有较深入研究,它的结构修饰物已作为抗白血病药物进入一期临床试验[8]。现已发现对映-贝壳杉烷二萜约1 300余种,在香茶菜属植物的枝叶中含量尤为丰富,该类化合物显示了广泛的抗癌活性,有望从中发现新的抗癌药物[8]。目前仅有冬凌草素等极少数的对映-贝壳杉烷二萜的抗癌机制有较深入系统的研究,其他该类二萜的相关研究还很欠缺,但近年来也取得了一些重要进展。近年来,发现某些对映-贝壳杉烷二萜可作用于细胞骨架系统而发挥抗癌活性。例如,pharicin A直接靶向BubR1蛋白而激活纺锤体组装检查点,阻止细胞中期向后期转换,抑制白血病细胞Raji和Jurkat的有丝分裂期[9];wangzaozin A和epinodosin分别引起HeLa细胞和HL-60细胞骨架(微丝、微管和中间丝)重排[10,11],与其诱导细胞分化相关联;leukamenin E还能诱导HUVECs和PLC细胞的角蛋白磷酸化进而阻滞角蛋白纤维网络正常组装[12,13]。本文继续报道leukamenin E对HeLa细胞的3种骨架纤维(微丝、微管及角蛋白纤维)重排的影响以及所导致的细胞生长和迁移抑制的可能机制,为阐明对映-贝壳杉烷二萜类化合物的抗癌分子机制提供线索,也为该化合物的进一步开发应用提供科学依据。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂与受试化合物
DMEM培养基、MTT、吉姆萨染色剂、碘化丙啶(propidium iodide,PI)及TRITC Phalloidin(Sigma公司);Pan-Keratin Mouse mAb、α-tubulin Mouse mAb(Cell Signaling Technology公司);Goat anti-mouse IgG-FITC(Santa Cruz公司);胰蛋白酶(trypsin,中国生工生物公司);RNase A(Solarbio);新生小牛血清(中国杭州四季青生物技术有限公司);荧光探针DCFH-DA(2,7-dichlorfluorescein-diacetate)、抗氧化剂NAC(N-acetyl-L-cysteine)(江苏碧云天生物技术研究所),其他试剂均为国产分析纯。
对映-贝壳杉烷型二萜leukamenin E由本实验室从甘肃产总序香茶菜(Isodonracemosa(Hemsl) Hara)中分离得到,采用紫外,红外,质谱,核磁共振等波谱学方法对其结构进行了鉴定[14]。用DMSO溶解leukamenin E(纯度大于99.5%),配制成10 mmol/L的母液于4 ℃储存备用。本实验体系中助溶剂DMSO终浓度小于0.01%,对细胞的生长无影响。Leukamenin E的分子结构如图1。
图1 Leukamenin E的化学结构Fig.1 Chemical structure of leukamenin E
1.1.2 实验仪器
CO2培养箱(Forma Scientific,美国),超净工作台(苏净集团,江苏),倒置显微镜(Olympus CKX41SF,日本),正置荧光显微镜(Leica DMI4000B,德国),高速低温离心机(Beckman Coulter Allegra64R,美国),流式细胞仪(Beckman Coulter Cell Lab Quanta SC Flow Cytometer,美国)。
1.2 实验方法
1.2.1 细胞培养
人宫颈癌细胞株HeLa购自中科院上海典藏细胞库。细胞培养于含10%小牛血清、100 U/mL青霉素和100 μg/mL链霉素的DMEM 培养基中,置于37 °C、5% CO2及饱和湿度的恒温培养箱中培养。
1.2.2 MTT法检测leukamenin E对HeLa细胞生长的影响
取对数生长期的HeLa细胞,以5 × 104个/mL的密度接种于96孔板,贴壁培养24 h后,加入含有不同浓度leukamenin E的培养基,继续培养24或48 h后每孔加入20 μL MTT(5 mg/mL),孵育4 h后弃去培养基,加入150 μL DMSO,震荡10 min,490 nm处测量OD值。
1.2.3 平板集落形成法检测leukamenin E对HeLa细胞集落形成的影响
取对数生长期的HeLa细胞,以100个/孔的密度接种于24孔培养板中,24 h后加入与“1.2.2”相同的受试药物浓度,培养7天后用甲醇固定,吉姆萨染色,在显微镜下记录每孔的细胞集落数(≥ 50个细胞为一个集落)。
1.2.4 流式细胞术检测leukamenin E对HeLa细胞周期的影响
细胞接种及药物的加入与“1.2.2”所述相同。当细胞培养48、72 h后收集细胞;预冷的PBS(pH7.4)洗2次,离心,弃上清。加入预冷的70%乙醇,4 ℃ 固定过夜,1 200 rpm离心5 min,弃固定液后用PBS洗2次,加入RNase A(终浓度100 μg/mL),37 ℃ 孵育30 min后,再加入PI(终浓度40 μg/mL)避光孵育30 min后,260目尼龙网过滤,上机检测。
1.2.5 吉姆萨染色观察leukamenin E对HeLa细胞及细胞核形态的影响
细胞接种密度与药物的处理见“1.2.2”。在细胞培养48 h和72 h后于倒置显微镜下观察细胞形态并拍照,且对细胞伪足进行定量分析[15]。在细胞培养48、72 h后,取出细胞爬片,PBS 洗2次,用甲醇-冰乙酸(3∶1)固定30 min,晾干后用吉姆萨染液染色20 min,用蒸馏水冲洗干净,于显微镜下观察细胞核形态并拍照。
1.2.6 划痕法检测leukamenin E对HeLa细胞迁移的影响
取对数生长期的HeLa细胞,以5 × 104个/mL密度接种于24孔板,待细胞培养24 h后,加入丝裂霉素(终浓度5 μg/mL)处理2 h,用灭菌的10 μL枪头在每孔底部中间划一窄线,用培养基洗去漂浮细胞,加入不同浓度的药物。药物处理24、48 h后置细胞培养板于倒置显微镜下观察拍照。
1.2.7 TRITC Phalloidin检测leukamenin E对HeLa细胞微丝的影响
细胞接种及药物的加入与“1.2.2”所述相同。待细胞培养48、72 h后取出细胞爬片,用PBS(pH7.4)洗3次/5 min,加入4%甲醛室温下固定15 min,洗去固定液,PBS(pH7.4)洗3次/5 min;避光加入TRITC Phalloidin,置于湿盒内37 ℃ 孵育1 h后用PBS(pH7.4)洗3次,封片,荧光显微镜下观察并拍照。
1.2.8 间接免疫荧光技术检测leukamenin E对HeLa细胞微管的影响
细胞接种、药物浓度、细胞爬片及固定与“1.2.2”所述相同。细胞固定后于室温下透化15 min(PBS含0.3% Triton X-100);吸去透化剂,加一抗置于37 ℃ 孵育1 h;PBS(pH7.4)洗3次后加二抗避光孵育2 h;用PBS洗3次后封片,在荧光显微镜下用同样的拍摄参数进行观察、拍照。
1.2.9 间接免疫荧光技术检测leukamenin E对HeLa细胞角蛋白纤维的影响
细胞接种及药物的加入与“1.2.2”所述相同。药物处理48、72 h后,取出细胞爬片,PBS(pH8.0)洗3次/5 min;用预冷的甲醇在-20 ℃固定5 min后用PBS(pH8.0)洗3次/5 min;室温下封闭1 h(封闭缓冲液:5%山羊血清,0.3% Triton X-100的PBS液)后,加一抗置于4 °C 冰箱孵育过夜;PBS(pH8.0)洗3次后加二抗避光孵育2 h,最后PBS(pH8.0)洗3次后封片,在荧光显微镜下用同样的拍摄参数进行观察、拍照。
按照上述相同的细胞接种浓度,用吉姆萨染色、划痕法和免疫荧光技术分别测定了300 μmol/L NAC单独或联合1.0 μmol/L leukamenin E对HeLa细胞形态、细胞迁移以及3种细胞骨架纤维(微管、微丝和角蛋白纤维)重排的影响。
1.2.10 流式细胞术检测leukamenin E对HeLa细胞聚合态纤维骨架含量的影响
细胞接种及药物的加入与“1.2.2”所述相同。待细胞培养48 h后,消化,用1 200 rpm离心5 min收集细胞,之后对细胞的处理方法同“1.2.7”“1.2.8”和“1.2.9”。PBS每次清洗后用1 200 rpm离心5 min收集细胞。260目尼龙网过滤,上机检测。
1.2.11 流式细胞术检测leukamenin E对HeLa细胞内ROS水平的影响
取对数生长期的HeLa细胞,以1 × 104个/mL密度接种于6孔板,不同药物处理后离心收集各组细胞,PBS清洗后加入DCFH-DA荧光探针染色,收集细胞,PBS清洗去除未进入细胞内的DCFH-DA,上机检测。
1.2.12 统计学分析
每组处理组随机取50个细胞,采用Image Pro Plus 6.0软件分析平均荧光强度。细胞迁移距离采用Image J 1.52a软件测量分析。柱形图和折线图使用Origin 2018软件制作。实验数据以mean±SD表示(n=3),显著性差异分析用SPSS 23.0软件。P< 0.05为差异显著,P< 0.01为差异极显著。
2 实验结果
2.1 Leukamenin E导致HeLa细胞的周期阻滞及细胞的增殖抑制
不同浓度的leukamenin E处理HeLa细胞24、48 h后,用MTT法检测细胞活力(见图2A)。如图2A所示,与对照相比,0.4 μmol/L leukamenin E对HeLa细胞的增殖无明显影响,而0.6~1.0 μmol/L leukamenin E显示了显著的抑制效应,其最高抑制率为20%(1.0 μmol/L, 48 h)。同样,leukamenin E对HeLa细胞的集落形成能力也有显著的抑制作用。如图2B所示,对照组的细胞集落形成数目最多(63.2±3.3),随着药物浓度的依次升高,HeLa细胞的集落形成能力明显下降,各处理组与对照组相比均具有显著差异。
进一步用流式细胞术检测了0.4~1.0 μmol/L leukamenin E对HeLa细胞周期的影响。如图2C所示,leukamenin E导致明显的G1期阻滞。48 h对照组G1期细胞比率为46.9%,0.4、0.6、0.8和1.0 μmol/L处理组G1期细胞比率分别为51.7%、55.5%、57.5%和60.1%,分别增加了4.8%、8.6%、11%和13.3%;同时,各处理组的G2期细胞比率也有所增加,而S期细胞数出现下降,在1.0 μmol/L时下降了17.9%(见图2C)。72 h处理组显示了与48 h处理组相似的G1期阻滞效应:与对照组相比,72 h药物处理组G1期细胞分别增加了4.9%、6.3%、10.3%和11.8%。同时S期细胞比率也出现下降,但G2期细胞变化不大(见图2D)。
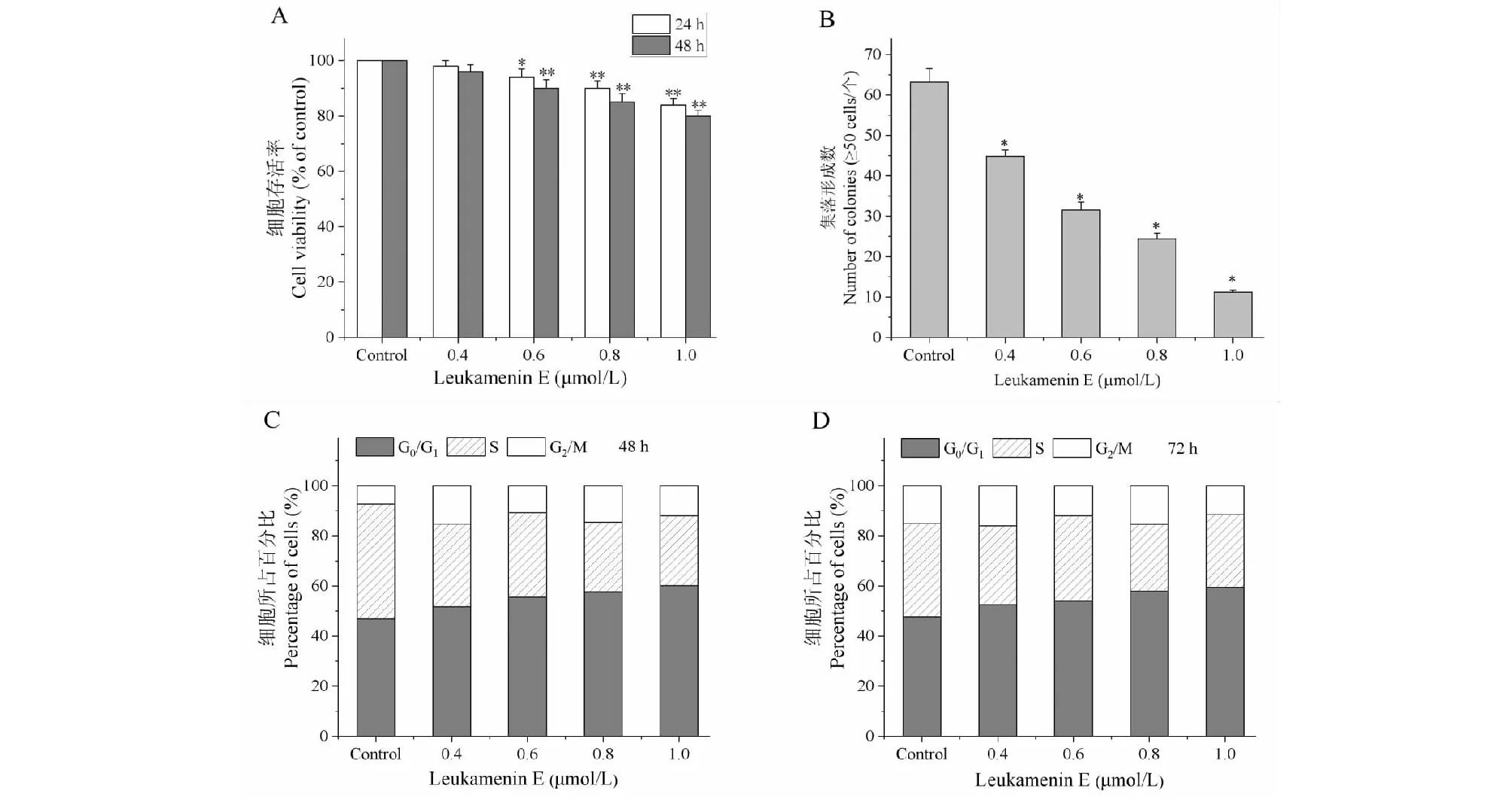
图2 Leukamenin E对HeLa细胞增殖和细胞周期的影响Fig.2 Effects of leukamenin E on HeLa cells proliferation and cell cycle注:A:Leukamenin E对HeLa细胞的增殖抑制效应;B:Leukamenin E抑制HeLa细胞集落形成能力,与对照组比较,*P < 0.05,**P < 0.01;C、D:48 h和72 h时leukamenin E对HeLa细胞周期的影响。Note:A:Leukamenin E inhibits proliferation of HeLa cells;B:Leukamenin E inhibits the colony forming ability of HeLa cells,compared with control,*P < 0.05,**P < 0.01;C and D:Graph depicts the effects of leukameninE on HeLa cell cycle at 48 h and 72 h.
上述结果表明0.6~1.0 μmol/L leukamenin E通过对HeLa细胞的G1期阻滞而抑制其增殖。
2.2 Leukamenin E诱导HeLa细胞及细胞核形态的改变
不同浓度leukamenin E处理HeLa细胞48 h和72 h后的细胞形态如图3A所示,对照组细胞形态呈不规则多边形,处理组的细胞的整体形态呈现两极伸长,向长条形变化的趋势;细胞伪足呈现减少趋势,较高浓度处理组(0.6~1.0 μmol/L)显示了显著或极显著差异(见图3C、D)。处理组中某些细胞两端的伪足拉伸延长呈细丝状,尤其在高浓度和长时间处理组中,这类细胞明显增多,还观察到长丝状伪足交织成网状的现象。
进一步通过吉姆萨染色观察细胞核形态的变化。从图3B可以看出,对照组的细胞核体积较大,呈圆形或卵圆形,有多个核仁,核浆比值大;当不同浓度药物处理48 h后,核体积变小,核浆比值下降,核形态改变成为“肾形”的细胞比率增多,并发现在“肾形核”凹处其细胞质着色较浅,呈小空泡样结构;当药物处理72 h后,核体积和核浆比值进一步下降,但“肾形核”比率与48 h处理组相比却有所减少,多数细胞核呈较小的椭圆形。核体积和核浆比值下降表明细胞代谢活动有所下降,而“肾形核”增多提示细胞骨架尤其是微管骨架可能有显著重排。
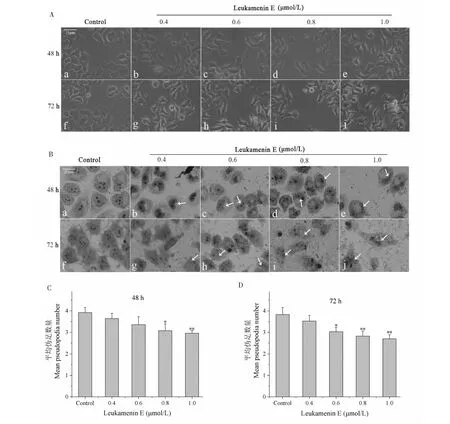
图3 Leukamenin E对HeLa细胞形态及核形态的影响Fig.3 Effects of leukamenin E on HeLa cells morphology and nuclear morphology注:A:48 h和72 h倒置显微镜下细胞形态的变化;B:48 h和72 h细胞核形态的变化;C、D:Leukamenin E处理48 h和72 h后HeLa细胞伪足数的定量分析,与对照组比较,*P < 0.05,**P < 0.01。图中箭头指示细胞核为“肾形核”的细胞。Note:A:Changes of cell morphology under the inverted microscope at 48 h and 72 h;B:Changes in nuclear morphology at 48 h and 72 h;C and D:Quantitative analysis of the pseudopodia number of HeLa cells treated with leukamenin E at 48 h and 72 h,compared with the control group,*P < 0.05,**P < 0.01.The arrow in the figure indicates a cell with a "kidney-shaped nucleus".
2.3 Leukamenin E抑制HeLa细胞的迁移
划痕实验检测leukamenin E对HeLa细胞迁移的变化结果如图4所示。在24 h处理组中对照组细胞迁移明显,其划痕愈合率为51%±2.0%,而0.6、0.8和1.0 μmol/L药物处理组的划痕愈合率分别为43.5%±4.0%、31.4%±3.0%和23.7%±3.0%(图4B),表明leukamenin E对细胞的迁移有明显的抑制效应;48 h后对照组大部分细胞已迁移靠近划痕中线,其划痕愈合率为62.7%±5.0%,而0.6、0.8和1.0 μmol/L处理组细胞的迁移受到明显的抑制,其划痕愈合率分别为51.0%±2.0%、36.9%±3.0%和29.4%±2.0%(见图4C)。
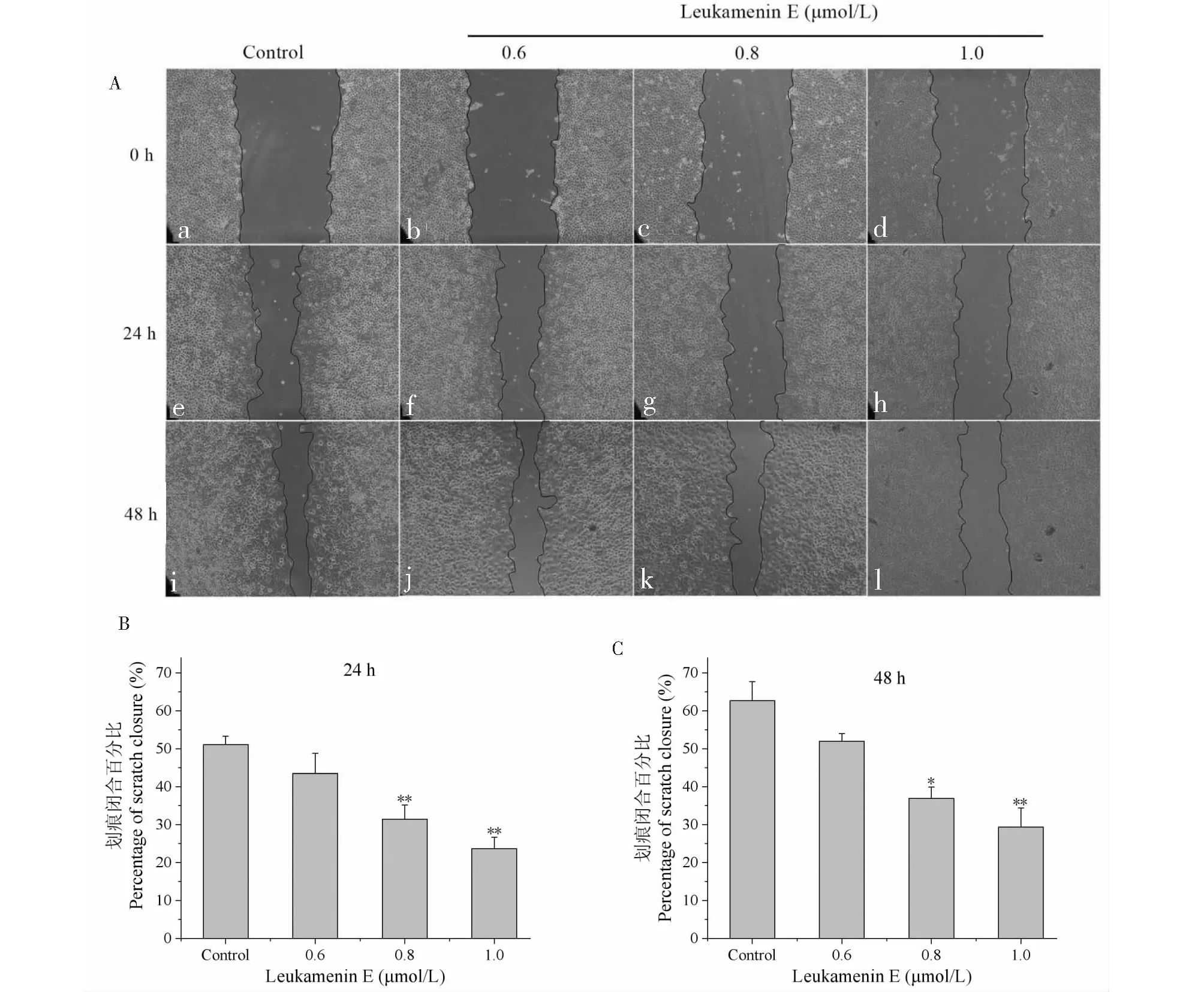
图4 Leukamenin E对HeLa细胞迁移的影响Fig.4 Effects of leukamenin E on HeLa cells migration注:A:不同浓度的leukamenin E对HeLa细胞迁移的抑制作用;B、C:不同浓度的leukamenin E处理24 h和48 h后HeLa细胞的划痕闭合率,与对照组比较,*P < 0.05,**P < 0.01。Note:A:Inhibition of leukamenin E on HeLa cell migration at the indicated concentrations;B and C:Scratch closure rate of HeLa cells treated with the indicated concentrations of leukamenin E for 24 h and 48 h,compared with the control group,*P < 0.05,**P < 0.01.
2.4 Leukamenin E诱导HeLa细胞的微丝、微管及角蛋白纤维的重排
分别用0.4、0.6、0.8、1.0 μmol/L的leukamenin E处理HeLa细胞48 h、72 h,通过TRITC Phalloidin染色微丝或者免疫荧光染色微管和角蛋白纤维后观察其变化,结果如图5所示。从图5A可以看出,对照组细胞胞质中可见清晰的平行束状应力纤维(微丝),贯穿于整个细胞胞质,数量较多。0.4 μmol/L的leukamenin E对HeLa细胞中应力纤维的影响与对照组相比没有显著变化,而0.6~1.0 μmol/L的leukamenin E显著减少胞质中的应力纤维数量,并显示了浓度依赖性(见图5A、B)。另外,表示胞质中微丝含量的细胞的平均荧光强度也随leukamenin E的浓度增加而降低,较高浓度处理组细胞显示了显著性或极显著差异(图5D),表明leukamenin E本文实验条件下可减少微丝数量,主要减少应力纤维的数量。
利用间接免疫荧光技术对微管染色,结果如图5A所示。对照组细胞中的微管网络在胞质中呈致密的均匀分布;0.4 μmol/L处理组细胞的微管网络与对照组细胞相比没有发生明显变化,而在0.6、0.8和1.0 μmol/L药物处理组细胞中的微管分布有明显改变:核周出呈现较强的荧光斑,表明微管在此有聚集,且随着处理药物浓度的升高和时间的延长,这种现象更为明显。经Image Pro Plus 6.0软件分析显示,处理组细胞中微管的平均荧光强度与对照组细胞相比显著增加(见图5E),表明leukamenin E可增加HeLa细胞微管数量,主要刺激核周区域微管的聚集。
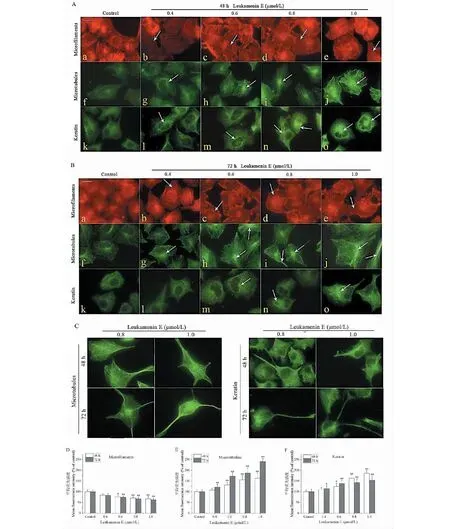
图5 Leukamenin E对HeLa细胞3种细胞质骨架分布的影响Fig.5 Effects of leukamenin E on the distribution of three cytoskeleton in HeLa cells注:A:48 h处理组细胞内微管、微丝和角蛋白纤维的荧光显微镜图像;B:72 h处理组细胞内微管、微丝和角蛋白纤维的荧光显微镜图像;C:具有长丝状伪足细胞的微管和角蛋白纤维的荧光显微镜图像;D~F:不同处理组细胞的微丝、微管和角蛋白纤维的平均荧光强度值,分别与48 h或72 h的对照组比较,*P < 0.05,**P < 0.01。白色箭头指细胞骨架的排列发生显著改变的胞质区域,标尺10 μm。Note:A:Fluorescence microscope images of intracellular microtubules,microfilaments and keratin filaments in treated cells at 48 h;B:Fluorescence microscope images of intracellular microtubules,microfilaments and keratin filaments in treated cells at 72 h;C:Fluorescence microscope images of microtubules and keratin filaments in cells with cytoplasmic elongation.D-F:The average fluorescence intensity values of microfilaments,microtubules and keratin filaments of cells in different treatment groups,respectively compared with the control group of 48 h or 72 h,*P < 0.05,**P < 0.01;The white arrow points to the cytoplasmic area where the arrangement of the cytoskeleton has changed significantly,and the scale is 10 μm.
对角蛋白中间纤维进行免疫荧光染色,其观察结果如图5B所示。对照组细胞的角蛋白纤维呈致密的网状结构,且均匀分布;0.4和0.6 μmol/L处理组细胞在48 h和72 h时其角蛋白纤维的分布与对照相比无明显变化,但核周角蛋白纤维的荧光强度有增加趋势,0.6 μmol/L处理组(48 h和72 h)角蛋白纤维的平均荧光强度均具有显著性上升;0.8和1.0 μmol/L处理组细胞与对照相比其角蛋白纤维分布明显改变,在核周有聚集的趋势,尤其是48 h处理组细胞在核周出现较强的荧光区域,纤维变粗,而72 h处理组细胞核周荧光区与48 h处理组细胞比却有显著的减弱。
如前所述(见图3A),较高浓度药物和较长时间处理组的细胞形成伸长的丝状伪足,经免疫荧光染色后,发现这些伪足中含有丰富的微管和角蛋白纤维,清晰可见其平行束状排列(见图5C)。但在微丝的染色中未见这些长丝状伪足中有应力纤维分布。从上述这些现象可知,药物处理后微管和角蛋白纤维的重排明显,最明显特征是核周及伪足处聚合度明显增加。
2.5 Leukamenin E引起HeLa细胞微丝、微管及角蛋白纤维的聚合度改变
细胞经免疫荧光染色后用流式细胞术测量胞内微丝、微管和角蛋白纤维的含量。由于样品处理过程使细胞内可溶性蛋白流出(低聚合的骨架纤维也有流失),因而,此方法所检出数据表示聚合态纤维骨架含量。
用0.4和0.8 μmol/L的leukamenin E处理HeLa细胞48 h后用流式细胞仪检测细胞中3种骨架纤维含量,评估其聚合特性,结果如图6所示。从图6可以看出,与对照组相比,高浓度处理组(0.8 μmol/L)细胞的聚合态微丝含量显著减少,而聚合态微管的含量却显著增多,其中0.4 μmol/L和0.8 μmol/L处理组细胞中聚合态微管与对照组相比分别增加了204.1%和383.4%,并显示了浓度依赖性,同时,处理组细胞中聚合态角蛋白纤维含量有较小幅增加,达到显著性或极显著差异(见图6)。
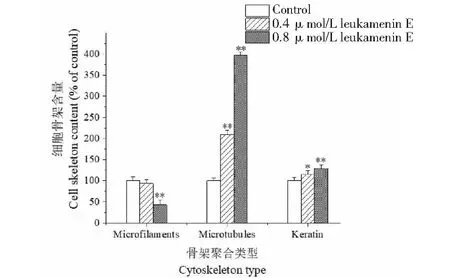
图6 Leukamenin E对HeLa细胞3种骨架聚合的影响Fig.6 Effects of leukamenin E on the aggregation of three cytoskeleton in HeLa cells注:与对照组比较,*P < 0.05,**P < 0.01。Note:Compared with the control group,*P < 0.05,**P < 0.01.
2.6 Leukamenin E引起HeLa细胞内ROS的变化
DCFH-DA(2′,7′-dichlorfluorescein-diacetate)可穿过细胞膜,在细胞内酯酶作用下水解生成无荧光的DCFH,细胞内的ROS可以进一步氧化DCFH生成具有荧光的DCF(2′,7′-dichlo-rofluorescin),其荧光强度即可反映细胞内ROS水平。本实验中,不同浓度的leukamenin E处理HeLa细胞6、12和24 h后,运用流式细胞仪检测细胞内ROS的变化,其结果如图7所示。从图可以看出,0.6~1.0 μmol/L在相同浓度条件下,随着处理时间的延长,ROS含量降低;相同处理时间条件下,随着药物浓度的升高ROS的含量明显升高。与对照组相比,在0.6、0.8和1.0 μmol/L时显示了显著性差异,表明leukamenin E可在较短时间内较大幅度提高胞内ROS水平。
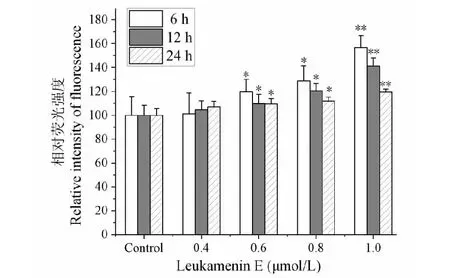
图7 Leukamenin E对HeLa细胞内ROS的影响Fig.7 Effects of leukamenin E on ROS in HeLa cells注:与对照组比较,*P < 0.05,**P < 0.01。Note:Compared with the control group,*P < 0.05,**P < 0.01.
2.7 Leukamenin E联合NAC对HeLa细胞形态、迁移以及3种细胞骨架形态的影响
为了求证leukamenin E诱导的ROS升高与HeLa细胞骨架重排、细胞形态以及细胞迁移的改变是否相关联,将抗氧化剂NAC(可清除活性氧)和1.0μmol/L leukamenin E加入培养基中,共孵育HeLa细胞24、48和72 h后,检测细胞形态、细胞迁移以及3种细胞骨架分布的变化,其结果如图8所示。从图8A可以看出,1.0 μmol/L leukamenin E单独处理组细胞的形态与对照组细胞相比其伸长变形的细胞有明显的增加(见图8A:c和g),细胞伪足数量比对照组有显著减少(见图8D);300 μmol/L NAC对细胞形态没有明显的影响(见图8A:b和f),而NAC联合leukamenin E处理组(300 μmol/L NAC+1.0 μmol/L leukamenin E)的细胞形态与对照组细胞相比也未见明显改变(见图8A:d和h),表明leukamenin E诱导细胞内ROS的产生与细胞形态的伸长改变相关联。
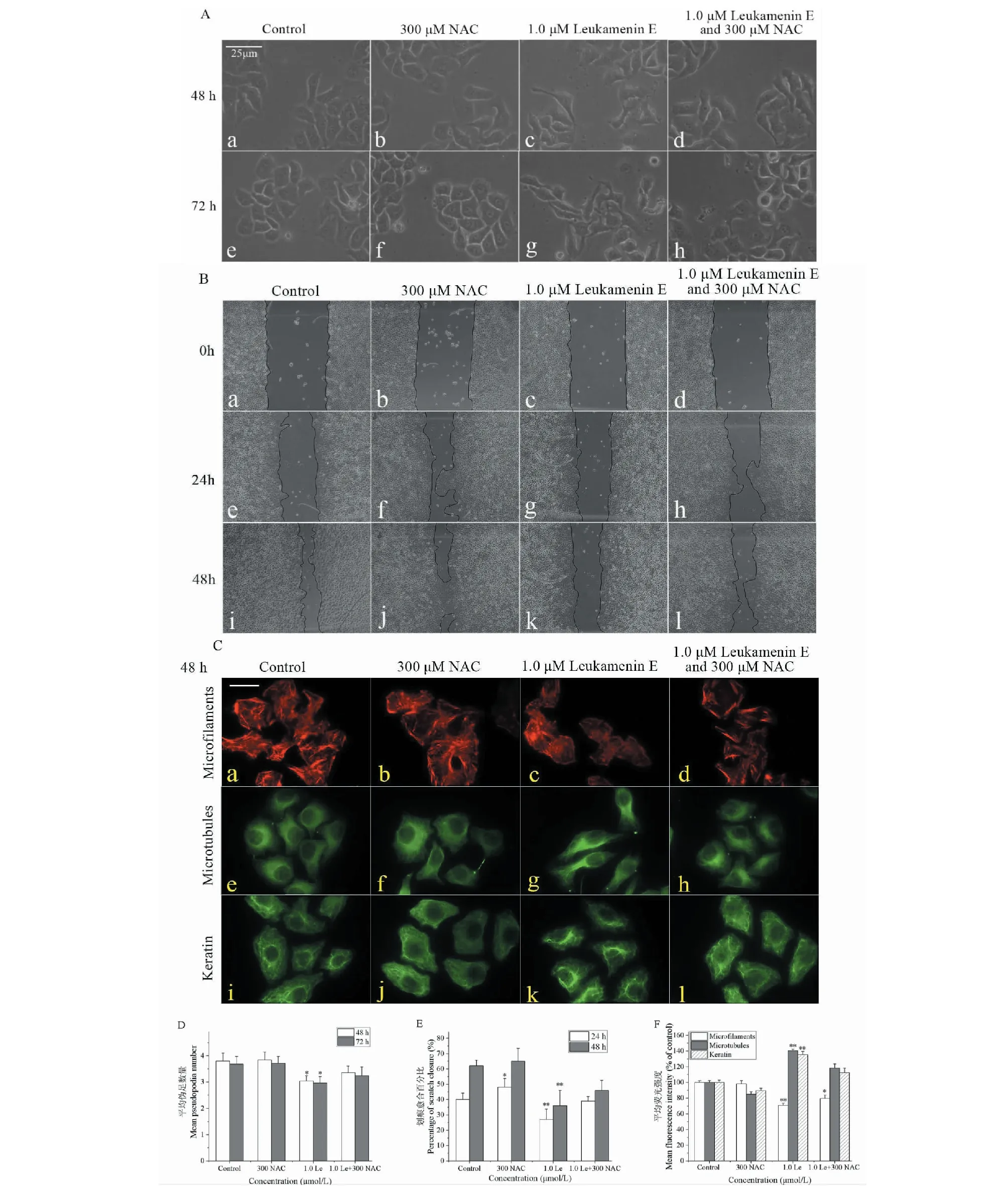
图8 NAC联合leukamenin E使用对HeLa细胞形态、细胞迁移以及3种胞质骨架重排的影响Fig.8 Effects of NAC combined with leukamenin E on cell morphology,cell migration and three cytoskeletal rearrangement in HeLa cells注:A:NAC减弱了leukamenin E诱导HeLa细胞形态的改变;B:NAC减弱了leukamenin E诱导的细胞迁移的抑制效应;C:NAC减弱了leukamenin E诱导3种胞质骨架的重排,标尺10 μm;D~F:Leukamenin E联合NAC使用对HeLa细胞形态、细胞迁移和胞质骨架重排的定量分析,与对照组比较,*P < 0.05,**P < 0.01。Le:Leukamenin E。Note:A:NAC reduced leukamenin E-induced changes of cell morphology;B:NAC reduced leukamenin E-induced inhibition of cell migration;C:NAC reduced leukamenin E-induced changes of the three cytoskeletal distribution in HeLa cells,scale 10 μm;D-F:Quantitative analysis of cell morphology,cell migration and cytoskeletal rearrangement in HeLa cells treated by leukamenin E combined with NAC.Compared with the control group,*P < 0.05,**P < 0.01.Le:Leukamenin E.
同样,1.0 μmol/L leukamenin E单独处理组对HeLa细胞3种细胞骨架的分布与对照组相比有明显改变,具体细节与前面2.4中所述结果一致:胞质应力纤维显著减少(见图8C:c);微管向核周聚集,而其他胞质区域的微管分布减少(见图8C:g);角蛋白也呈现不均匀分布也在核周聚集,纤维变粗(见图8C k)。而NAC与leukamenin E联合处理(300 μmol/L NAC+1.0 μmol/L leukamenin E)显著抑制了leukamenin E对HeLa细胞3种骨架形态的改变:与1.0 μmol/L leukamenin E单独处理组诱导的改变相比,联合处理组细胞的应力纤维在中央区域有所减少,但细胞周边的应力纤维清晰可见(见图8C:d);微管和角蛋白纤维分布较为均匀,核周荧光强度相对较低,未见明显的核周聚集现象(见图8C:h和l)。进一步的荧光强度分析显示,NAC在培养中的加入的确减弱了leukamenin E诱导的微丝、微管和角蛋白纤维的改变,表明leukamenin E诱导细胞内ROS的产生与HeLa细胞3种骨架的改变(重排)特征相关联。
随后,划痕实验检测了NAC联合leukamenin E使用时HeLa细胞的迁移变化,发现300 μmol/L NAC单独处理HeLa细胞24 h后对细胞迁移显示了一定的促进效应,但在48 h后其细胞迁移促进效应减弱,未显示显著性差异(见图8B:b、f、j),而NAC联合leukamenin E使用后(300 μmol/L NAC+1.0 μmol/L leukamenin E)显著减弱了1.0 μmol/L leukamenin E单独处理对HeLa细胞的迁移抑制效应(见图8B:d、h、l),表明leukamenin E诱导细胞内ROS的产生与细胞迁移抑制效应相关。
3 讨论与结论
近年来,对映-贝壳杉烷二萜的抗癌药理活性引起了研究者的广泛兴趣,不同分子构型的该类化合物的抗癌机制的研究报道逐年增多[9,10,12,13,16],发现该类化合物对细胞生命过程的影响是多方面的,在分子水平也显示了多靶点效应。例如,通过多种细胞信号途径诱导细胞凋亡和细胞分化[10,16-19];靶向作用于过氧化物还原酶Ⅰ和Ⅱ、BubR1蛋白以及癌蛋白AML1-ETO[9,16],并可调节NADPH氧化酶活性和诱导角蛋白磷酸化[10,12,13,17]。我们课题组相继报道了对映-贝壳杉烷二萜对细胞骨架系统的影响:leukamenin E可诱导细胞角蛋白K8和K18磷酸化而抑制角蛋白的组装[13];epinodosin和wangzaozin A可分别影响HL-60和HeLa细胞骨架动态组装,引起胞质骨架重排,改变微丝、微管和中间纤维骨架纤维的分布,干扰胞质骨架系统的稳态[10,11],但其作用机制不甚清楚。
本文中我们首先研究了低浓度leukamenin E(0.4~1.0 μmol/L)诱导HeLa细胞骨架重排的特征。低浓度leukamenin E在较长时间(48 h和72 h)处理细胞后使细胞形态显著变化,细胞形成长条状,伪足数量显著减少,伪足拉长,同时,核形态也发生明显变化,“肾形核”数量增多。众所周知,微丝、微管和中等纤维3种细胞骨架均具有维持细胞及其核形态的功能,因此这些变化提示leukamenin E可能干扰细胞骨架的动态平衡,诱导了细胞骨架的重排。进一步的荧光染色检测证实了这一推测:胞质应力纤维数量减少,微管以及角蛋白纤维在核周聚集,微管和角蛋白中间纤维的排布明显改变,某些微管和角蛋白中间纤维增粗(见图5)。流式细胞术检测也证实了HeLa细胞内聚合态微丝减少,聚合态的微管增加显著以及角蛋白纤维聚合小幅上升(见图6)。该结果与我们之前报道的对映-贝壳杉烷二萜wangzaozin A对HeLa细胞骨架重排的诱导作用相类似[11]。但leukamenin E在高浓度(2.0~4.0 μmol/L)条件下处理HepG2、H1299、PLC和HUVEC细胞24 h,其细胞形态变化较小,与低浓度处理后的变化模式完全不同[12,13]。我们发现高浓度leukamenin E可激活细胞ERK信号通路,诱导K8-S431/73和K18-S52磷酸化,抑制角蛋白纤维组装,减少角蛋白纤维数量[13]。这表明不同浓度的leukamenin E可参与调节细胞不同的信号通路,引起不同的细胞响应事件。
细胞骨架深度参与了细胞分裂和迁移的细胞功能,与细胞癌变及恶化密切相关。细胞骨架极其调节蛋白所组成的动态纤维网络参与了细胞迁移的过程,表现为连续的细胞形态改变,细胞骨架重组并驱动细胞定向运动[20]。以细胞骨架为靶点的化合物(细胞松弛素类、秋水仙素和长春新碱等)通过影响细胞骨架组装阻止细胞增殖和迁移。我们的研究表明,0.8~1.0 μmol/L leukamenin E可通过干扰HeLa细胞骨架的动态平衡,引起胞质骨架显著重排,抑制细胞迁移,并通过阻滞细胞周期运转降低细胞增殖速率,说明leukamenin E对于抗癌新药的研究和发现具有重要价值。