腹腔镜辅助下全内脏反位胃癌根治术一例
罗朝霞 袁建 姚磊 赵端仪
病人,女性,66岁。因呕吐、反酸、嗳气1年入院。15年前因子宫肌瘤行子宫切除术。母亲因胃癌去世,哥哥为完全内脏反位(situs inversus totalis,SIT)。体格检查:右位心,体重指数(body mass index,BMI)24.4 kg/m2。2020年10月1日行胃镜检查,提示胃窦部巨大溃疡;10月20日查肿瘤标志物提示:糖类抗原199 137 IU/ml。血常规血红蛋白106 g/L;红细胞压积32%。胸腹部CT检查提示:全脏器反位(图1);胃小弯胃壁增厚,肿瘤性病变可能性大(图2);肝胃间隙及胰头区淋巴结肿大。诊断为胃癌,胸腹腔脏器反位。
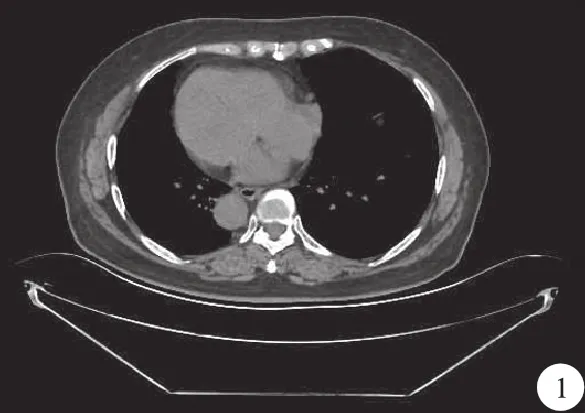
图1 胸部CT提示:内脏反位
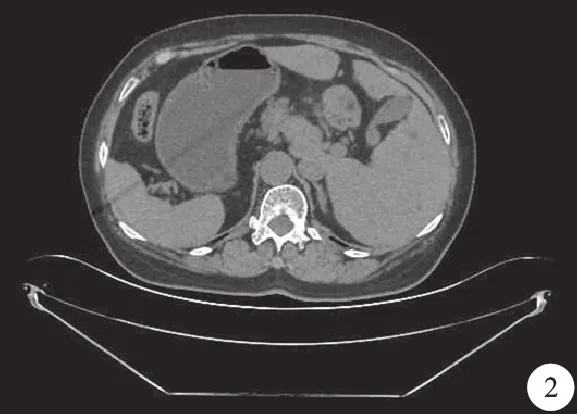
图2 腹部CT提示:胃小弯胃壁增厚,肿瘤性病变可能性大
手术过程:全身麻醉,取“大字位”,主刀医生位于病人左侧,扶镜手位于病人两腿间,助手位于病人右侧,五孔法进行操作,探查腹腔,见大网膜部分与腹壁粘连,完全内脏反位,即肝、胆囊、幽门、十二指肠位于左侧,脾、胃底和胃大弯位于右侧,呈镜像位,肿瘤位于胃窦部小弯侧,周围组织未见明显侵犯,游离大网膜结肠附着处右侧,离断胃网膜左血管,离断部分脾胃韧带和胃短血管,清扫4sb淋巴结[1];继续切断大网膜在横结肠左侧附着部,辨别胃与横结肠系膜,于胰十二指肠上前静脉水平结扎切断胃网膜右静脉,显露胃十二指肠动脉,沿胃网膜右动脉分离并与根部结扎切断,清扫第4a、6组淋巴结[1];显露脾动脉起始部并向左侧细致沿脾动脉分离至胃后动脉分支处完成第11p组淋巴结[2];沿脾动脉根部继续向左侧分离,显露胃左动脉根部并予以结扎离断,清扫第7组、第8a组、第9组淋巴结[1];沿肝固有动脉表面分离,显露胃右静脉并结扎离断,清扫第5组、第12a组淋巴结[1];切开肝胃韧带至食管附近,最后完成第1、3组淋巴结清扫[1];腔镜下离断手术标本,辅助小切口完成消化道重建选择结肠前胃空肠吻合(毕Ⅱ式)(图3,手术时间295分钟,术中出血约100 ml。

图3 消化道重建,胃空肠吻合(毕Ⅱ式)
术后予以抑酸、抗感染、化痰、补液等治疗,术后与护理部交接各引流管情况,对应引流袋做好醒目标注,重点强调脾窝、肝下引流管位置与常规相反。术后第4天拔除尿管,病人下床活动;术后第5天,病人进食清流质饮食;术后第6天排大便。复查腹部CT,拔除胃管;术后第7天拔除脾窝引流管,进食流质饮食;术后第8天拔除肝下引流管,进食半流质饮食;恢复顺利,术后第10天出院。术后病检提示:胃高-中分化腺癌。
讨论SIT又称“镜像人”,是指病人心、肺、肝、胆囊、脾、胃等解剖结构与正常人完全相反[3-4]。SIT的临床发病率较低,当其并发其他疾病需要手术治疗时,其特有的“镜像反位”和无共识可依据给术者增加了难度。为SIT病人行腹腔镜手术主要集中在胆囊及胆道手术中,腹腔镜下胃癌根治术罕见报道[2]。SIT是一种罕见的解剖结构异常现象,临床发病率约为0.005%~0.01%[5]。常伴有血管、胆道、脾、肠道等先天畸形。目前SIT的原因尚存在争议,有学者认为,SIT是常染色体阴性遗传导致的先天异常[6],也有学者认为是在胚胎发育期间旋转不良导致的。有研究表明,KIF3复合体、细胞黏附因子与内脏反位及同步癌症发生及进展有关联[5],SIT是否增加胃癌的发病率尚没有结论。
SIT合并胃癌的病例在国内外很少报道,检索Pubmed、中国知网数据库,目前共有34篇文献报道了SIT并发胃癌的病例,共有36例,其中32例接受腹腔镜手术治疗[5],且术后恢复可。其中有12例SIT病人合并血管畸形。因此术前应特别注意相关影像学检查,如腹部CT,有条件可以行腹部CT血管三维重建,判断血管走形及变异情况,术中谨慎寻找解剖层次,避免暴力牵拉,不盲目切断或夹闭任何结构,可降低术中副损伤风险[7]。本例病人未发现明显血管、胆道等变异,但在清扫淋巴结时有一定困难。
在对SIT病人行腹腔镜手术治疗时,由于其内脏全反位,关于术者的站位,未有统一认识。Kigasawa等[8]采用全反位站位及双监护,顺利完成手术。Yaegashi等[9]报道,在对SIT病人行腹腔镜手术时,改变术者的站位是有效的。但有学者报道,改变术者站位更有利于左利手术者操作,对右利手术者有一定的挑战性[10]。本例中术者、助手、器械护士一开始采用全反位站位,后因不适应非常规站位及操作方式,助手无法很好地帮助术者,器械护士也不能很好地配和,最后改用常规站位和反向思维来行手术操作,顺利完成手术。

