轻型颅脑损伤病人血清高迁移率族蛋白B1、泛素C末端水解酶L1和神经元特异性烯醇化酶水平变化及与预后的相关性分析
谢元润 马迎辉 叶继业 陈超
轻型颅脑损伤(mild head injury,MHI)在颅脑损伤病人中占比远多于中、重型颅脑损伤,且因症状较轻的原因,仅少数及时得到了医治,常留下后遗症[1]。目前,临床主要通过格拉斯哥预后量表(Glasgow coma scale,GOS)评估颅脑损伤病人预后,但病人生理病理等基础因素的影响具有一定局限性。研究发现,炎症反应和神经组织损伤与颅脑损伤病人预后密切相关[2]。高迁移率族蛋白B1(high mobility group protein B1,HMGB1)是一种核蛋白,能激活核因子κB,引起一系列炎症级联反应[3]。泛素C末端水解酶L1(ubiquitin C-terminal hydrolase L1,UCH-L1)是一种半胱氨酸特异性水解酶,能通过结合单体泛素,延长泛素半衰期以对神经元进行调控,与神经系统功能密切相关[4]。神经元特异性烯醇化酶(neuron specific enolase,NSE)是神经元细胞的一种酶,在脑组织细胞中具有极高的活性,脑组织受损后,会大量释放NSE[5]。本研究分析MHI病人血清HMGB1、UCH-L1、NSE水平变化情况,探讨其与病人预后的关系。
对象与方法
一、对象
我院2017年1月~2019年1月收治的84例MHI病人为MHI组,均经颅脑CT检查确诊,其中男62例,女22例;年龄42~63岁,平均(48.82±3.87)岁;BMI为20~28 kg/m2,平均(24.18±3.13)kg/m2;入院时间为伤后2~8小时,平均(4.50±1.23)小时。纳入标准:(1)符合《临床诊疗指南.创伤学分册》中颅脑损伤诊断标准[6];(2)GOS评分13~15分;(3)临床资料完整者;(4)病人及家属均知情研究;(5)无痴呆者。排除标准:沟通障碍;滥用精神药物、长期酗酒;颅内感染、颅内占位、大面积脑梗死等其他类型脑部疾病者;严重心血管疾病;肝肾功能不全;合并其他部位损伤。另选取同时期57例来我院体检健康者为对照组,男41例,女16例;年龄40~65岁,平均(47.35±4.83)岁;BMI为20~28 kg/m2,平均(23.97±3.23)kg/m2;两组研究对象一般资料对比差异无统计学意义(P>0.05)。本研究经本院伦理委员会批准(伦理编号:EDYLJTHSSZXYY20161108008)。
二、方法
1.基础资料收集:收集MHI病人性别、年龄、BMI、吸烟、饮酒、病史、致伤原因、损伤类型、并发症(包括感染、颅内血肿、脑疝、脑梗塞、压疮等),入院后24小时收缩压(systolic pressure,SP)、舒张压(diastolic pressure,BP)水平。测定总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-C)、超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)水平。
2.血清HMGB1、UCH-L1、NSE水平测定:取入院后24小时内5 ml静脉血,3 000 r/min离心10分钟,半径8 cm,酶联吸附法测定HMGB1、UCH-L1、NSE水平。
3.预后评估:对所有病人随访6个月,采用GOS评估病人预后状况。将MHI组分为预后不良组(Ⅰ~Ⅲ级,23例)和预后良好组(Ⅳ~Ⅴ级,61例)。
三、统计学处理

结果
1.MHI组和对照组血清HMGB1、UCH-L1、NSE水平对比:MHI组血清HMGB1、UCH-L1、NSE水平高于对照组,差异有统计学意义(P<0.05)。见表1。
2.MHI病人预后不良影响因素的单因素分析:预后不良组复合损伤、并发症比例和血清hs-CRP、HMGB1、UCH-L1、NSE水平高于预后良好组,差异有统计学意义(P<0.05)。见表2。
3.MHI病人预后不良影响因素的多因素Logistics回归分析: 以损伤类型、并发症、hs-CRP、HMGB1、UCH-L1、NSE为自变量,以预后情况为因变量(不良=1,良好=0),多因素Logistic回归分析显示,复合损伤、HMGB1、UCH-L1、NSE为MHI病人预后不良独立影响因素(P<0.05)。见表3。
4.血清HMGB1、UCH-L1、NSE水平对MHI不良预后的预测价值:以血清HMGB1、UCH-L1、NSE水平为自变量,MHI预后情况为因变量(不良=1,良好=0),进行Logistic回归,建立MHI不良预后预测模型,Log=P/(1-P)=9.265+1.059×HMGB1-5.964×UCH-L1+0.287×NSE,预测概率作联合ROC曲线,HMGB1+UCH-L1+NSE预测MHI不良预后的AUC明显大于HMGB1、UCH-L1、NSE单独预测(Z=3.894、3.833、4.341,均P<0.05)。见表4、图1。
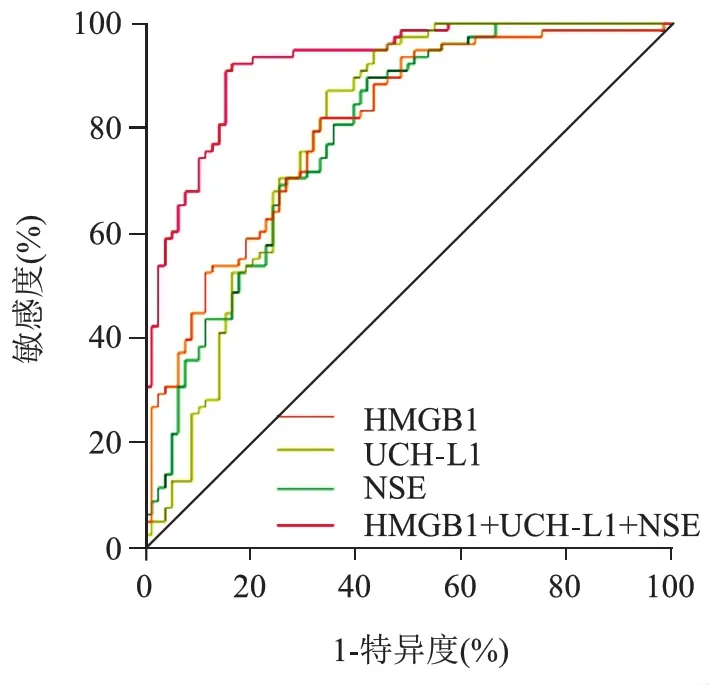
图1 血清HMGB1、UCH-L1、NSE水平预测MHI不良预后的ROC曲线
讨论
MHI为颅脑损伤中最为常见的类型,但由于很多病人并没有明显的影像学和临床表现,且很少有残疾和死亡的结果,因此临床重视度不高。目前,MHI的预后主要依据GOS评分评估,但即便13~15分的病人也可能出现病变恶化甚至死亡等事件,因此迫切需要一种能帮助MHI诊断及评估病人预后的指标。
HMGB1为含量最丰富的HMG蛋白,生理状态下,HMGB1参与DNA复制、转录等功能,病理状态下,则会作为损伤信号分子和炎性因子,通过炎性反应刺激免疫系统,诱导释放多种炎性因子[7]。创伤性脑损伤病人血浆中HMGB1浓度提高,可激活天然免疫系统,释放大量炎症因子,加重病情[8]。本研究结果显示,MHI组血清HMGB1水平高于对照组,颅脑损伤是一个复杂过程,组织、血管损伤会导致HMGB1大量释放,同时组织、血管损伤还会导致脑细胞缺氧、死亡,继发炎症反应,炎症因子刺激细胞导致HMGB1被动释放,并通过受损血脑屏障(blood brain barrier,BBB)进入血液,故MHI病人血清HMGB1水平明显升高[9]。结果显示,预后不良组血清HMGB1水平高于预后良好组,为MHI病人预后不良独立影响因素。Li等[10]通过阻断中风大鼠HMGB1发现,阻断HMGB1信号能减轻BBB损伤和炎症反应。预后不良组血清HMGB1水平升高可能通过加重BBB损伤和炎症反应,加重组织缺血性损伤和神经功能退变进而降低病人预后。
UCH-L1为泛素蛋白酶体系统重要组成分,广泛参与细胞凋亡、细胞周期调控等生理病理反应过程[8]。UCH-L1仅存在于脑部神经元,且分子量仅24 kDa,很容易透过BBB进入外周血液。研究表明,UCH-L1活性改变与帕金森、阿尔茨海默病等神经退行性疾病有关,近年研究发现,脑梗死病人血清中UCH-L1表达明显提升,与病人病情严重程度密切相关[11]。Metzger 等[12]研究也发现,颅脑损伤后脑脊液中UCH-L1表达明显升高,且随着预后变差而提升。本研究结果显示,MHI组血清UCH-L1水平明显高于对照组,颅脑损伤后UCH-L1可从受损神经元中漏出,再经受损BBB进入血液,因此MHI病人血清UCH-L1水平明显提升。研究发现,UCH-L1可通过蛋白激酶A-cAMP反应元件结合蛋白信号途径调节大脑海马组织神经细胞,并通过泛素途径调节应激介导细胞凋亡,加重脑组织损伤[13]。本研究结果也显示。预后不良组血清UCH-L1水平明显高于预后良好组,为MHI病人预后不良独立影响因素,说明血清UCH-L1水平越高,MHI病人预后越差,符合上述报道。
NSE特异性存在神经元胞浆内,生理状态下,能催化α-磷酸甘油裂解为磷酸烯醇式丙酮酸,促进机体糖代谢和控制神经细胞多种功能,病理状态下,多种因素破坏神经元细胞结构则会大量释放NSE,并参与BBB基膜的纤黏蛋白和层黏蛋白降解,损坏BBB并经此进入血液[14]。研究发现,颅脑损伤后12小时内血清中NSE水平即可达高峰,若无继发损害则会在6~12天后降低,与颅脑损伤程度密切相关[15]。同时,NSE还能促进细胞外基质降解、肌动蛋白重构、炎性胶质细胞增殖,使活化小胶质细胞和巨噬细胞迁移至受损部位,加速神经细胞死亡,释放更多NSE[16]。本研究结果显示,MHI组血清NSE水平高于对照组,颅脑损伤后神经元细胞受损,释放NSE并透过BBB进入血液循环。结果显示,预后不良组血清NSE水平高于预后良好组,为MHI病人预后不良独立影响因素,说明NSE水平越高病人预后越差。ROC曲线显示,HMGB1、UCH-L1、NSE均对MHI不良预后具有一定预测价值,三项联合AUC显著增加。联合检测血清HMGB1、UCH-L1、NSE水平能提升MHI不良预后预测价值。

