大肠杆菌O139及其所产志贺样毒素SLT-IIe对猪临床相关指征的影响
范永超,刘海隆,施晓杰,张倩,冯波,穆祥*
(1. 北京农学院动物科学技术学院/兽医学(中医药)北京市重点试验室,北京 102206;2. 海南省农业科学院畜牧兽医研究所,海南 海口 571100;3. 中央民族大学药学院,北京 100081)
仔猪水肿病(edema disease,ED)是一种多发于断奶仔猪的细菌性疾病,主要由产志贺样毒素大肠埃希菌(Shiga toxigenicEscherichiacoli,STEC)引起,初步视诊可观察到头部水肿、腹泻并伴有共济失调、站立不稳和惊厥等神经症状,剖检可见肠系膜、胃壁水肿并伴有出血[1]。该病发病急,病死率高且目前尚未有特效药,极大的影响了仔猪生长发育,严重影响了经济效益。大肠埃希菌O138、O139、O141等血清型可引起该病,其中以O139最为常见[2]。该病主要毒力因子是F18ab菌毛和志贺样毒素二型变异体(Shiga-like toxin IIe,SLT-IIe)[3]。SLT-IIe是由一个具有酶活性的A亚单位被一个识别特定糖脂受体的B亚单位的五聚体包围组成的,A亚单位进入宿主细胞发挥细胞毒作用[4]。细菌通过F18ab菌毛定植在小肠上皮细胞并释放SLT-IIe,SLT-IIe侵害血管内皮细胞,增加血管通透性,促进炎性细胞因子释放并引发一系列免疫反应,造成以肠道为主的多器官损伤,全身水肿和神经症状[4-5]。本试验以猪为试验动物进行攻毒和攻菌,通过临床观察、病理解剖及组织学观察,证明该方法成功模拟了自然感染下仔猪水肿病的病理状态,为基于仔猪水肿病辨证分型新技术的建立和中兽药的研发奠定基础。
1 材料与方法
1.1 菌株与毒素
大肠埃希菌CVCC1519,血清型为O139,购自中国兽医药品监察所;SLT-IIe由本试验室提取保存,浓度为721.75 μg/mL。
1.2 主要试剂
苏木精伊红(HE)染色试剂盒(批号为C0105),购自碧云天生物技术公司;4%多聚甲醛(批号为BL539A),购自西安风腾生物有限公司;注射用生理盐水(批号为HG/T3491-1999),购自四川科林药业股份有限公司;中性树胶(批号为10004160),购自四川科林药业股份有限公司;麦康凯琼脂培养基由兽医学(中医药)北京市重点试验室配置保存。
1.3 试验动物及分组
试验动物长白一元仔猪(25~30日龄),购自北京原种猪场。
选体重5~8 kg长白一元断奶仔猪15头,适应性饲养3 d。试验前对断奶仔猪进行称重,设3个处理组,每组5只。对照组腹腔注射生理盐水1.2 mL/kg,毒素组腹腔注射SLT-IIe毒素溶液0.7 mg/kg,细菌组腹腔注射1×1010CFU/mL的菌液1.2 mL/kg。
1.4 临床指标采集
对各组仔猪进行实时观测,临床观测指标为精神、皮毛色泽、活动、饮食、粪便、舌色。
1.5 病理剖检及组织学检测
在病程发展最高峰时,对各组半数仔猪及死亡仔猪进行剖检取样,观察记录脏器表观病理变化,剖检胃、小肠,对其内容物及黏膜进行观察;取相同部位相同大小的肝脏、脾脏、肺脏、肾脏、空肠、胃进行组织固定,HE染色进行病理组织学检测。
2 结果
2.1 临床症状
对照组无明显临床症状,细菌组及毒素组表现出面部水肿、神经症状等明显水肿病特征性症状,具体如表1所示。

表1 临床症状
2.2 病理剖检
由剖检可见,对照组肠道和胃无明显病理变化(图1A、图1D);毒素组和细菌组仔猪腹腔有纤维样渗出及黄色澄明液体,液体暴露于空气后凝固成胶冻;十二指肠及空肠肠壁肿胀变薄,呈红褐色,肠内容物为红棕色黏稠液体,肠黏膜脱落,弥漫性出血,结肠系膜呈透明胶冻样水肿(图1B、图1C);胃壁水肿,胃黏膜红肿,严重充血、出血,胃底部弥漫性出血,胃内有黄色胶冻,胃黏膜层与肌层易分离,可见水肿液流出(图1E、图1F)。

A. 对照组肠道;B. 毒素组肠道;C. 细菌组肠道;D. 对照组胃;E. 毒素组胃;F. 细菌组胃
2.3 病理组织学检测结果
2.3.1 肝脏
对照组肝脏组织完整,中央静脉结构清晰,可见清晰的肝小叶和排列整齐的肝索(图2A);毒素组肝小叶中央静脉扩张,充满红细胞,肝索紊乱,可见大量炎性细胞浸润,肝细胞破裂(图 2B);细菌组肝小叶中央静脉扩张,肝索紊乱,肝脏组织水肿(图 2C)。

A. 对照组;B. 毒素组;C. 细菌组
2.3.2 空肠
对照组小肠绒毛清晰可见,未发生脱落,肠黏膜及固有层结构正常(图 3A);毒素组小肠绒毛变短、脱落,肠黏膜下层及固有层水肿,炎性细胞浸润,杯状细胞增多(图 3B);细菌组小肠绒毛变短、脱落,肠固有层水肿及黏膜下层水肿,肠腺结构破坏,可见大量炎性细胞浸润(图 3C)。

A. 对照组;B. 毒素组;C. 细菌组
2.3.3 肺脏
对照组肺脏组织结构正常,肺泡壁分界清晰,未见炎性细胞(图 4A);毒素组肺脏组织发生实变,肺泡壁肿胀,炎性细胞增多,间质结缔组织增生显著(图 4B);细菌组肺泡病变区发生实变,肺泡壁肿胀,肺泡腔内有中性粒细胞渗出,肺泡中可见脱落的上皮细胞,间质毛细血管扩张。毒素组肺组织发生实变,肺泡壁肿胀,炎性细胞增多,间质结缔组织增生显著(图 4C)。

A.对照组;B. 毒素组;C. 细菌组
2.3.4 胃
对照组胃壁黏膜完整清晰,胃小凹组织细胞结构排列整齐(图 5A);毒素组胃黏膜腺体和固有层有炎性细胞浸润,下层结构疏松,结缔组织水肿(图 5B);细菌组胃黏膜萎缩,结构紊乱,黏膜下层结构疏松,炎性细胞浸润,结缔组织水肿(图 5C)。
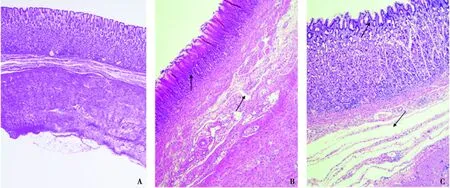
A.对照组;B. 毒素组;C. 细菌组
2.3.5 脾脏
对照组脾脏组织结构正常,脾索、脾窦分界清晰(图 6A);毒素组脾脏组织发生水肿,脾小体结构疏松,充满粉红色水肿液,间质细胞增生,吞噬细胞数量增多(图 6B);细菌组脾窦扩张,血管壁增厚,血管内有微血栓,部分区域淋巴细胞消失(图 6C)。

A.对照组;B. 毒素组;C. 细菌组
2.3.6 肾脏
对照组肾脏组织结构正常,肾小球、肾小管形态清晰(图 7A);毒素组肾小球内细胞增生,肾小管上皮细胞肿胀,肾间质炎性细胞浸润(图 7B);细菌组肾小球萎缩,肾小管上皮细胞脱落,大量炎性细胞浸润(图 7C)。

A.对照组;B. 毒素组;C. 细菌组
3 讨论
仔猪水肿病是三大仔猪大肠杆菌病之一,目前我国还尚未有针对此病的特效药,治疗以青霉素、链霉素等抗生素为主并辅以安痛定等支持性药物[6]。随着2020年国家全面禁抗,兽用抗生素的全面退出,对于替抗药物的研发已经迫在眉睫,一个稳定有效的动物模型是药物研发的重要保障。周宏超等[7]以小鼠为试验动物,通过腹腔注射107/86大肠埃希菌和SLT-IIe毒素成功复制了仔猪水肿病病理模型。本试验选取断奶长白仔猪为试验动物诱发的仔猪水肿病,更加贴近临床上仔猪水肿病的病例。结果发现,毒素组与细菌组的临床表现基本一致,均出现了精神沉郁、共济失调、肌肉震颤等神经症状和典型眼睑、面部水肿等仔猪水肿特征性症状。剖检发现,毒素组和细菌组仔猪胃肠病变突出,胃大弯和肠系膜均出现严重的出血水肿。组织学观察发现,各脏器细胞均有不同程度肿胀甚至破碎,细胞间出血和炎性细胞浸润。其中,胃肠细胞病变最严重,小肠绒毛萎缩脱落、肠黏膜下层及固有层水肿,胃黏膜萎缩、结缔组织水肿。
在已有报道中,对仔猪水肿病的研究大都是围绕胃肠道进行的[8-10],在本试验中,发病仔猪表现出以胃肠道为主的全身多器官损伤。Yang等[11]研究表明,肠道是该病侵袭的靶器官,小肠上皮细胞刷状缘的F18受体是该病的靶点。SLT-IIe是该病的主要毒力因子,本试验也进一步证明了这一观点。SLT-IIe是一种血管毒素,当SLT-IIe被肠道吸收进入血后,与靶内皮细胞糖脂受体结合,去除核糖体28S rRNA上特定的腺嘌呤残基,使核糖体灭活,从而抑制蛋白质的合成[12]。SLT-IIe还能从微血管内皮细胞细胞核DNA中除去腺嘌呤,造成细胞DNA损伤,引起血管内皮细胞变性坏死,导致全身各器官损伤[13]。综上所述,仔猪水肿病是一种以内皮细胞受损为核心的“血管内皮疾病”。因此,开发出保护内皮细胞的药物,理论上可以有效治疗仔猪水肿病。
4 结论
本试验用大肠杆菌O139和SLT-IIe均成功诱发了仔猪水肿病,且SLT-IIe所诱导的发病猪在相关临床指征上与细菌组诱导的发病猪表现出一致性。研究结果为该病的诊断、预防和治疗奠定了科学的理论基础,并为相关新兽药的研发提供了靶动物模型。

