腐植酸浸种对低温胁迫下玉米幼苗抗氧化系统的影响
孙海燕,孔德庸,胡慧影,杜丹凤,马传芳,郭 伟,*
1 黑龙江八一农垦大学农学院,大庆 163319 2 黑龙江省现代农业栽培技术与作物种质改良重点实验室,大庆 163319
黑龙江省作为全国重要商品粮基地,玉米是其种植面积最大的作物。该地区作为典型的一年一熟制春玉米生产区域,多在4月下旬开始播种,苗期气温频繁波动,低温冷害(甚至“倒春寒”)作为该地区主要农业气象灾害[1-2],已成为导致玉米产量不稳、品质不高的主要原因[3]。低温诱导产生活性氧损伤膜的结构[4],而植物对低温的最初响应就是调整生物膜本身的膜脂不饱和度及改善低温下膜的流动性[5-6],以增强植物抗氧化应激能力。抗氧化能力的强弱是由系列小分子物质含量和抗氧化酶活性决定的[7],如超氧化物歧化酶(SOD,superoxide dismutase)、过氧化物酶(POD,peroxidase)、过氧化氢酶(CAT,catalase)和抗坏血酸过氧化物酶(APX,ascorbate peroxidase)等。超氧自由基(SAR,superoxide anion radical)在SOD作用下转化为过氧化氢(H2O2,hydrogen peroxide),进而在CAT、POD或抗坏血酸-谷胱甘肽(AsA-GSH,ascorbic acid-reduced glutathione)循环系统的作用下分解为H2O[4]。同时,抗坏血酸(AsA,ascorbic acid)、谷胱甘肽(GSH,reduced glutathione)、维生素E和类胡萝卜素等低分子量抗氧化剂[8],也可直接与SAR、分子单态氧和羟基自由基相互作用,参与活性氧的非酶清除[9]。低温是破坏植物代谢过程和细胞结构的主要环境压力之一,由于玉米原产于热带,对低温胁迫特别敏感[10]。黑龙江地区频发的低温冷害具有明显的区域性和季节性特征[2],短时低温危害对作物生长影响不大,但持续3 d以上14℃以下的温度将对玉米产量形成不利影响[11-12]。因此,提高玉米的耐低温能力,尤其是研究玉米苗期的耐低温机制及栽培技术,对提高该地区玉米生产能力具有重要的意义[13]。尽管有大量的工作致力于低温胁迫下玉米细胞中低分子量抗氧化剂和抗氧化酶作用机制的研究,但关于玉米幼苗对低温的代谢反应及系统响应研究不多。腐植酸作为一种自然界中广泛存在的大分子有机物质,用其处理作物种子,可以显著提高作物对非生物胁迫的耐受能力[14]。腐植酸浸种可显著提高干旱胁迫下谷子的发芽势和活力指数,有效缓解干旱胁迫对谷子的伤害[15];有效提高小麦叶片GSH含量、SOD和CAT活性[16];促进可溶性糖积累,提高根系渗透性,有效缓解盐碱胁迫对小麦幼苗的质膜损伤[17]。叶片外源施用腐植酸[18-19]或与化肥一起根际施用[20]也可提高抗氧化酶活性,增加游离脯氨酸含量[19],减缓叶绿素分解[18],增强根系活力[20],提高作物的抗旱性。因此,本文在前期研究基础上[16-17],参考腐植酸处理玉米种子方法[21],研究了15℃/8℃的低温胁迫下玉米幼苗的代谢活性、系统抗性和抗氧化能力,以明确腐植酸浸种对低温胁迫下玉米幼苗的耐逆生理机制及适宜浓度,为黑龙江省玉米高产稳产栽培技术研究与应用提供理论参考。
1 材料与方法
1.1 试验材料
试验用玉米(ZeamaysL.)品种为郑单958。腐植酸(C9H9NO6,分子量227.16)由四川西亚化工股份有限公司制造。
1.2 研究方法
选取籽粒饱满、均匀一致的玉米种子,用2%次氯酸钠溶液消毒种子30 min,蒸馏水反复冲洗干净,用滤纸将表面水分吸干。然后分别用质量浓度为0(蒸馏水)、0.2%、0.4%、0.8%、1.2%、1.6%、2.0%的腐植酸溶液在室温条件下浸种12 h,用蒸馏水将种子冲洗干净,将其分别整齐摆放在铺有双层滤纸的发芽盒中,在温度为20℃、相对湿度为70%的培养箱中培养7 d,期间根据滤纸湿度情况及时补充蒸馏水。7 d后选取整齐一致的幼苗移植于带有圆孔的泡沫板上(10株/盒),在塑料方盒(30 cm×50 cm)中用1/2 Hoagland营养液培养,培养条件为光照度100 μmol m-2s-1,温度20℃,光周期12 h/12 h,每3 d更换1次营养液,待玉米幼苗第3片叶完全展开后进行低温胁迫。将不同浓度浸种处理的幼苗在昼夜温度为15℃/8℃下进行低温胁迫培养,每个处理重复3次,胁迫培养48 h后取样测定。
每个处理选取整齐一致的8株幼苗,将幼苗分为根系与地上两部分,用滤纸吸干表面水分,然后用电子天平(精度0.01 g)分别测定根系和地上部8株总鲜重,根系鲜重与地上部分鲜重比值即为根冠比。测定后迅速用液氮冷冻并置于-80℃冰箱保存。分别参照刘萍等[22]的方法采用氯化硝基四氮唑蓝光还原法测定SOD活性;采用紫外吸收法测定CAT活性;采用愈创木酚比色法测定POD活性;采用羟胺氧化法测定SAR产生速率;采用硫代巴比妥酸比色法测定丙二醛(MDA,malondialdehyde)含量;采用考马斯亮蓝比色法测定可溶性蛋白质(SP,soluble protein)含量;采用蒽酮比色法测定可溶性糖(SS,soluble sugar)含量;采用2,6-二氯酚靛酚法测定AsA、脱氢抗坏血酸(DHAA,dehydroascorbic acid)含量;采用二硫代(2-二硝基苯甲酸)法测定GSH、氧化型谷胱甘肽(GSSG,oxidized glutathione)含量;采用分光光度法测定APX活性;采用氯化三苯基四氮唑法测定根系活力。参照中国科学院上海植物生理研究所[23]的方法采用分光光度法测定苯丙氨酸解氨酶(PAL,phenylalnine ammonia-lyase)、多酚氧化酶(PPO,polyphenol oxidase)活性及H2O2含量。
1.3 数据处理
利用WPS进行数据处理、分析及绘图,SPSS Statistics 25软件进行数据统计分析。Duncan新复极差法进行差异显著性检验(P<0.05)。
2 结果与分析
2.1 腐植酸浸种对低温胁迫下玉米植株代谢活性与鲜重的影响
由图1可知,随着腐植酸浸种浓度的增加,低温胁迫下玉米单株鲜重和根冠比呈单峰曲线,峰值出现在0.4%的处理浓度。其中,0.2%—0.8%腐植酸浸种处理的单株鲜重较对照显著增加了31.9%—40.8%,腐植酸浸种浓度≥1.2%处理的单株鲜重与对照间无显著差异;根冠比显著高于对照41.8%—84.7%。

图1 腐植酸浸种对低温胁迫下玉米单株鲜重和根冠比的影响Fig.1 Effects of soaking seed with humic acid on plant fresh weight and root shoot radio of maize seedlings under low temperature stress不同小写字母表示处理间差异显著(P<0.05)
由图2可知,地上部和根系鲜重与单株鲜重变化相似,随着腐植酸浸种浓度的增加,地上部鲜重和根系鲜重也呈单峰曲线,峰值出现在0.4%的处理浓度,但地上部鲜重与对照间无显著差异;0.2%—1.2%处理的根系鲜重较对照显著增加了38.7%—105.3%。因此,腐植酸浸种主要促进了低温胁迫下玉米幼苗根系的生长,从而增加了植株的鲜重,但腐植酸处理浓度≥1.2%则抑制地上部生长,且对根系生长的促进作用也减弱。
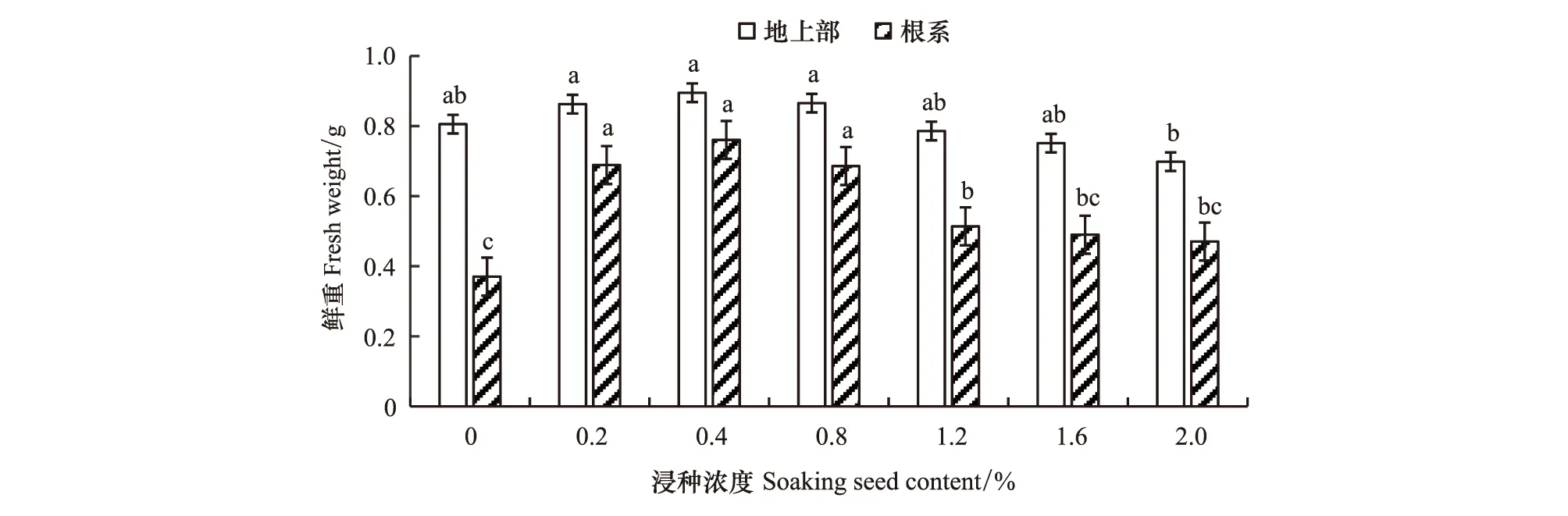
图2 腐植酸浸种对低温胁迫下玉米幼苗地上部鲜重和根系鲜重的影响Fig.2 Effects of soaking seed with humic acid on fresh weight of shoot and root in maize seedlings under low temperature stress
由图3可知,低温条件下腐植酸浸种促进幼苗生长的主要途径是提高了植株的氮代谢水平,而对碳代谢影响不显著(图4)。随着浸种浓度的增加,叶片和根系的可溶性蛋白含量呈单峰曲线,峰值分别出现在1.2%和1.6%的浓度处理;0.4%—2.0%浓度处理的叶片可溶性蛋白含量显著高于对照23.3%—34.9%;0.8%—2.0%浓度处理的根系可溶性蛋白含量高于对照31.9%—89.6%。由此可知,叶片的可溶性蛋白积累对腐植酸浸种处理的响应时间早于根系,但响应程度小于根系。腐植酸浸种处理的叶片和根系可溶性糖的含量与对照间无显著差异。
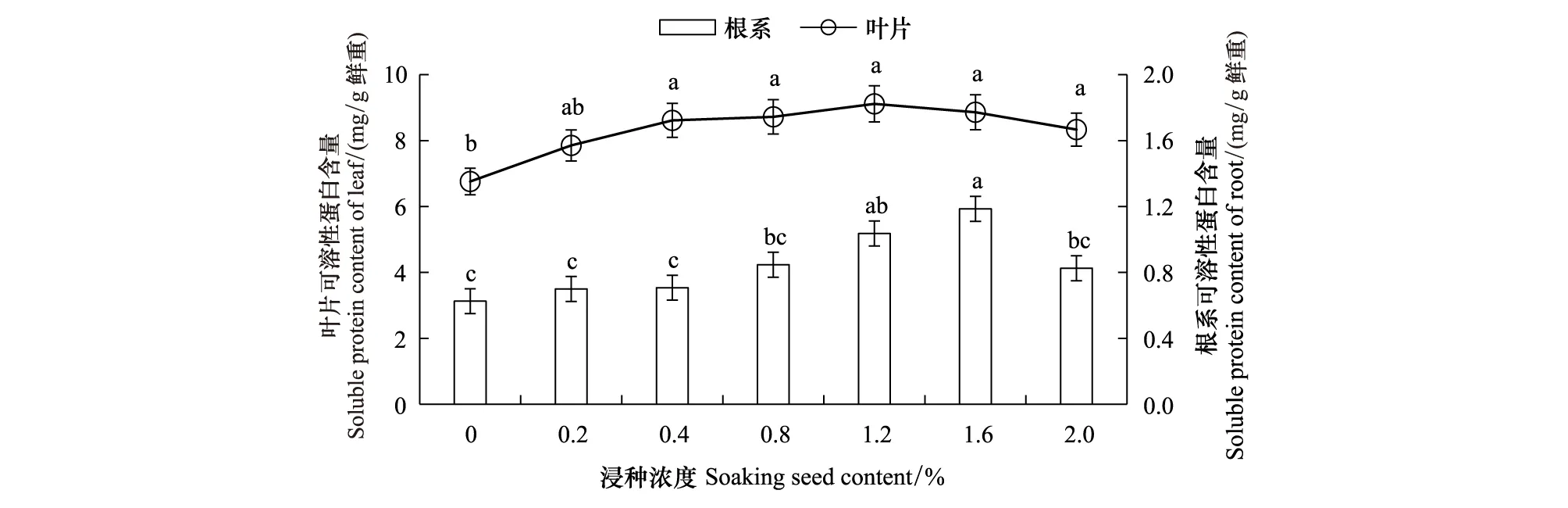
图3 腐植酸浸种对低温胁迫下玉米幼苗可溶性蛋白含量的影响Fig.3 Effects of soaking seed with humic acid on soluable protein content in maize seedlings under low temperature stress

图4 腐植酸浸种对低温胁迫下玉米幼苗可溶性糖含量的影响Fig.4 Effects of soaking seed with humic acid on soluable sugar content in maize seedlings under low temperature stress
2.2 腐植酸浸种对低温胁迫下玉米幼苗根系活力与系统抗性的影响
低温条件下腐植酸浸种可不同程度的增强植株对胁迫的系统响应,主要表现为系统抗性的代表性酶PAL、PPO活性及根系活力的提高。由图5可知,低温胁迫条件下腐植酸浸种处理的叶片和根系的PAL活性均不同程度的增强,在1.6%浓度处理出现PAL峰值,分别较对照显著增加了16.8%和38.8%,且各浓度处理下根系的PAL活性增加的幅度大于叶片各相同处理。
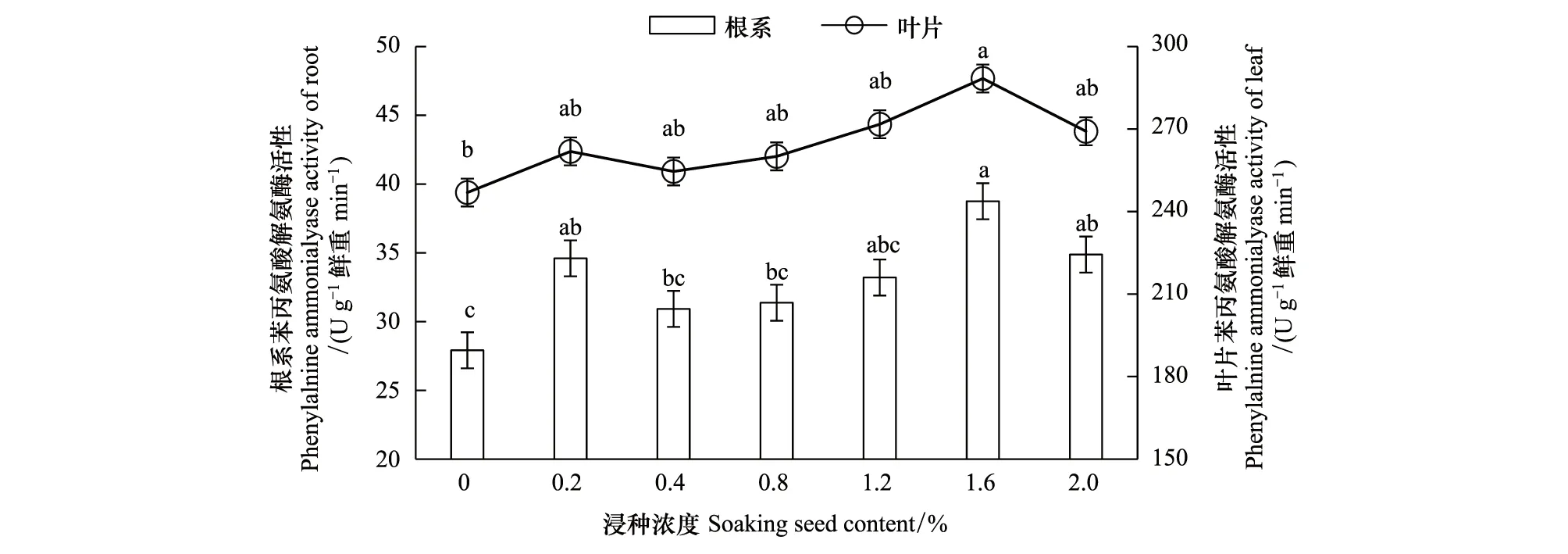
图5 腐植酸浸种对低温胁迫下玉米幼苗苯丙氨酸解氨酶(PAL)活性的影响Fig.5 Effects of soaking seed with humic acid on phenylalnine ammonialyase activity in maize seedlings under low temperature stress
低温胁迫条件下腐植酸浸种对玉米植株PPO活性的影响与PAL相似(图6),不同的是叶片的PPO活性峰值出现在1.6%浓度处理,较对照显著增加了27.7%,而根系的PPO活性峰值出现在2.0%浓度处理,较对照显著增加了23.4%,当浸种浓度≤0.4%,根系PPO活性增加的幅度大于叶片,而处理浓度>0.4%时,PPO活性增加幅度小于叶片。

图6 腐植酸浸种对低温胁迫下玉米幼苗多酚氧化酶(PPO)活性的影响Fig.6 Effects of soaking seed with humic acid on polyphenol oxidase activity in maize seedlings under low temperature stress
当腐植酸浸种浓度为1.6%时,PAL和PPO活性显著增加,而根系活力随着浓度的增加呈单峰曲线(图7),其中,0.4%和0.8%浓度处理的根系活力最高,较对照分别显著提高了25.1%和25.0%。综合根系的鲜重、根冠比及植株蛋白质含量的变化分析可知,低浓度浸种促进了根系的生长,且随着浓度的增加对根系发育的影响减弱,但逐步增强了植株的系统抗性。
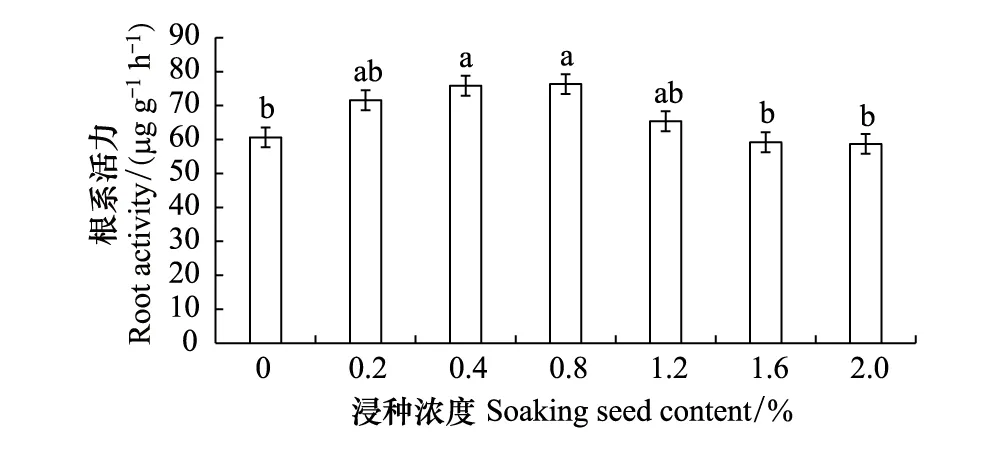
图7 腐植酸浸种对低温胁迫下玉米幼苗根系活力的影响Fig.7 Effects of soaking seed with humic acid on root activity in maize seedlings under low temperature stress
2.3 腐植酸浸种对低温胁迫下玉米植株抗氧化特性的影响
由表1可知,随着腐植酸浸种浓度的增加,玉米幼苗叶片SAR呈现不同程度的降低,其中1.6%和2.0%浓度处理的SAR较对照分别显著降低了24.3%和23.0%,而根系SAR与对照间无显著差异。SOD作为受超氧自由基诱导的抗氧化酶,其活性受浸种浓度影响较小,只有2.0%浓度处理的叶片SOD活性较对照显著降低了64.8%,其他处理叶片与根系的SOD活性与对照间无显著差异。
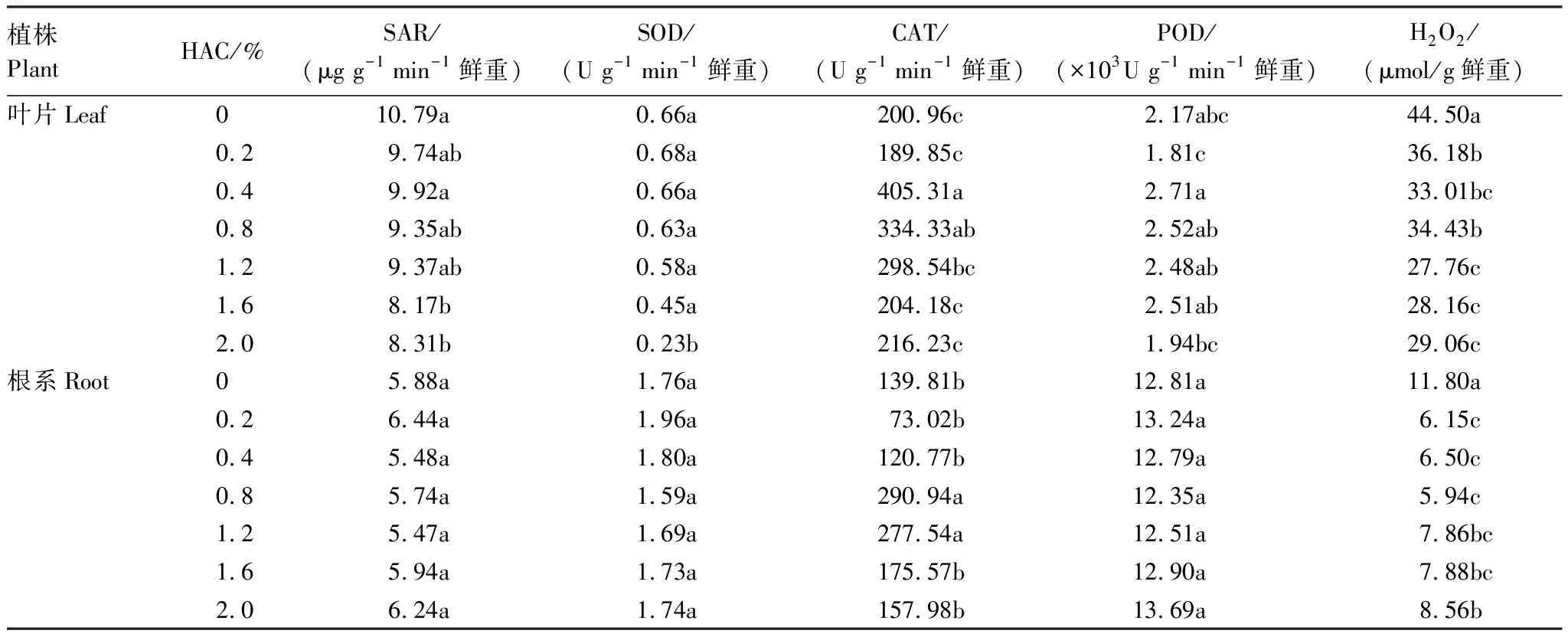
表1 腐植酸浸种对低温胁迫下玉米氧化特性及抗氧化酶活性的影响
超氧自由基发生歧化反应后生成的过氧化物进一步诱导抗氧化酶活性的增强,腐植酸浸种处理下叶片和根系的CAT活性呈单峰曲线,其中0.4%和0.8%浓度处理的叶片CAT活性较对照分别增加了101.7%和66.4%;0.8%和1.2%浓度处理的根系CAT活性较对照分别增加了108.1%和98.5%。随着浸种浓度的增加,叶片POD活性呈单峰曲线,但与对照间无显著差异;根系POD活性与对照间无显著差异。
腐植酸浸种处理的叶片H2O2含量显著低于对照18.7%—37.6%,根系H2O2含量显著低于对照27.5%—49.7%,且低浓度处理叶片H2O2含量大于高浓度处理,而低浓度处理根系H2O2含量小于高浓度处理。结合POD、CAT活性变化可得到,H2O2可能是低温胁迫下积累的过氧化物的主要成分。
由GSH-AsA循环(表2)可知,随着腐植酸浸种浓度的增加,叶片的GSH含量逐渐增加,而根系的GSH含量呈单峰曲线,随着浸种浓度的增加,叶片GSSG含量呈单峰曲线,仅0.8%浓度处理的GSSG含量较对照显著增加了25.4%,而各处理的根系GSSG含量与对照间无显著差异。

表2 腐植酸浸种对低温胁迫下玉米抗坏血酸-谷胱甘肽循环活性的影响
随着腐植酸浸种浓度的增加,叶片AsA含量呈单峰曲线,峰值出现在1.6%的处理浓度,其中1.2%和1.6%处理浓度的叶片AsA含量较对照分别增加了37.4%和62.6%;而根系的AsA含量随处理浓度的增加逐渐增加,当处理浓度≥1.2%时,AsA含量显著增加了40.4%—58.6%。随着浸种浓度的增加,叶片和根系的DHAA含量逐渐增加,其中1.6%和2.0%浓度处理的叶片DHAA含量分别增加了31.9%和36.2%;当处理浓度≥1.2%时,DHAA含量显著增加了47.9%—70.3%。由此可知,腐植酸浸种主要促进了DHAA形成,提高了GSH-AsA循环活性。
随着腐植酸浸种浓度的增加,叶片APX活性呈单峰曲线,其中0.8%和1.2%浓度处理的叶片APX活性较对照分别显著提高了72.3%和97.9%,其他处理的叶片APX活性与对照相比差异不显著;根系APX活性随着腐植酸浸种浓度的增加逐渐增加,当处理浓度超过1.6%,APX活性降低,但其他处理的酶活性均显著低于对照(1.2%和1.6%浓度处理除外)。
MDA是膜脂过氧化程度的重要衡量指标,腐植酸浸种处理的叶片MDA含量较对照降低了3.0%—30.0%(图8),其中0.8%—1.6%浓度处理的MDA含量显著降低了22.0%—30.0%;根系MDA含量较对照降低了1.6%—45.7%,其中0.2%、0.4%和0.8%浓度处理的根系MDA含量分别显著降低了37.1%、45.7%和28.0%,且明显低于相同处理的叶片,而浓度处理≥0.8%,根系与叶片MDA含量与对照相近。由此可见,低浓度(0.2%和0.4%)腐植酸浸种处理对低温胁迫下玉米幼苗的根系抗氧化保护作用较强,中等浓度(0.8%和1.2%)浸种处理对根系的保护作用减弱,对叶片的抗氧化保护加强,高浓度(1.6%和2.0%)浸种对幼苗的抗氧化能力影响较小。

图8 腐植酸浸种对低温胁迫下玉米幼苗丙二醛含量的影响Fig.8 Effects of soaking seed with humic acid on malondialdehyde content in maize seedlings under low temperature stress
2.4 腐植酸浸种对低温胁迫下玉米植株代谢、抗氧化特性及系统抗性间相关分析
由表3可知,低温胁迫和腐植酸浸种处理下幼苗SAR产生速率与SOD活性间显著正相关;根系SAR与叶片、根系CAT活性显著负相关;根系H2O2含量与叶片、根系的MDA含量显著正相关;叶片的H2O2含量与SOD活性间显著正相关。综合分析,SAR的产生诱导了SOD活性,低温条件下腐植酸浸种对SAR产生和SOD活性影响不显著,而CAT活性增强,且与SAR呈显著负相关,与H2O2含量无显著相关性;MDA含量与H2O2含量正相关,与SAR相关不显著。可见,低温胁迫条件下腐植酸浸种可消除H2O2积累,从而降低了膜脂过氧化程度,而依靠CAT活性增强消除H2O2并非主要途径。
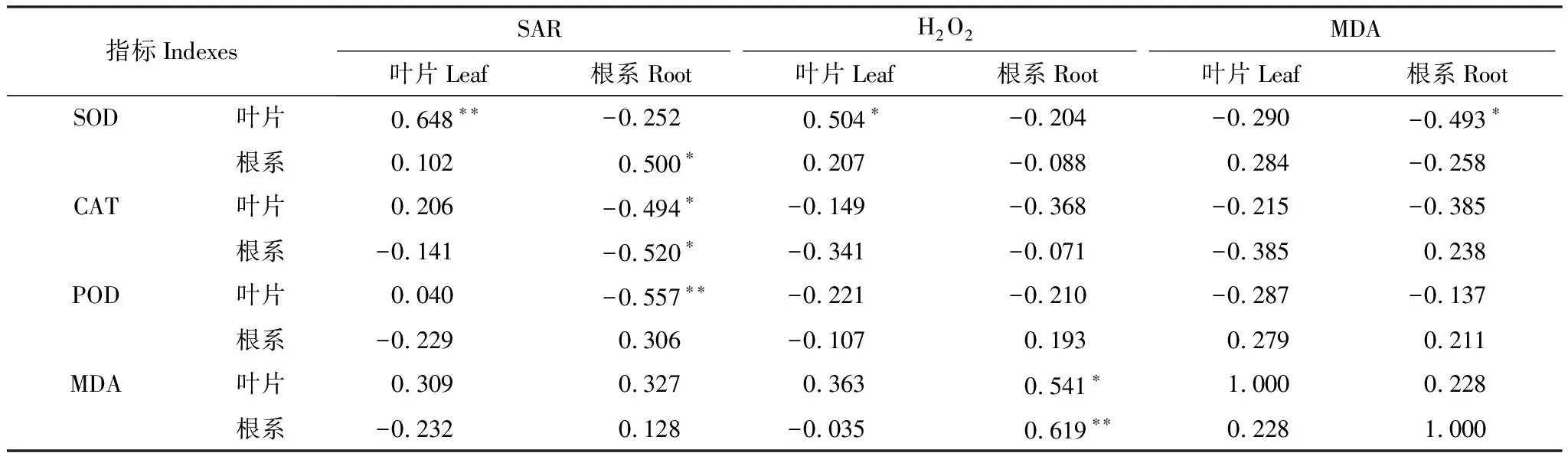
表3 低温胁迫下玉米抗氧化酶系及膜脂过氧化间相关分析
由表4可知,叶片SAR产生速率与幼苗的AsA、DHAA、GSH及GSSG等AsA-GSH循环主要物质含量间显著负相关;叶片H2O2含量与AsA-GSH循环也呈显著负相关;根系的MDA含量与AsA-GSH循环关系较为复杂,主要表现为根系的MDA含量与根系的AsA-GSH循环正相关,而叶片为负相关。由此可知,低温胁迫条件下腐植酸浸种提高了AsA-GSH循环强度,加强H2O2的清除,并且是H2O2清除的主要途径。
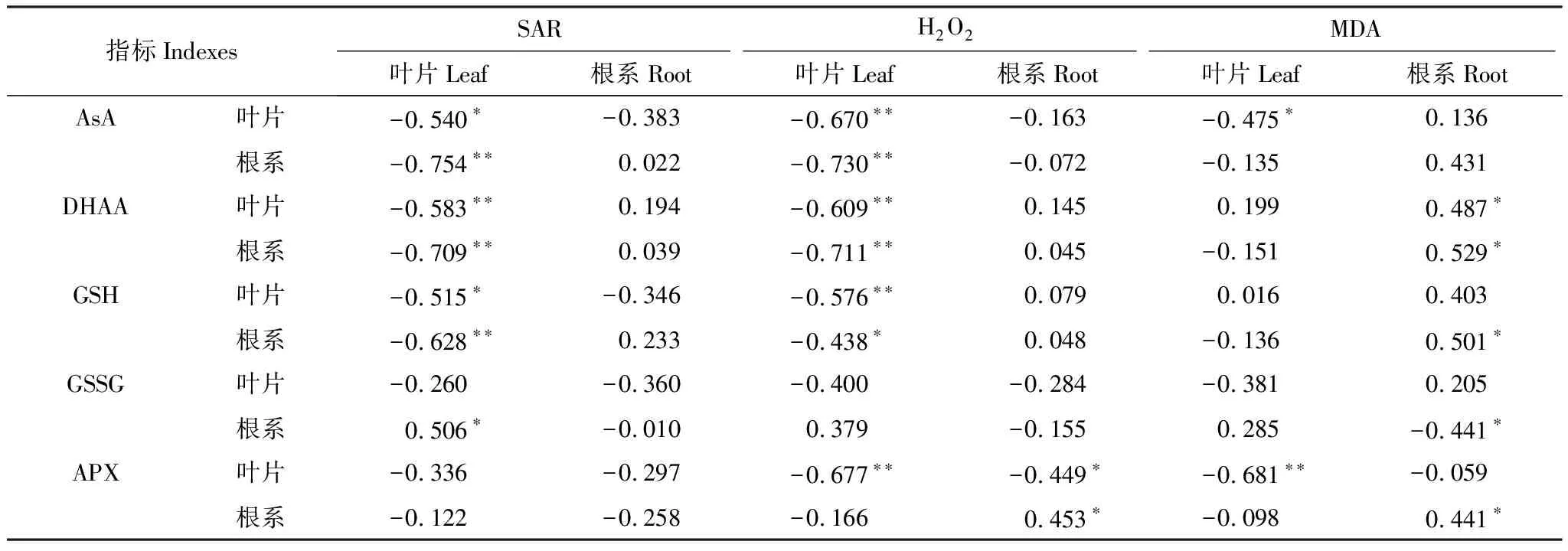
表4 低温胁迫下玉米AsA-GSH循环及膜脂过氧化间相关分析
由表5可知,根系活力与根系的H2O2、MDA含量显著负相关,与叶片的SOD、CAT活性及根系GSSG含量显著正相关,与幼苗DHAA含量显著负相关。可见,低温胁迫下腐植酸浸种可能是通过加强根系对H2O2的清除能力起到减弱根系的膜脂过氧化程度,从而促进根系发育的一个重要途径。
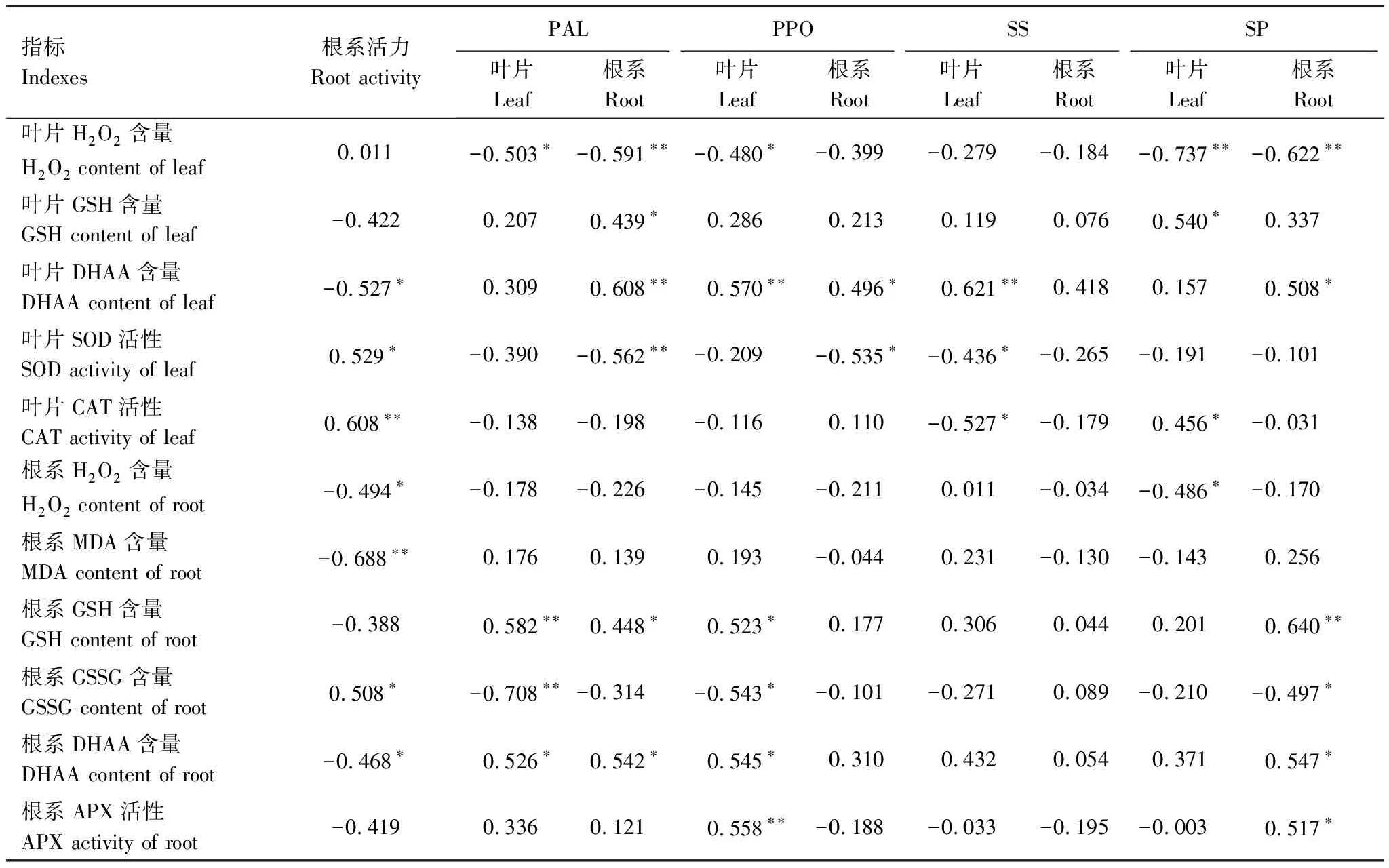
表5 低温胁迫下玉米系统抗性、碳氮代谢与膜脂过氧化间相关分析
PAL、PPO作为系统抗性的代表性酶,与叶片H2O2含量、根系的SOD活性显著负相关,与根系GSH、DHAA含量显著正相关。由此可知,低温胁迫下腐植酸浸种加强了根系AsA-GSH循环,提高了植株对H2O2的系统响应。
叶片SS含量与DHAA含量显著正相关,而与SOD和CAT活性显著负相关;叶片的SP与H2O2含量显著负相关,与CAT活性显著负相关,而根系的SP与H2O2含量显著负相关,与根系的AsA-GSH循环主要物质显著正相关。可见,低温胁迫下腐植酸浸种加强了幼苗氮代谢,增强了抗氧化酶系活性,从而加强了H2O2的清除能力。
3 讨论
3.1 腐植酸浸种处理下玉米幼苗响应低温胁迫的主要诱导因子
植物在不同的非生物胁迫下都可以观察到膜损伤现象,低温胁迫首先发生在细胞膜系统[24]。研究认为,玉米的最佳生长温度为25—28℃,在12℃以下玉米幼苗的过氧化应激基因表达上调,SOD与APX活性同时提高,降低由活性氧引起的细胞离子外渗成为提高耐低温的重要特征[25]。低温胁迫导致SAR积累,从而诱导SOD活性,转化为高浓度的H2O2,进而提高了抗氧化酶系活性。本研究中腐植酸浸种对玉米幼苗抗氧化响应的主要诱导因子也是H2O2而非SAR。因为不仅幼苗的SAR产生速率与诱导酶SOD活性间相关系数显著,且系统抗性代表酶PAL、PPO活性及AsA-GSH循环主要物质含量的变化也表现为与H2O2含量的显著相关性。这可能是低温胁迫下活性氧浓度超出一定范围,易使SOD、POD等酶失活[26]。植物在不适的生长环境下会产生超过正常水平的活性氧[4],研究发现在植物中2%左右的基因表达是受H2O2调控的[27],尤其是在非生物逆境条件下H2O2可以诱导许多保护酶编码基因的产生[28-29],介导了一系列的抗性机制[30-31]。本文中玉米幼苗叶片和根系的膜脂过氧化的主要产物MDA含量均与根系的H2O2含量显著正相关,而与SAR产生速率相关不显著。综合分析,腐植酸浸种通过消除根系的H2O2积累,从而减少低温胁迫对根系的质膜损伤,增强玉米幼苗对过氧化的系统响应。
3.2 腐植酸浸种对低温胁迫下玉米幼苗H2O2清除的主要途径
低温胁迫下SAR和H2O2作为植株体内最主要的活性氧导致膜脂过氧化,破坏细胞膜完整性,激活抗氧化酶及抗氧化物质相关基因表达,增强植株自身活性氧清除能力是植物耐低温胁迫的主要途径[32]。郑春芳等[33]等研究认为低温胁迫下清除叶片H2O2的AsA-GSH循环受到抑制,致使叶片对活性氧的清除主要依赖SOD。但也有研究表明,由于SOD、POD等酶在低温条件下受活性氧积累的影响易失去活性和分解[34],同时,CAT对底物H2O2的亲和力较低,而AsA-GSH循环在胞质H2O2的清除中起主要作用。本文研究认为,由于腐植酸浸种对低温胁迫下SAR产生速率影响很小,而调控H2O2的积累是加强玉米幼苗抵御低温膜质过氧化的主要途径。虽然腐植酸浸种同步提高了CAT和AsA-GSH循环活性,但H2O2清除主要依靠AsA-GSH循环。前人研究证实,在AsA-GSH循环中AsA含量及AsA/DHAA比值与抗冷性呈正相关[35-36]。此外,GSH作为植物体内主要的抗氧化物质之一,除了直接参与活性氧的清除,还与AsA偶联[37],GSH及GSH/GSSG 比值成为激活植物体内抗性基因的信号因子[38]。本研究中腐植酸浸种提高了低温胁迫下玉米幼苗的GSH、GSSG、AsA和DHAA含量,但GSH和GSSG含量的增加幅度明显小于AsA和DHAA增加幅度,且浸种处理的叶片APX活性增加幅度均大于50%。由此可见,低温胁迫下腐植酸浸种加强了AsA和GSH再生,提高了AsA-GSH循环活性而增加H2O2清除能力,且以促进AsA合成为核心。这与低温胁迫下番茄[39]、黄瓜[40]、秋茄[33]、茶树[32]的AsA-GSH循环研究结果相似。腐植酸浸种增强低温胁迫下玉米幼苗抗氧化机制与外源褪黑素的作用途径一致,外施褪黑素也是通过增加AsA含量,提升AsA/DHAA比值,为APX提供足够的底物使AsA再生成,促进了AsA-GSH循环系统的运转[33]。
3.3 低温胁迫下玉米幼苗对腐植酸浸种的系统响应
低温是破坏栽培植物代谢过程和细胞结构的主要环境压力之一[10],玉米在低温(昼夜14℃/12℃)条件下28 h就会发生冷应激反应,冷敏感型玉米的细胞渗透电位降低,主要与蔗糖积累降低有关[41],而耐冷型玉米蔗糖转运蛋白和水孔蛋白含量显著增加,韧皮部转载蔗糖能力提高[42]。本研究发现腐植酸浸种处理的玉米幼苗低温胁迫下可溶性糖含量略有增加,但与对照差异不显著,而可溶性蛋白质含量增加明显。可溶性糖向根系的运输和积累可提高根系渗透调节能力,防止膜脂过氧化,维持根系活力。但本研究中腐植酸浸种降低了植物C/N,通过加强氮代谢,促进可溶性蛋白质合成,从而提高抗氧化酶系活性,以及GSH等含氮抗氧化物质含量以维系质膜完整性,保持根系活力;根系活力与抗氧化特性的相关分析也表明,根系活力与根系的GSSG含量显著正相关,而与DHAA含量显著负相关。腐植酸浸种不仅提高了低温胁迫下植株的抗氧化能力,同步诱导了系统抗性的增强,而后者的提高又加强了前者的能力,叶片H2O2含量的降低与PAL和PPO活性的增强显著相关。腐植酸浸种增强植株对低温胁迫抗氧化响应的重要原因在于其复杂的化学结构。腐植酸作为大分子聚合物,带有羧基、酚基、酮基等活性基团,具有很强的生物活性和可变电子价位[43],而这些特性被证明分别是海藻提取物[44]、稀土元素[34]能够提高低温条件下玉米抗氧化应激能力的原因。
3.4 腐植酸浸种对低温胁迫下玉米幼苗生长的影响
玉米低温胁迫下外源脱落酸灌根研究表明,PAL和PPO活性的提升,既提高了幼苗的抗氧化能力,也有利于低温后的幼苗修复[45]。本研究发现,系统抗性和氮代谢的加强是根系和叶片对腐植酸浸种的共同反应,尤其是PAL活性;浸种处理后根系在SAR和H2O2双重信号的作用下,抗氧化酶系、AsA-GSH循环活性均得到加强;而叶片对浸种的响应主要是AsA-GSH循环;腐植酸浸种处理的根系鲜重显著提高,而对叶片鲜重影响较小。因此,维持根系活力、促进根系生长成为腐植酸浸种调控玉米幼苗耐低温胁迫的主要途径。比较不同浸种浓度的效果可知,大多数测定指标均表现为随浸种浓度的增加呈单峰曲线或对数曲线,其中AsA-GSH循环主要物质含量和酶活性的峰值出现在1.6%或2.0%浓度处理;系统抗性酶活性及SS、SP含量的峰值出现在1.6%浓度处理;但抗氧化酶活性、根系活力和鲜重的峰值出现在0.4%或0.8%浓度处理。而根系的H2O2含量在0.8%浓度处理时达到最低值,MDA含量在0.4%浓度处理时达到最低值;同时,叶片的H2O2含量在1.2%浓度处理时达到最低值,MDA含量在0.8%浓度处理时即达到最低值。可见,高浓度的腐植酸浸种有利于低温胁迫下玉米幼苗对活性氧的清除和系统抗性的增强,但AsA-GSH循环主要物质和系统抗性酶的合成是以牺牲生长为代价。植物往往以消耗更多的代谢资源用于防御系统的激活以“权衡生长与防御”[46],但快速生长也是植物耐受逆境的一种重要方式[47]。因此,综合分析评价膜质损伤程度、根系活力和生长质量认为,用0.4%—0.8%质量浓度的腐植酸浸种对提高玉米幼苗耐低温胁迫较为适宜。前人的研究发现,在土壤中施用不超过1 g/kg的腐植酸类物质或叶面喷施0.1%的腐植酸,可促进作物生长[48]。本研究中采用0.4%—0.8%的腐植酸浸种可显著提高玉米耐低温能力,但试验是基于人工气候箱的水培方式进行的,对于露地生产的实践效果还有待于进一步研究。
4 结论
低温胁迫条件下腐植酸浸种主要受到H2O2积累诱导,促进了可溶性蛋白质合成,提高氮代谢水平,以消除根系的H2O2积累,减少低温胁迫对根系的质膜损伤为主要途径。通过增强CAT活性,促进AsA合成为核心,增强AsA-GSH循环系统的运转活性;提高PAL、PPO活性,增强幼苗系统抗性;维持根系活力和促进根系生长来提高玉米植株根冠比,提高玉米幼苗的抗氧化应激能力。虽然,质量浓度为1.6%—2.0%的腐植酸浸种处理可获得最好的AsA-GSH循环系统活性和系统抗性,但是以牺牲生长为代价,在本研究中0.4%—0.8%处理即可达到最佳的H2O2清除效果,获得最大的根系活力和鲜重,可作为水培条件下玉米种子处理的适宜浓度。

