基于BiOI纳米片双识别型毒死蜱光电化学传感器的构建及应用研究
金党琴,龚爱琴,王元有,雍达明,孙 强,朱文军,孙艳艳
(扬州工业职业技术学院 化学工程学院,江苏 扬州 225127)
毒死蜱(CPF)是一种高效中毒有机磷农药,可破坏害虫体内乙酰胆碱酯酶(AChE)活性[1],对植食性害虫,如飞虱、稻纵卷叶螟、菜青虫等具有很好的毒杀效果[2],在蔬菜、水果、粮食作物中应用十分广泛。但因过量使用,导致农药残留严重影响了生态环境安全,对人与动物的生命安全构成威胁[3-4]。联合国环境规划署(UNEP)和粮农组织(FAO)禁用或严格限制一些高毒有机磷农药(如甲基对硫磷和对硫磷)在农业上使用[4]。泰国政府规定针对百草枯和毒死蜱从2020年6月1日起实施禁令[5]。日本肯定列表制度中明确毒死蜱在蔬菜中的最高残留限量为0.01~0.5 mg/kg,我国规定无公害蔬菜中的毒死蜱最高残留限量为1 mg/kg[6-7]。
毒死蜱残留检测的方法有气相色谱(GC)[8]和气相色谱-质谱(GC-MS)[9]、液相色谱(LC)[10]和液相色谱-质谱法(LC-MS)[11]、表面增强拉曼光谱法(SERS)[12]等,但这些方法常要求复杂的前处理、成本昂贵,且不适合现场检测。光电化学(PEC)技术因其具有成本低、灵敏度高、仪器简单、易于小型化等特点而得到快速发展[13-16]。在光照射下,PEC传感器产生的光电流强度与分析物的浓度成正比,可用于定量分析。光敏材料和选择性是决定PEC传感器敏感性的两个关键因素。
作为一种新型三元氧化物半导体,碘氧化铋(BiOI)因具有独特的分层结构,内部静电场垂直于每一层,可以引起光生电子和空穴有效分离,被认为是光捕获材料[17]。其中,由于最小带隙(~1.8 eV)和强吸收可见光特性(吸收边缘为~680 nm),Bi OI在太阳光照射下表现出优异的光吸收性能,已成为研究热点[18],可作为光电化学传感器的电极修饰材料。生物酶分子印迹光电化学传感器因具有高选择性优点,对其研究可进一步提高光电化学传感器的选择性[19]。本研究利用分子印迹聚合物对目标分子毒死蜱的选择性识别能力降低样品基质干扰,并利用毒死蜱对AChE活性的抑制原理,构建了分子印迹AChE/Bi OINFs/ITO双识别型光电化学传感器,为水样中毒死蜱的痕量检测提供了一种新方法。
1 实验部分
1.1 仪器与试剂
CHI660D电化学工作站(上海辰华仪器有限公司),氘卤钨灯光源装置(250 W,λ=504~624 nm,北京纽比特科技有限公司),光源对着电解池中导电玻璃修饰面进行光照射;Hitachi S-4800扫描电子显微镜(SEM,日本日立公司),加速电压15 kV进行扫描;所有实验均在室温下采用传统的三电极体系,参比电极是饱和甘汞电极(SCE),辅助电极是铂丝(φ=1.0 mm),工作电极是氧化铟锡(ITO)导电玻璃(深圳市力科光电玻璃有限公司)。
氯化乙酰硫代胆碱(ATCl,99%)、AChE(C3389,500 U/mg)购自Sigma-Aldrich公司;毒死蜱标准溶液(100μg/mL,乙腈溶解)、Bi(NO3)3·5H2O、KI、2-氨基对苯二甲酸(H2BDC-NH2)、二甲基甲酰胺(DMF)、对巯基苯胺(ATP)、戊二醛、KCl、甲醇(分析纯,中国医药集团有限公司)。0.1 mol/L磷酸盐缓冲液(PBS)用NaH2PO4和Na2HPO4配制。实验用水均为超纯水。
1.2 MIP/BiOINFs/ITO与MIP/AChE/BiOINFs/ITO电极的制备
用玻璃刀将氧化铟锡(ITO)导电玻璃切成长×宽为5 cm×0.6 cm长方形小片,置于2 mol/L KOH的异丙醇溶液煮沸保持30 min,取出,超声清洗10 min,放入100℃烘箱中烘干,备用。
BiOINFs/ITO电极的制备[20]:通过连续的离子层吸附和反应(SILAR)法制得BiOI纳米片组(BiOINFs),取2个烧杯用水分别配制5 mmol/L Bi(NO3)3·5H2O和5 mmol/L KI溶液。处理后的ITO浸入Bi(NO3)3溶液中,取出用水冲洗,然后再浸入KI溶液,每一个浸入过程持续10 s,经过一定的SILAR循环后,制得BiOINFs/ITO在室温下自然晾干。
MIP/BiOINFs/ITO电极的制备:将上述BiOINFs/ITO电极放入含有5 mmol/L对巯基苯胺和0.1 mmol/L毒死蜱的pH 7.0 PBS中,电位值为-1.5 V,恒电位沉积聚合5 min,毒死蜱被聚合到电极表面,取出电极,用适量0.1%戊二醛滴涂至电极表面,自然晾干,用水冲洗过量的戊二醛,再晾干,制得修饰电极。将修饰电极浸入0.1 mol/L KCl溶液中,循环伏安扫描30圈洗脱掉模板分子,电位范围为-1.2~0.5 V,取出电极,自然晾干,制得毒死蜱分子印迹传感器(MIP/BiOINFs/ITO),其表面留有许多毒死蜱分子识别位点。
MIP/AChE/BiOINFs/ITO电极的制备:将制得的MIP/BiOINFs/ITO浸入含6 mU/mL AChE的5 mmol/LPBS(pH 7.0)溶液中6 h。取出,用PBS冲洗MIP/BiOINFs/ITO电极表面未固定的AChE,冲洗时间持续15 min,制得MIP/AChE/BiOINFs/ITO电极。
1.3 毒死蜱的分子印迹光电化学测定
取5 mL 0.1 mol/L PBS(pH 7.0),向缓冲溶液中加入一定浓度的毒死蜱,将制得的MIP/AChE/BiOINFs/ITO电极浸入其中,保持10 min,取出后,再将此电极插入含1.0 mmol/L ATCl的0.1 mol/L PBS(pH 7.0)中,测试光电化学反应。采用I-t法,20 s进行光照,持续10 s,30 s时关闭光源。偏置电压:0 V。毒死蜱的抑制率计算公式为:抑制率(%)=( )I0-I/I0×100,式中,I0和I分别表示不存在和存在毒死蜱时,MIP/AChE/BiOINFs/ITO电极对ATCl的光电流值。
2 结果与讨论
2.1 BiOINFs/AChE的表征
采用扫描电子显微镜对制备的BiOINFs纳米材料形貌进行表征(如图1)。从图1A中可以看出,通过SILAR法制得的BiOINFs纳米片均匀地分布在ITO基体上。图1B显示BiOINFs/ITO电极表面被毒死蜱分子印迹后,BiOINFs纳米片的多孔结构无变化。通常,多孔纳米结构基底利于蛋白质的固定,直接影响生物传感器的最终性能。因此,BiOINFs的这种交错网络结构更有利于生物酶分子的固定。随着AChE的固定化,发现AChE-BiOINFs的形态(图1C)与BiOINFs相似,表明BiOI的结构形态固定后保持不变。

图1 BiOINFs/ITO(A)、MIP/BiOINFs/ITO(B)及MIP/AChE/BiOINFs/ITO(C)的SEM图Fig.1 SEM images of BiOINFs/ITO(A),MIP/BiOINFs/ITO(B)and MIP/AChE/BiOINFs/ITO(C)
在含有2.0×10–3mol/L[Fe(CN)6]3-/4-的0.1 mol/L KCl溶液中,进一步通过电化学阻抗谱法(EIS)研究分子印迹光电化学传感器的逐步组装过程(如图2)。结果显示,BiOINFs/ITO的交流阻抗最小(图2a),通过电聚合法制备分子印迹聚合膜后,交流阻抗显著增加(图2b),这可能是因为分子印迹聚合膜增加了传质阻力的缘故。当AChE修饰到MIP/BiOINFs/ITO电极表面后,交流阻抗进一步增加(图2c),表明AChE的不导电特性会阻碍电子传递和电化学探针的大量传输,导致阻抗增强。上述研究结果表明基于AChE分子印迹电极修饰的每一步过程都是成功的。
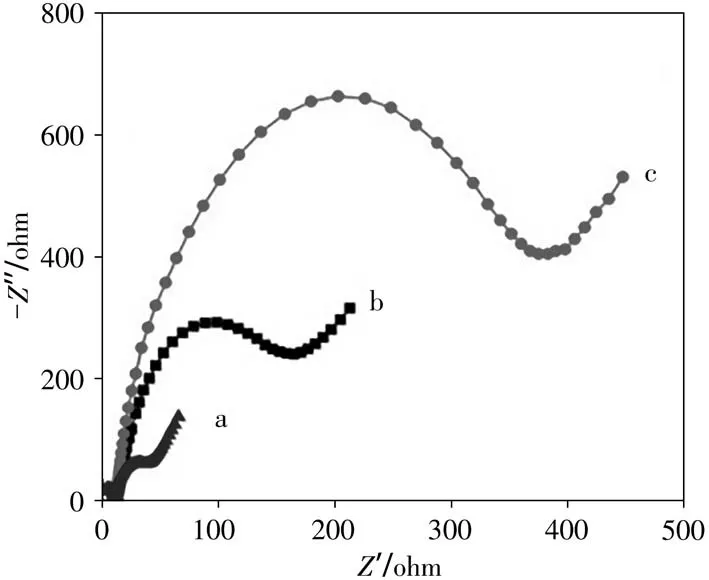
图2 不同电极在2.0×10–3 mol/L[Fe(CN)6]3̄/4̄溶液中的交流阻抗图Fig.2 Electrochemical impedance spectroscopy of differ⁃ent electrodes in 2.0×10-3 mol/L[Fe(CN)6]3-/4-a:BiOINFs/ITO;b:MIP/BiOINFs/ITO;c:MIP/AChE/BiO⁃INFs/ITO;0.1 mol/L KCl
2.2 不同修饰电极的光电流实验
为了研究可见光诱导产生光电流响应情况,对3种修饰电极(Bi OINFs/ITO、MIP/BiOINFs/ITO、MIP/AChE/BiOINFs/ITO)在0.1 mol/L PBS(pH 7.0)中的光电流响应情况进行考察(见图3A)。结果表明,在可见光照射下,BiOINFs/ITO产生明显的光电流(曲线a);由于分子印迹产生的印迹空穴利于电子传递,MIP/BiOINFs/ITO的光电流(曲线b)大于Bi OINFs/ITO;MIP/AChE/BiOINFs/ITO(曲线c)的光电流略高于MIP/BiOINFs/ITO。在PBS溶液中加入酶底物ATCl后,MIP/AChE/BiOINFs/ITO(曲线e)的光电流为42.6 nA,为不含ATCl情况下MIP/AChE/BiOINFs/ITO光电流(11.8 nA)的3.6倍。表明酶底物的加入导致光电流显著提升,可以解释为:当PBS溶液中加入酶底物ATCl,固定的AChE可以催化ATCl水解为乙酸盐和硫代胆碱,在可见光照射下,硫代胆碱易捕获光生空穴,发生氧化反应,促进光生电子和光生空穴分离,导致光电流强度增强。同样实验条件下,未修饰AChE的MIP/BiOINFs/ITO的光电流未见明显增强。进一步说明BiOINFs提供了良好的固定AChE的基质,且AChE保留了其生物活性。
MIP/AChE/BiOINFs/ITO在不同浓度毒死蜱溶液中浸入10 min后,再放入含有酶底物ATCl的PBS中,考察其光电流响应情况(见图3B)。结果表明,MIP/AChE/BiOINFs/ITO的光电流随着毒死蜱浓度的增加(0~20.0 nmol/L)而降低(曲线a~d),且光电流的降低量与毒死蜱浓度成正比。因此,该分子印迹生物传感器可用于毒死蜱的检测。

图3 A:BiOINFs/ITO(a),MIP/Bi OINFs/ITO(b),MIP/AChE/BiOINFs/ITO(c)在0.1 mol/L pH 7.0 PBS中,以及MIP/BiO⁃INFs/ITO(d),MIP/AChE/Bi OINFs/ITO(e)在含1.0 mmol/L ATCl的0.1 mol/L pH 7.0 PBS中的光电流响应;B:MIP/AChE/BiOINFs/ITO在不同浓度毒死蜱溶液中浸入10 min后,在含1.0 mmol/L ATCl溶液的0.1 mol/L pH 7.0 PBS中的光电流响应Fig.3(A)Photocurrent responses of BiOINFs/ITO(a),MIP/BiOINFs/ITO(b)and MIP/AChE/Bi OINFs/ITO(c)in 0.1 mol/LpH 7.0 PBS,and MIP/Bi OINFs/ITO(d),MIP/AChE/Bi OINFs/ITO(e)in 0.1 mol/L pH 7.0 PBS containing 1.0 mmol/LATCl;(B)photocurrent responses of MIP/AChE/BiOINFs/ITO in PBS containing 1.0 mmol/LATCl after immersion in different concentrations chlorpyrifos solution for 10 minB:concentration of chlorpyrifos(a-d):0,0.5,1.0,20.0 nmol/L
2.3 ATCl浓度的优化
ATCl浓度是毒死蜱分析的重要参数之一,当其浓度过低时,MIP/AChE/BiOINFs/ITO电极产生的光电流很小,很难检出毒死蜱含量。然而,ATCl浓度过高时会导致AChE的活性中心被底物占据,不利于抑制剂的抑制。实验考察了6种不同ATCl浓度(0.2、0.4、0.6、0.8、1.0、1.2 mmol/L)对电极光电流的影响。结果显示,随着ATCl浓度的增大,体系的光电流强度增强,且在1.0 mmol/L ATCl时达到最高。继续增大ATCl浓度,则光电流强度降低(见图4A)。因此,实验选择1.0 mmol/L的ATCl为最佳浓度。
2.4 p H值的优化
溶液pH值影响AChE的生物活性,为此考察了不同pH值对MIP/AChE/BiOINFs/ITO电极光电流的影响。为了保持BiOINFs的稳定性[17],溶液pH从6.0~10.0进行实验。结果表明,当溶液pH值为7.0时,电极的光电流最大(见图4B)。因此,实验选择最佳pH值为7.0。
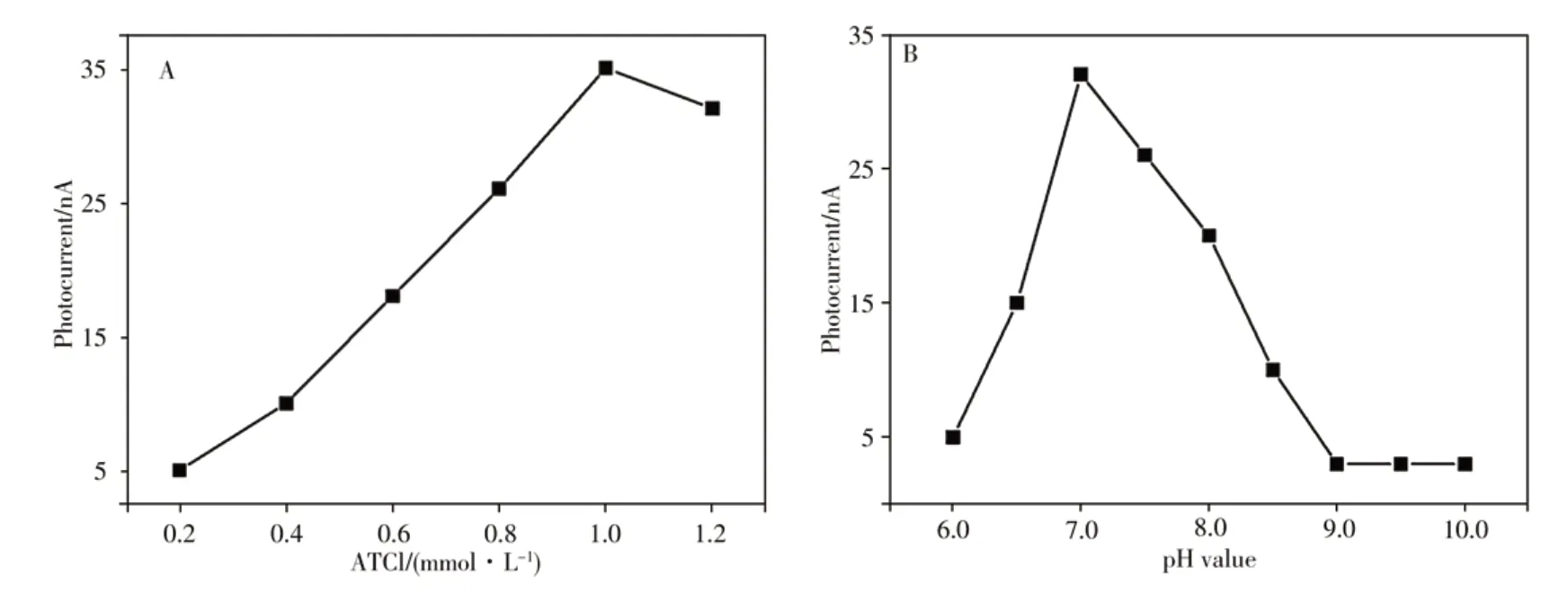
图4 不同浓度ATCl(A)及溶液pH值(B)对MIP/AChE/Bi OINFs/ITO光电流的影响Fig.4 Influences of different ATCl concentrations(A)and pH values(B)on photocurrents of MIP/AChE/BiOINFs/ITO
2.5 MIP/AChE/BiOINFs/ITO光电化学检测毒死蜱
在PBS溶液中,将MIP/AChE/BiOINFs/ITO电极分别浸入不同浓度(0、0.02、0.05、0.1、0.2、0.5、1.0、20.0、50.0、100.0、200.0 nmol/L)毒死蜱中10 min后,进行检测。结果表明,电极的光电流值随着毒死蜱浓度的增加而降低,且光电流抑制率和毒死蜱浓度(CCPF)在0.02~1.0 nmol/L和20.0~200.0 nmol/L范围内呈良好的线性关系,线性方程分别为:抑制率(%)=49.253CCPF+9.433(r2=0.998 6)和抑制率(%)=0.193CCPF+57.599(r2=0.999 1),信噪比(S/N)为3时,检出限为0.005 nmol/L。相比于GC[6]、GC-MS[7]、HPLC[9]、HPLC-MS[10]、SERS[11]和分子印迹光电化学传感器[1]等方法,本方法的灵敏度更高(见表1),且本方法的检出限低于我国规定的毒死蜱最高残留限量。因此,该方法适用于实际样品中毒死蜱的检测。

表1 对毒死蜱不同分析方法的比较Table 1 Comparison of the analytical performance of different methods for chlorpyrifos detection
2.6 方法的重现性、再现性与稳定性
在优化实验条件下,用相同MIP/AChE/BiOINFs/ITO修饰电极重复测量0.5 nmol/L毒死蜱9次,测得相对标准偏差(RSD)为4.2%,表明所制备的电极具有较好的重现性。用相同批次9个MIP/AChE/BiOINFs/ITO修饰电极分别测定0.5 nmol/L毒死蜱,测定结果的RSD为3.9%,表明修饰电极具有良好的再现性。进一步对MIP/AChE/BiOINFs/ITO电极的稳定性进行验证。将该分子印迹电极在4℃下储存7 d后,通过测定,其光电流保留了原光电流响应值的93.9%,说明该双识别型传感器的稳定性较好。
2.7 方法的选择性及其在实际样品中的应用
在优化条件下,选择一些和毒死蜱结构相似的物质,如:三唑磷(TRI)、氯苯(CHL)、杀螟硫磷(FEN)和甲基对硫磷(MP)作为干扰物,考察了分子印迹传感器对毒死蜱的选择性。通过在0.2 nmol/L毒死蜱中加入2.0 nmol/L TRI、CHL、FEN、MP,共存条件下测量光电流信号的强度。结果表明,当毒死蜱中添加上述干扰物时,其光电流信号分别为34.7、34.9、35.1、34.8 nA,相比较仅含毒死蜱(35.0 nA)时无明显变化,表明该分子印迹传感器的选择性较好,具有一定的抗干扰能力。
在优化条件下,采用制备的MIP/AChE/BiOINFs/ITO测定地表水样品中的毒死蜱含量,结果未检出毒死蜱,进一步对样品进行不同浓度(0.05、0.1、0.5、1.0、20.0 nmol/L)毒死蜱的加标回收实验。结果表明水样中毒死蜱的回收率为96.1%~108%,RSD为2.8%~4.2%。表明传感器在复杂样品中具有良好的准确度和回收率。
3 结 论
鉴于分子印迹技术和酶的良好选择性以及BiOINFs在太阳光照射下优异的光吸收性能,本文构建了一种基于BiOINFs纳米材料制备双识别型光电化学传感器,光电子在毒死蜱、BiOINFs和ITO之间的快速传递,使得光电流显著增强。分子印迹技术和生物酶AChE的固定进一步增强了该传感器的选择性。该传感器灵敏度高、制作简便、便于携带,为水样中毒死蜱的检测提供了一种简便的方法。

