微小RNA-140对高糖诱导血管内皮细胞炎性损伤及凋亡的影响*
秦丹丹, 李 强, 刘 璟
湖北省荆门市第二人民医院综合病房,荆门 448000
近年来,我国糖尿病发病率不断增加,目前患病人数已经超过1亿人,已成为公共健康问题,给社会经济发展带来严重负担。高血糖是糖尿病的重要临床表现,长期高血糖可导致血管病变、神经病变等一系列慢性并发症,严重威胁患者的生命健康[1]。其中,高血糖引起血管内皮细胞功能损伤是导致糖尿病患者预后不良及并发症发生、发展的重要病理生理机制[2-3]。因此,进一步深入研究高糖诱导的血管内皮细胞炎性损伤及凋亡机制对防治糖尿病并发症具有重要的临床意义。微小RNA(microRNA,miRNA)是一类广泛存在且进化高度保守的内源性非编码单链小分子RNA,参与细胞增殖、凋亡、应激反应等多种复杂的生命调控过程[4]。miR-140为miRNAs家族的重要成员,在多种肿瘤中低表达,发挥抑制肿瘤细胞增殖与侵袭的作用[5-6]。近年来研究发现,miR-140可能通过影响炎症反应在骨关节炎及类风湿关节炎中起作用[7-8]。但miR-140对高糖诱导血管内皮细胞炎性损伤及凋亡的影响尚未见相关报道。本研究将通过探讨miR-140对高糖诱导人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)炎性损伤及凋亡的影响,以期为防治糖尿病并发症提供一定参考。
1 材料与方法
1.1 试剂与仪器
人脐静脉血管内皮细胞株(HUVECs)、DMEM培养液、化学发光试剂盒(货号:R-HIAS-649、ZY-P0032、ZY-11256)购自上海泽叶生物科技有限公司;Lipofectamine 2000转染试剂、蛋白提取试剂盒、BCA蛋白测定试剂盒、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体、GAPDH抗体、辣根过氧化物酶标记的羊抗兔(货号:11668019、BC3640、PT0001、K000323P、K001435M、M1000110、SR134)购自上海恒斐生物科技有限公司;CCK-8试剂、Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒、白细胞介素-1β(Interleukin1β,IL-1β)抗体(货号:QN1293-OIR、WE0325-THR、K18201-UTG)购自北京百奥莱博科技有限公司;negative control-miR-140、miR-140 mimics均由广州市锐博生物科技有限公司合成;荧光定量PCR试剂盒(货号:DEM202-50 T)购自北京拜尔迪生物技术有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)抗体(货号:ATA38860)购自武汉益普生物科技有限公司;人IL-1β、TNF-α酶联免疫(enzyme-linked immunosorbent assay,ELISA)试剂盒(货号:SEKMY-0002-96 Time、SEKRT-0402-96 Time)购自北京索莱宝科技有限公司。恒温培养箱(型号:MIR-162-PC/MIR-262-PC)购自日本松下公司;荧光定量PCR仪(型号:ABI 7500)购自美国Applied Biosystems公司;酶标仪(型号:MODEL550)购自美国Bio-Rad公司;流式细胞仪(型号:BD FACSCantoⅡ)购自美国BD公司;化学发光成像系统(型号:ChemiDocXRS)购自美国Bio-Rad公司。
1.2 实验方法
1.2.1 细胞培养与分组 将HUVECs培养于含10%胎牛血清、双抗的DMEM培养液,置于37℃、5% CO2饱和湿度培养箱中常规培养。待细胞融合率达到70%~80%时,用胰蛋白酶消化、传代培养。
取对数期HUVECs以1×105个/mL、100 μL/孔接种于96孔培养板,实验分组为:空白对照组(5 mmol/L D-葡萄糖);高糖组(30 mmol/L D-葡萄糖);阴性对照组(30 mmol/L D-葡萄糖+转染negative control-miR-140);miR-140过表达组(30 mmol/L D-葡萄糖+转染miR-140 mimics)。阴性对照组、miR-140过表达组细胞转染采用Lipofectamine 2000转染试剂进行。
1.2.2 实时荧光定量PCR法检测各组HUVECs中miR-140表达情况 将1.2.1中4组HUVECs培养48 h,收集细胞,使用TRIzol试剂提取总RNA,逆转录合成cDNA,采用实时荧光定量PCR(real-time quantitative PCR,qRT-PCR)法检测miR-140表达水平,内参基因为U6。反应程序:95℃ 30 s;95℃ 10 s,60℃ 25 s,72℃ 30 s,共循环45次;72℃ 10 min。miR-140上游引物:5′-GCCGCAGTGGTTTTACCCT-3′,下游引物:5′-CAGTGCAGGGTCCGAGGT-3′;内参U6上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′。Ct值为扩增产物的荧光信号达到临界阈值时对应的循环数,miR-140相对表达量以2-ΔΔCt表示。
1.2.3 CCK-8法检测各组HUVECs增殖情况 将1.2.1中4组HUVECs培养48 h,加入CCK-8试剂后继续培养2 h,使用全自动酶标仪于波长450 nm处检测各孔吸光度(A)值。
1.2.4 流式细胞仪检测各组HUVECs凋亡情况将1.2.1中4组HUVECs培养48 h,收集细胞,胰蛋白酶消化,PBS洗涤,使用400 μL 1×结合缓冲液将细胞密度调整为1×106个/mL,按照Annexin Ⅴ-FITC/PI凋亡检测试剂盒操作说明书步骤,分别加入Annexin Ⅴ-FITC、PI各5 μL,避光孵育1 h,使用流式细胞仪检测细胞凋亡率。
1.2.5 Western blot法检测各组HUVECs中PCNA、Bax、IL-1β、TNF-α蛋白表达情况 将1.2.1中4组HUVECs培养48 h,收集细胞,使用蛋白提取试剂盒提取各组细胞总蛋白,使用BCA蛋白测定试剂盒测定蛋白浓度并进行定量。电泳分离等量蛋白质并转至PDVF膜上,用含5%脱脂奶粉的TBST封闭1 h,分别加入PCNA抗体、Bax抗体、IL-1β抗体、TNF-α抗体、GAPDH抗体(1∶500),4℃孵育过夜,TBST洗涤后加辣根过氧化物酶标记的羊抗兔二抗(1∶5000),室温孵育1 h,免疫反应化学发光法显色,Tanon 600图像分析系统拍摄图像并分析条带灰度,目的蛋白的相对含量=目的蛋白灰度值/内参GAPDH灰度值。
1.2.6 ELISA法检测各组HUVECs的IL-1β、TNF-α分泌情况 将1.2.1中4组HUVECs培养48 h,收集上清液。ELISA法检测IL-1β、TNF-α分泌情况,具体操作参照试剂盒说明书进行,使用酶标仪于波长450 nm处测定A值,计算IL-1β、TNF-α分泌含量。
1.3 统计学分析

2 结果
2.1 各组HUVECs中miR-140表达情况
与空白对照组相比,高糖组、阴性对照组miR-140表达水平显著降低(均P<0.05);与高糖组相比,阴性对照组HUVECs中miR-140表达水平差异无统计学意义(P>0.05),miR-140过表达组HUVECs中miR-140表达水平显著升高(P<0.05);与阴性对照组相比,miR-140过表达组HUVECs中miR-140表达水平显著升高(P<0.05)。见表1。
表1 各组HUVECs中miR-140表达情况Table 1 Expression of miR-140 in HUVECs of each group
2.2 各组HUVECs增殖、凋亡情况
与空白对照组相比,高糖组、阴性对照组HUVECs增殖水平均显著降低,凋亡率显著升高(均P<0.05);与高糖组相比,阴性对照组HUVECs增殖水平,凋亡率均差异无统计学差异(均P>0.05),与高糖组阴性对照组相比,miR-140过表达组HUVECs增殖水平显著升高,凋亡率显著降低(均P<0.05)。见表2、图1。
表2 各组HUVECs增殖、凋亡情况Table 2 Proliferation and apoptosis of

图1 流式细胞仪检测各组HUVECs凋亡情况Fig.1 Apoptosis of HUVECs in each group was detected by flow cytometry
2.3 各组HUVECs中PCNA、Bax、IL-1β、TNF-α蛋白表达情况
与空白对照组相比,高糖组、阴性对照组HUVECs中PCNA蛋白表达水平显著降低,Bax、IL-1β、TNF-α蛋白表达水平显著升高(均P<0.05);与高糖组相比,阴性对照组HUVECs中PCNA、Bax、IL-1β、TNF-α蛋白表达水平差异均无统计学意义(均P>0.05),miR-140过表达组HUVECs中PCNA蛋白表达水平显著升高,Bax、IL-1β、TNF-α蛋白表达水平均显著降低(均P<0.05);与阴性对照组相比,miR-140过表达组HUVECs中PCNA蛋白表达水平显著升高,Bax、IL-1β、TNF-α蛋白表达水平显著降低(P<0.05)。见图2、表3。
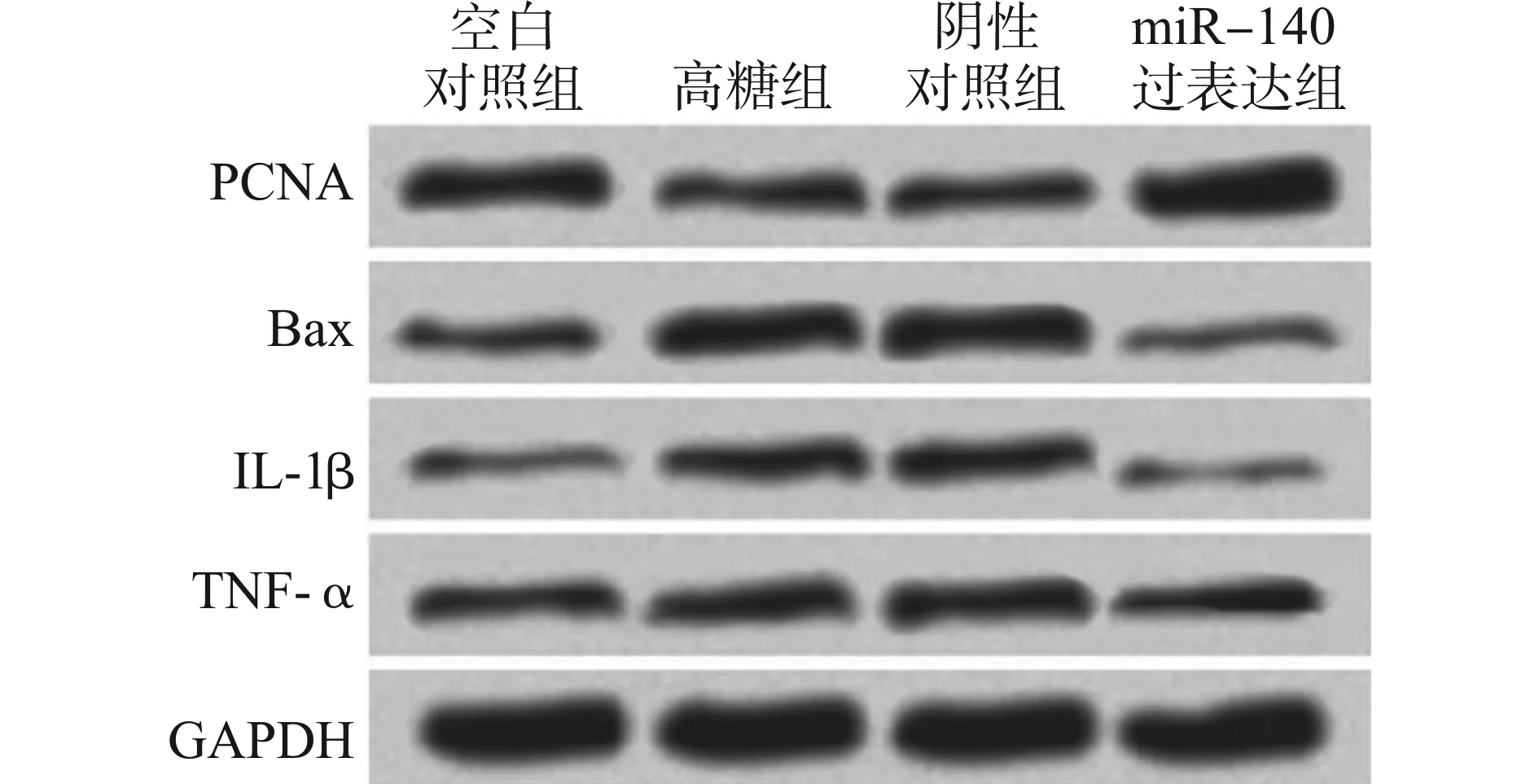
图2 Western blot法检测各组HUVECs中PCNA、Bax、IL-1β、TNF-α蛋白表达情况Fig.2 Expression of PCNA,Bax,IL-1β and TNF-α protein in HUVECs in each group detected by Western blotting
表3 各组HUVECs中PCNA、Bax、IL-1β、TNF-α蛋白表达情况Table 3 PCNA,Bax,IL-1β,and TNF-α protein expression in HUVECs in each
2.4 各组HUVECs的IL-1β、TNF-α分泌情况
与空白对照组相比,高糖组、阴性对照组HUVECs的IL-1β、TNF-α分泌水平显著升高(均P<0.05);与高糖组相比,阴性对照组HUVECs的IL-1β、TNF-α分泌水平无显著差异(均P>0.05),miR-140过表达组HUVECs的IL-1β、TNF-α分泌水平显著降低(均P<0.05);与阴性对照组相比,miR-140过表达组HUVECs的IL-1β、TNF-α分泌水平显著降低(均P<0.05)。见表4。
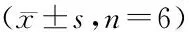
表4 各组HUVECs的IL-1β、TNF-α分泌情况Table 4 The secretion of IL-1β and TNF-α of
3 讨论
糖尿病是以高血糖为主要特征的代谢性疾病,其在中国成人中发病率已达11.6%[9]。糖尿病心血管病变、视网膜病变等多种并发症均始于内皮细胞功能紊乱,以内皮细胞凋亡加速、内皮细胞因子分泌失衡为主要表现[10-11]。内皮细胞是重要的自分泌和旁分泌组织,作为血管的机械屏障,通过调节血管张力、血流速度及氧化应激、抑制血管炎症等,在维持血管内环境稳定方面发挥重要作用。本研究结果显示,与空白对照组相比,高糖组HUVECs的miR-140表达水平、细胞增殖水平显著降低,细胞凋亡率、IL-1β、TNF-α蛋白表达水平显著升高,提示高糖会导致HUVECs中miR-140表达下调,加重炎症反应,抑制细胞增殖同时促进细胞凋亡。因此,进一步研究高糖状态下内皮细胞损伤的潜在机制,对探寻糖尿病并发症防治的新靶点具有重要意义。
近年来,越来越多的研究表明,生物体内存在的许多miRNA分子,通过对其靶基因转录后抑制的调控方式,参与生物多种生命过程。目前,miRNA的研究主要集中在肿瘤发生发展方面,miR-140作为miRNA分子,在大多数肿瘤组织及细胞中呈现低表达,发挥抑癌基因作用,是肿瘤领域研究的热点之一。陈翔等[12]研究表明,miR-140在骨肉瘤中低表达,过表达miR-140后可抑制骨肉瘤U2细胞的增殖和侵袭,并促进其凋亡。梁帅等[13]研究表明,miR-140可靶向高迁移率蛋白B1抑制胰腺癌细胞的增殖。本研究结果显示,与高糖组、阴性对照组相比,miR-140过表达组HUVECs中miR-140表达水平、细胞增殖水平显著升高,HUVECs凋亡率显著降低,提示过表达miR-140可促进HUVECs增殖并抑制其凋亡。
除调节肿瘤发生发展外,有文献证实miR-140还可调节组织、细胞中的炎症反应并抑制组织损伤。贾良良等[14]研究表明,补肾壮筋汤通过调节miR-140表达抑制脂多糖介导的软骨细胞炎症相关调控因子表达,从而抑制脂多糖介导软骨细胞表达基质紊乱,保护软骨细胞功能。王娓娓等[15]研究表明,灯盏花素可能是通过上调miR-140表达,抑制缺血-再灌注损伤引起的心肌细胞凋亡,对心肌缺血再灌注损伤发挥保护作用。本研究结果显示,与高糖组、阴性对照组相比,miR-140过表达组HUVECs中PCNA蛋白表达水平显著升高,Bax、IL-1β、TNF-α蛋白表达水平显著降低,提示过表达miR-140可能通过促进细胞增殖相关因子PCNA表达,抑制促细胞凋亡相关因子Bax及促炎因子IL-1β、TNF-α蛋白表达,促进HUVECs增殖、抑制其凋亡并降低炎症反应损伤[16-17]。进一步研究发现,与高糖组、阴性对照组相比,miR-140过表达组HUVECs的IL-1β、TNF-α分泌水平显著降低,提示过表达miR-140不仅抑制HUVECs中IL-1β、TNF-α蛋白表达,同时抑制IL-1β、TNF-α分泌过程。
综上所述,miR-140可能通过降低炎症因子IL-1β、TNF-α蛋白表达与分泌,下调促凋亡因子Bax蛋白表达,上调细胞增殖相关因子PCNA蛋白表达,抑制高糖诱导的血管内皮细胞炎性损伤及凋亡,并促进细胞增殖,但miR-140在其他血管内皮细胞的作用机制还需进一步研究与完善。

