高效降解生物胺乳酸菌的筛选、鉴定及特性研究
柳佳娜,张 宾,刘 宇,邓尚贵,周小敏,姜 维*
(1.浙江海洋大学 食品与药学学院,浙江 舟山 316022;2.浙江海洋大学 创新应用研究院,浙江 舟山 316022;3.浙江兴业集团有限公司,浙江 舟山 316020)
生物胺是一类具有生物活性的含氮有机化合物的总称,主要是氨基酸脱羧酶对游离氨基酸脱羧反应的产物[1-2]。人体内的微量生物胺具有重要的生理功能,但自身合成的量就能满足需要,一般不需要外源摄入[3]。当人体摄入少量生物胺,可通过体内的胺氧化酶进行降解,如果摄入量超过人体自身的降解能力,会导致脸红、呕吐、呼吸加快、支气管痉挛、头痛以及高血压等中毒症状。对先天性生物胺解毒能力低,或因饮酒、服用药物等导致暂时性缺失生物胺解毒能力的人群,摄入少量生物胺即产生中毒症状。
生物胺在食品中广泛存在,常见的有组胺、酪胺、腐胺和尸胺等,已经在酒类[4]、肉制品[5]、水产品[6]、乳制品[7]和调味品[8]中检测到较高浓度的生物胺。减少食品中的生物胺主要有两条途径:抑制生物胺的产生和去除已产生的生物胺。目前,绝大部分研究集中在抑制生物胺的产生,生物胺的产生需要满足三个条件:①游离氨基酸;②产氨基酸脱羧酶的微生物;③适宜微生物产氨基酸脱羧酶及氨基酸脱羧酶发挥作用的环境。采用辐照[9]、超高压[10]、添加剂[11-12]和气调包装[13]等技术,可以有效抑制生物胺产生菌的生长或降低氨基酸脱羧酶的活性,从而减少生物胺的产生,但难以应用到需要微生物的发酵类食品中。
生物胺性质稳定,去除已经产生的生物胺是生物胺控制的难点。研究表明,采用胺氧化酶可以分解食品中的生物胺,但成本较高,短期内难以产业化推广应用[14]。采用生物胺降解菌是去除食品尤其是发酵食品中生物胺的重要途径之一,研究人员已经分离出多粘芽孢杆菌(Bacillus polymyxa)[15-16]、肉葡萄球菌(Staphylococcus carnosus)[17]、干酪乳杆菌(Lactobacillus casei)[18]、植物乳杆菌(Lactobacillus plantarum)[19]等生物胺降解菌,但数量不多。不同生物胺降解菌的生长和生物胺降解特性差异较大,实际应用中往往需要考量其与生产过程在温度、酸碱度和盐度等方面的匹配度,以及对食品风味和品质等方面的影响,以期挑选出符合要求的生物胺降解菌作为发酵剂。因此,有必要筛选高效降解生物胺的微生物,并明确其生长和生物胺降解特性,提高特定应用场景中生物胺降解菌的选择范围。
本研究以不同发酵时期的鱼露为原料,采用化学成分限定培养基(chemical defined medium,CDM)选择性富集、分离和纯化乳酸菌,通过高效液相色谱法筛选高效生物胺降解乳酸菌,确定降解菌株的分类学归属,并研究其生长和生物胺降解特性,以期为发酵食品中生物胺控制提供有应用潜力的功能发酵剂。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
不同发酵时期(0.5、1、3和6个月)的鱼露:浙江兴业集团有限公司。
1.1.2 化学试剂
标准品腐胺、尸胺、组胺、酪胺和衍生剂丹磺酰氯:西格玛奥德里奇(上海)贸易有限公司;甲醇(色谱纯):默克生命科学技术(南通)有限公司;API50CH和API 50CHL鉴定试剂条:梅里埃诊断产品(上海)有限公司;盐酸、丙酮、硝酸银等其他化学试剂:国药集团化学试剂有限公司。除特殊说明外,所用试剂均为分析纯。
1.1.3 培养基
参考文献[20]方法制备用于乳酸菌培养的CDM液体培养基,并使用4种生物胺代替硫酸铵,腐胺100 mg/L,尸胺100 mg/L,组胺100 mg/L,酪胺100 mg/L,固体培养基中添加2%琼脂。
MRS肉汤培养基、MRS琼脂培养基:青岛海博生物技术有限公司。
1.2 仪器与设备
1260高效液相色谱仪:安捷伦科技有限公司;JXDC-20氮吹仪:上海净信实业发展有限公司;H2050R高速冷冻离心机:湘仪离心机仪器有限公司;DW-86L388超低温冰箱:青岛海尔股份有限公司;CX41生物纤维镜:奥林巴斯(中国)有限公司;UV2600紫外可见分光光度计:日本岛津公司;DH6000BⅡ电热恒温培养箱:天津泰斯特仪器有限公司;BSC-150恒温恒湿箱:上海博迅实业有限公司;Milli-Q超纯水系统:密理博(上海)贸易有限公司。
1.3 方法
1.3.1 生物胺的测定
采用丹磺酰氯柱前衍生-高效液相色谱法测定生物胺含量[21]。
1.3.2 生物胺降解乳酸菌的富集、分离与纯化
1 g鱼露样品加入到20 mL的CDM液体培养基(NaCl含量3%)中,37 ℃条件下静置富集培养48 h,稀释100~104倍后取0.1 mL分别涂布于CDM琼脂培养基(NaCl含量3%)平板,37 ℃下培养48 h,分离挑选单菌落,在CDM琼脂培养基(NaCl含量3%)平板上4次划线纯化,对纯化后微生物编号,添加20%甘油后保藏于-80 ℃冰箱中。
1.3.3 乳酸菌的生物胺降解能力评价
2%乳酸菌(V/V)接种于MRS肉汤培养基(NaCl含量3%)中,37 ℃条件下静置培养24 h,4 ℃、8 000×g离心10 min收集菌体。0.05 mol/L pH=6.0磷酸盐缓冲液(NaCl含量3%)洗涤两次,将菌体重悬到含腐胺、尸胺、组胺和酪胺各100 mg/L的上述磷酸盐缓冲液中,调整菌浓度为OD600nm值=0.8。取8 mL菌悬液加入到10 mL培养管中,37 ℃条件下静置保持24 h。不添加菌体的含生物胺上述磷酸盐缓冲液在同样条件下保持24 h,作为对照组。测定对照组和实验组上清液中的4种生物胺含量,生物胺降解率计算公式如下:

1.3.4 乳酸菌产生物胺能力评价
将2%乳酸菌(V/V)接种于MRS肉汤培养基(NaCl含量3%和鸟氨酸、赖氨酸、组氨酸、酪氨酸各300 mg/L)中,37 ℃条件下静置培养48 h。不接种乳酸菌的培养基在同样条件下保持48 h,作为对照组。测定实验组和对照组的生物胺含量,乳酸菌产生物胺能力为实验组的生物胺含量减去对照组生物胺含量。经过比较,选择降解组胺、尸胺、腐胺和酪胺能力强且本身不产该4种生物胺的菌株,作为本研究的高效降解生物胺乳酸菌。
1.3.5 菌株FSCBAD033的鉴定
使用API50CH和API 50CHL检测菌株对49种不同碳源的发酵能力。将菌株涂布接种于MRS琼脂培养基(NaCl含量3%)上,37 ℃条件下培养24 h后观察菌落形态,并进行革兰氏染色。
分子生物学鉴定:委托上海生工生物工程技术服务有限公司提取菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),扩增16SrRNA序列并进行测序。测出的16SrRNA基因序列提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的Genbank数据库,获得登录号。在EzBioCloud平台上比较菌株与其他标准菌株的16S rRNA序列相似性[22]。选择相似度高的属内和属间序列,使用MEGA 11软件中的邻接(neighbor-joining,NJ)法构建系统发育树,自举法(bootstrap)对系统发育树进行检验(重复1 000次),确定菌株FSCBAD033的种属关系。
1.3.6 菌株FSCBAD033生长曲线的绘制及环境因素对菌株生长的影响
接种环挑取少量斜面保存的菌株FSCBAD033于20 mL MRS肉汤培养基(NaCl含量3%)中,37 ℃下活化培养12 h。取活化好的种子液按照2%的接种量接种于MRS肉汤培养基(NaCl含量3%)和含生物胺MRS肉汤培养基(NaCl含量3%和腐胺、尸胺、组胺、酪胺各100 mg/L),37 ℃条件下静置培养24 h,间隔时间测定波长600 nm下的吸光度值作为生物量,绘制生长曲线。
参照上述步骤,在MRS肉汤培养基中:在初始pH值6.0和NaCl含量3%的条件下,依次考察温度(5 ℃、10 ℃、15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、37 ℃、40 ℃、45 ℃、50 ℃、55 ℃)、初始pH值(2、3、4、5、6、7、8、9)、NaCl含量(0、1%、2%、3%、6%、9%、12%、15%、18%、21%、24%、27%、30%)对菌株FSCBAD033生长的影响。
1.3.7 菌株FSCBAD033去除生物胺作用方式分析
按照1.3.3的方法制备洗涤两次后的菌体,将菌体重悬到0.05 mol/L pH=6.0的磷酸盐缓冲液(NaCl含量3%)中,调整菌液浓度为OD600nm值=0.8,取部分菌悬液121 ℃高压蒸汽灭菌20 min。向灭活和未灭活的菌悬液中分别加入四种混合生物胺,使各生物胺的终质量浓度均为100 mg/L,37 ℃下保持24 h。不添加菌悬液的含生物胺磷酸盐缓冲液在同样条件下保持24 h,作为对照组。测定灭活菌实验组、未灭活菌实验组和对照组上清液中的生物胺含量,分析生物胺的脱除是物理吸附还是生物降解作用。生物胺脱除率计算公式如下:

1.3.8 菌株FSCBAD033对混合生物胺的降解动力学研究
按照1.3.3的方法,在0.05 mol/L pH=6.0的磷酸盐缓冲液(含3% NaCl和腐胺、尸胺、组胺、酪胺各100 mg/L),37 ℃条件下静置保持24 h,不添加菌体的含生物胺上述磷酸盐缓冲液在同样条件下保持24 h作为对照组,间隔3 h取样,测定生物胺降解率,绘制菌株对混合生物胺的降解动力学曲线。
1.3.9 环境因素对菌株降解生物胺的影响
参考1.3.3的方法,在初始pH值6.0和NaCl含量3%的条件下,考察温度(5 ℃、10 ℃、15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、37 ℃、40 ℃、45 ℃、50 ℃、55 ℃)、初始pH值(2、3、4、5、6、7、8、9)、NaCl含量(0、1%、2%、3%、6%、9%、12%、15%、18%、21%、24%、27%、30%)对菌株降解四种生物胺的影响。
1.3.10 数据处理与分析
采用Excel2019软件处理数据,采用Origin 9.0软件绘图,结果以“平均值±标准偏差”表示。
2 结果与分析
2.1 乳酸菌的分离
通过选择性富集、分离和纯化,从鱼露样品中共分离到42株乳酸菌菌株(编号FSCBAD001~FSCBAD042),来源见表1。由表1可知,发酵时间长的鱼露样品中分离到的乳酸菌菌株相对更多。

表1 发酵鱼露样品中分离到的乳酸菌菌株Table 1 Lactic acid bacteria strains isolated from fish sauce samples
2.2 生物胺降解乳酸菌的筛选
采用含生物胺菌悬液培养法,评价了42株乳酸菌菌株的生物胺降解能力,结果见表2。其中,8株乳酸菌表现出对腐胺、尸胺、组胺和酪胺中一种或多种生物胺的降解活性,未检测到其余34株乳酸菌对该4种生物胺的降解活性。有2株乳酸菌(FSCBAD006和FSCBAD033)对4种生物胺均有降解活性,且菌株FSCBAD033的活性明显高于菌株FSCBAD006,降解了86.4%腐胺、78.5%尸胺、72.3%组胺和100%酪胺。其余6株乳酸菌可以降解2~3种生物胺,其中,菌株FSCBAD018降解89.4%尸胺,菌株FSCBAD022降解100%酪胺,FSCBAD038菌株降解80.6%腐胺和65.2%尸胺,这些菌株对特定生物胺表现出较好的降解活性。
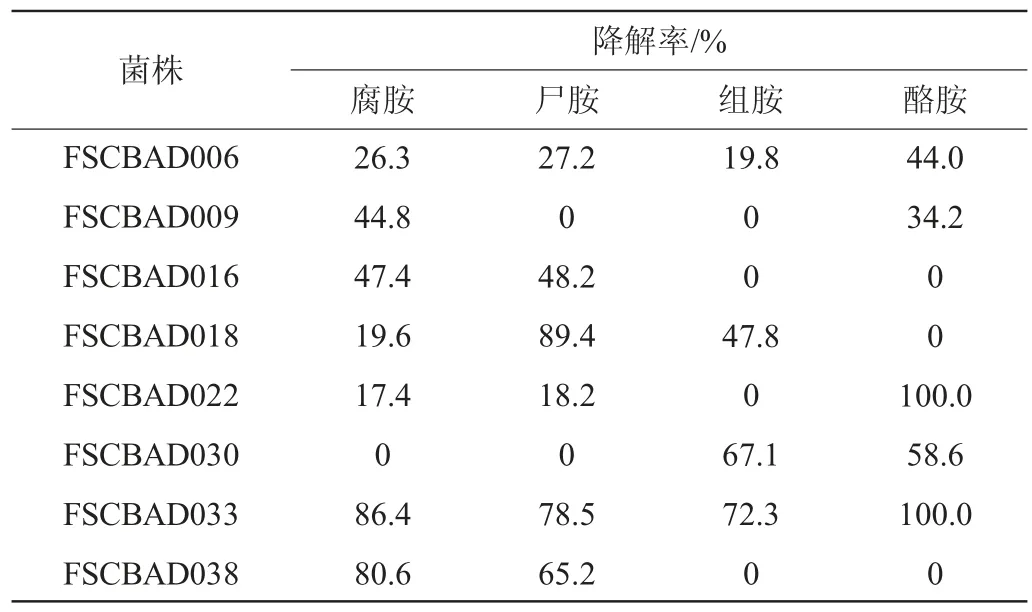
表2 乳酸菌菌株降解生物胺能力的比较Table 2 Comparison of biogenic amines degradation ability by different lactic acid bacteria strains
采用含生物胺前体氨基酸培养基培养法,评价了8株生物胺降解乳酸菌的产生物胺能力,结果见表3。由表3可知,除菌株FSCBAD006和FSCBAD033外,其余6株乳酸菌均具备产生物胺的能力,不宜作为生物胺降解功能菌。此外,本研究还发现,具备降解特定生物胺的菌株均未观察到产该生物胺的能力,与以往的研究报道相符,这也有可能是因为菌株自身将已经产生的生物胺再次降解[21,23-24]。

表3 生物胺降解乳酸菌菌株产生物胺能力的分析结果Table 3 Analysis results of the biogenic amines forming ability of biogenic amines degrading lactic acid bacteria strains
综上,分离自发酵6个月鱼露样品中的菌株FSCBAD033,对食品中4种常见生物胺(腐胺、尸胺、组胺和酪胺)表现出高效的降解能力,且在含有前体氨基酸的培养基中不积累该4种生物胺,进一步根据文献[21]方法分析菌株FSCBAD033产色胺、苯乙胺、精胺和亚精胺的能力,发现其不产上述4种生物胺。因此,选择菌株FSCBAD033为本研究的高效生物胺降解菌。
2.3 生物胺降解菌株FSCBAD033的鉴定
2.3.1 菌落形态及生理生化试验
菌株FSCBAD033的菌落呈圆形乳白色、表面光滑、中间凸起,革兰氏阳性,细胞呈短杆状,API 50CH和API 50CHL分析结果表明,菌株FSCBAD033可以利用阿拉伯糖、纤维二糖、半乳糖、麦芽糖、甘露糖、蜜二糖、棉子糖、核糖、蔗糖、海藻糖和木糖。
2.3.2 菌株的分子生物学鉴定
将菌株FSCBAD033的16S rRNA基因序列提交至NCBI Genbank,获得登录号MW642087,在EzBioCloud平台上分析菌株FSCBAD033的16S rRNA基因序列与其他标准菌株相似度,发现与发酵柠檬乳杆菌(Limosilactobacillus fermentum)CECT 562T的相似度最高(99.80%)。选择16S rRNA基因序列相似度较高的乳杆菌科(Lactobacillaceae)柠檬杆菌属(Limosilactobacillus)菌株以及乳杆菌科其他两个属菌株的16S rRNA基因序列,与菌株FSCBAD033的16S rRNA基因序列构建系统发育树见图1。

图1 基于16S rRNA基因序列菌株FSCBAD033的系统发育树Fig.1 Phylogenetic tree of strain FSCBAD033 based on 16S rRNA gene sequences
由图1可知,菌株FSCBAD033与L.fermentumCECT 562T聚为一支,并且明显区别于其他菌株,从分子生物学上可将菌株FSCBAD033归类为L.fermentum。2020年,原发酵乳杆菌(Lactobacillus fermentum)被重新分类为发酵柠檬乳杆菌(Limosilactobacillus fermentum)[25-26]。因此,菌株FSCBAD033被鉴定为发酵柠檬乳杆菌(Limosilactobacillus fermentum)。
2.4 菌株FSCBAD033的生长特性研究
2.4.1 菌株FSCBAD033的生长曲线
菌株FSCBAD033在MRS培养基(含3%NaCl)和含生物胺MRS培养基(含3%NaCl和腐胺、尸胺、组胺和酪胺各100 mg/L)的生长曲线见图2。

图2 发酵柠檬乳杆菌FSCBAD033的生长曲线Fig.2 Growth curve of Limosilactobacillus fermentum FSCBAD033
由图2可知,将菌株FSCBAD033按照2%(V/V)接种到不含生物胺的MRS培养基中,在37 ℃条件下静置培养,接种后4 h进入对数生长期,16 h进入稳定期,最大生物量(OD600nm值)为1.728。菌株FSCBAD033按照2%(V/V)接种到含有4种生物胺的MRS培养基中,接种后6 h进入对数生长期,18 h进入稳定期,最大生物量(OD600nm值)为1.624。因此,生物胺通过延长迟滞期和降低对数期生长速率的方式,一定程度上抑制了菌株FSCBAD033的生长,可能是因为生物胺会对细胞产生一定的毒性,导致细胞的凋零或死亡[27-28]。
2.4.2 温度对菌株FSCBAD033生长的影响
由图3可知,随着温度的升高,菌株FSCBAD033的生物量呈先升高后降低的趋势,当温度为5 ℃、10 ℃、15 ℃和55 ℃时,菌株FSCBAD033基本不生长,菌株FSCBAD033在温度25~40 ℃的范围内生物量较高(OD600nm值>1),当温度为40 ℃时获得最高生物量(OD600nm值=1.815)。
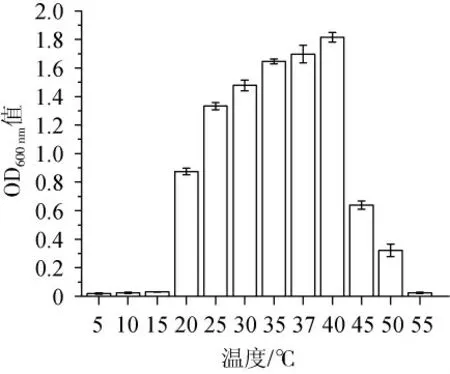
图3 温度对发酵柠檬乳杆菌FSCBAD033生长的影响Fig.3 Effect of temperature on the growth of Limosilactobacillus fermentum FSCBAD033
2.4.3 初始pH值对菌株FSCBAD033生长的影响
由图4可知,随着初始pH值的升高,菌株FSCBAD033的生物量呈先升高后降低的趋势,当初始pH值为2和3时,菌株FSCBAD033基本不生长,菌株FSCBAD033在初始pH值4~8的范围内生物量较高(OD600nm值>1),当初始pH值为6时获得最高生物量(OD600nm值=1.834)。

图4 初始pH值对发酵柠檬乳杆菌FSCBAD033生长的影响Fig.4 Effect of initial pH value on the growth of Limosilactobacillus fermentum FSCBAD033
2.4.4 NaCl含量对菌株FSCBAD033生长的影响
由图5可知,随着NaCl含量的升高,菌株FSCBAD033的生物量呈先升高后降低的趋势,当NaCl含量>24%时,菌株FSCBAD033基本不生长,菌株FSCBAD033在NaCl含量0~15%的范围内生物量较高(OD600nm值>1),低含量NaCl(<3%)可以促进菌株FSCBAD033的生长,当NaCl含量为3%时获得最高生物量(OD600nm值=1.892)。
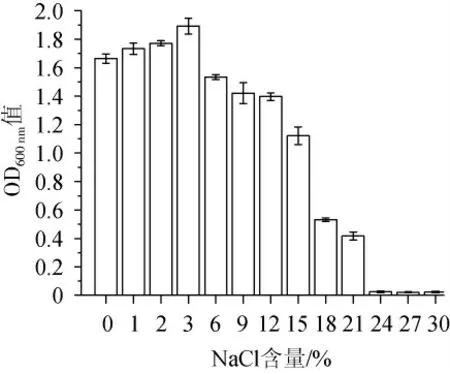
图5 NaCl含量对发酵柠檬乳杆菌FSCBAD033生长的影响Fig.5 Effect of NaCl content on the growth of Limosilactobacillus fermentum FSCBAD033
2.5 菌株FSCBAD033的生物胺降解特性研究
2.5.1 菌株FSCBAD033脱除生物胺的作用方式
由图6可知,未灭活菌株FSCBAD033对4种生物胺的脱除能力较强(均>65%),灭活菌株FSCBAD033对4种生物胺的脱除能力较弱(均<5%),说明菌株FSCBAD033脱除4种生物胺主要通过生物降解的方式,物理吸附作用不明显。

图6 灭活和未灭活发酵柠檬乳杆菌FSCBAD033的生物胺脱除率比较Fig.6 Comparison of biogenic amines removal rates between inactivated and unactivated Limosilactobacillus fermentum FSCBAD033
2.5.2 菌株FSCBAD033对混合生物胺的降解动力学研究
由图7可知,菌株FSCBAD033对酪胺的降解能力最强,3 h降解52.4%酪胺,12 h降解100%酪胺;对其他3种生物胺也表现出较强的降解能力,时间3~12 h范围内降解率:尸胺>腐胺>组胺,时间15~24 h范围内降解率:腐胺>尸胺>组胺,24 h腐胺、尸胺和组胺的降解率分别为83.1%、77.9%和67.8%。

图7 发酵柠檬乳杆菌FSCBAD033对四种生物胺的降解动力学曲线Fig.7 Degradation kinetics of 4 biogenic amines by Limosilactobacillus fermentum FSCBAD033
2.5.3 温度对菌株FSCBAD033降解生物胺的影响
由图8可知,菌株FSCBAD033对4种生物胺的降解率均随温度的升高呈现先上升后下降的趋势,菌株FSCBAD033在温度30~40℃的范围内对4种生物胺的降解率均超过50%,其中,酪胺降解率维持在100%,腐胺(85.7%)、尸胺(76.4%)和组胺(69.8%)最高降解率的温度分别是35℃、37℃和37℃;当温度为5 ℃、10 ℃、50 ℃和55 ℃时,菌株FSCBAD033未表现出明显的生物胺降解活性。生物体一般通过胺氧化酶或胺脱氢酶实现对生物胺的分解作用,温度可对微生物产酶和酶活性产生较大的影响,从而影响生物胺的降解[29]。

图8 温度对发酵柠檬乳杆菌FSCBAD033降解四种生物胺的影响Fig.8 Effect of temperature on the degradation of 4 biogenic amines by Limosilactobacillus fermentum FSCBAD033
2.5.4 初始pH值对菌株FSCBAD033降解生物胺的影响
由图9可知,菌株FSCBAD033对4种生物胺的降解率均随初始pH值的升高呈现先上升后下降的趋势,菌株FSCBAD033在初始pH值5~7的范围内对4种生物胺的降解率均>50%,其中,在初始pH值4~7的范围内可全部降解酪胺,腐胺(86.7%)、尸胺(82.4%)和组胺(78.4%)最高降解率的初始pH值分别是5、5和7;当初始pH值为2时,菌株FSCBAD033对4种生物胺均未表现出明显的降解活性。因此,菌株FSCBAD033在初始pH值5~7的范围内,能保持较好的生物胺降解活性。
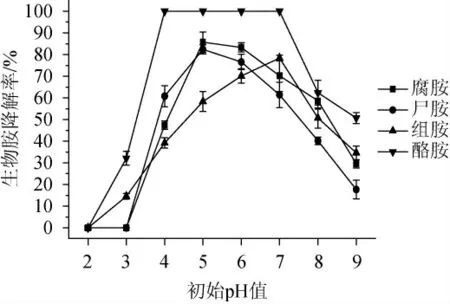
图9 初始pH值对发酵柠檬乳杆菌FSCBAD033降解四种生物胺的影响Fig.9 Effect of initial pH on the degradation of 4 biogenic amines by Limosilactobacillus fermentum FSCBAD033
2.5.5 NaCl含量对菌株FSCBAD033降解生物胺的影响
由图10可知,菌株FSCBAD033对4种生物胺的降解率整体上随NaCl含量的升高呈现先平稳后下降的趋势,菌株FSCBAD033在NaCl含量<6%的范围内对4种生物胺的降解率均>50%,其中,在NaCl含量不高于3%的范围内可全部降解酪胺,当NaCl含量>18%时,菌株FSCBAD033对4种生物胺的降解率均低于50%;当NaCl含量>24%时,菌株FSCBAD033对4种生物胺均未表现出明显的降解活性。因此,菌株FSCBAD033在NaCl含量<6%的范围内,能保持较好的生物胺降解活性。
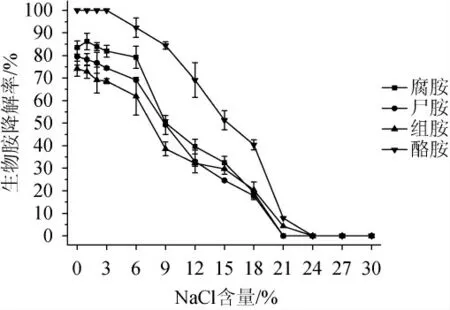
图10 NaCl含量对发酵柠檬乳杆菌FSCBAD033降解四种生物胺的影响Fig.10 Effect of NaCl content on the degradation of 4 biogenic amines by Limosilactobacillus fermentum FSCBAD033
3 结论
本研究从发酵3个月的鱼露样品中筛选到一株高效生物胺降解乳酸菌菌株FSCBAD033,经形态学观察、碳源利用情况分析和分子生物学鉴定,确定该菌株为发酵柠檬乳杆菌(Limosilactobacillus fermentum)。该菌株在0.05 mol/L pH=6.0的磷酸盐缓冲液(含3%NaCl和腐胺、尸胺、组胺、酪胺各100 mg/L)中,37 ℃条件下静置保持24 h后可降解86.4%腐胺、78.5%尸胺、72.3%组胺和100%酪胺,且在含有前体氨基酸的培养基中不积累上述4种生物胺。菌株FSCBAD033在温度25~40 ℃、初始pH值4~8、NaCl含量1%~15%的范围内生长良好,在温度30~40 ℃、初始pH值5~7、NaCl含量<6%的范围内对腐胺、尸胺、组胺和酪胺的降解率均>50%。本研究筛选到的高效生物胺降解菌菌株FSCBAD033,有潜力作为功能发酵剂用于降低食品中的生物胺含量,研究数据也为其应用对象的选择提供重要参考。

