肺结核患者标准治疗过程中GSTs基因多态性与抗结核药物血药浓度相关性研究
张 敏,李星星,何 霞,袁 丽,程 希,童荣生
(1.成都中医药大学附属医院药学部,四川 成都 610071;2.四川省医学科学院·四川省人民医院药学部,四川 成都 610072;3.电子科技大学医学院/个体化药物治疗四川省重点实验室,四川 成都 610072)
谷胱甘肽-S-转移酶(Glutathione S-tranaferase,GSTs)是一种由多个亚家族组成二相代谢酶,GSTM1、GSTT1和GSTP1是其主要的亚组成员,在消除有毒中间代谢物中发挥着重要作用[1,2]。目前GSTM1、GSTT1和GSTP1与抗结核药物诱导的肝损伤(druginduced liver injury during anti-TB treatment,AT-DILI)相关性研究存在争议[3,4],而GSTM1、GSTT1和GSTP1与抗结核药物异烟肼、利福平等血药浓度具有相关性却鲜有报道。本文将研究肺结核患者的GSTs基因多态性与结核标准治疗方案治疗后血浆中抗结核药物血药浓度的相关性,为进一步研究GSTs与AT-DILI相关性提供临床基础数据。
1 资料与方法
1.1 一般资料本研究经成都中医药大学附属医院和四川省医学科学院·四川省人民医院伦理委员会批准,采用前瞻性研究的方法纳入2019年1月至 2020年12月在成都中医学院附属医院和四川省医学科学院·四川省人民医院诊断为肺结核的60名住院治疗患者。纳入标准:①根据世界卫生组织《结核病管理指南》以及中国《抗结核药物性肝损伤诊治指南(2019年版)》[5,6]确诊的或临床诊断为肺结核的患者;②年龄16~70周岁。排除标准:①不使用异烟肼等一线抗结核药物标准治疗方案进行治疗的患者;②不能获取患者抗结核药物前后完整相关生化指标检测值或数据情况的病例;③入组前肝功能异常或合并患有病毒性肝炎,脂肪肝等对肝功很大影响的患者;④合并服用有其他说明书中肝毒性为主要不良反应药物的患者,如化疗药物、部分抗菌药物、大剂量对乙酰氨基酚等。
在接受抗结核治疗前应用聚合酶链反应 (PCR)-芯片杂交技术测定 GSTs基因亚组GSTM1、GSTT1和GSTP1位点的基因型。开始抗结核治疗日期,抗结核治疗药物及其剂量,检测异烟肼、利福平、吡嗪酰胺三种目前血药浓度与AT-DILI发生相关性较明确的药物血药浓度[7~10]。
1.2 方法
1.2.1给药方案 按照世界卫生组织推荐的一线抗结核治疗方案为:异烟肼(INH)、利福平(RFP)、乙胺丁醇(EMB)和吡嗪酰胺(PZA)强化治疗2个月,INH+ RFP巩固治疗4个月(2IREP+4IR)方案进行治疗。在抗结核治疗开始后7天采集患者外周血,应用超高效液相色谱串联质谱法(UPLC-MS/MS)法测定血浆中抗结核药物浓度,分析 GSTs基因多态性与标准结核治疗后抗结核药物血药浓度之间的关系。
1.2.2试剂与仪器 血液基因组离心柱型DNA提取试剂盒,中国北京天根生化科技有限公司;GSTP1 Taqman SNP 基因分型试剂盒,美国ApliedBpiosystem公司;GSTM1 / GSTT1基因分型试剂盒,美国Thermo Fisher Scientific公司;GSTM1 / GSTT1primer,美国 Invitrogen公司;异烟肼标准品规格:每支100 mg,批号:100578-200401,中国食品药品检定研究院;吡嗪酰胺标准品规格:每支100 mg,批号:100178-201104,中国食品药品检定研究院;利福平标准品规格:每支100 mg,批号:130496-201403,中国食品药品检定研究院;NanoDrop 2000型核酸浓度测定仪,实时定量PCR仪ABI7500,美国Thermo Fisher Scientific公司产品;实时荧光定量PCR仪LightCycler®480 II,德国Roche公司;德国Eppendorf公司;Rapid ResolutionZORBAX SB-Aq (3.0*50 mm,1.8 um),安捷伦公司。
1.2.3基因检测 ①引物:GSTM1(219 bp)的引物为:Forward:5’-GAACTCCCTGAAAAGCTAAAGC-3’;Reverse:5’-GTTGGGCTCAAATATACGGTGG-3’[11],GSTT1(257 bp)的引物为:Forward:5’-TTCCTTACTGGTCCTCACATCTC-3’;Reverse:5’-GGAAAAGGGTACAGACTGGGGA-3’。BCL为阳性内参,用来排除假阴性结果,BCL (154 bp)的引物为:Forward:5’-GCAATTCCGCATTTAATTCATGG-3’;Reverse:5’-GAAACAGGCCACGTAAAGCAAC-3’。② PCR反应扩增条件为:95 ℃ 10 min,95 ℃ 5 s,62 ℃ 15 s,72 ℃ 20 s共38个循环,设置温度改变速率为20 ℃/s。结凝曲线温度为:95 ℃ 5 s,65 ℃ 20 s,最后以0.2 ℃/s 速率升温至98 ℃,实验方法详见参考文献[12]。
1.3 统计学方法采用SPSS 26.0统计软件进行统计分析处理,符合正态分布的计量资料采用均数±标准差表示,采用t检验进行比较;不符合正态分布数据以M(Q1,Q3)表示,组间比较采用非参数检验统计分析。P< 0.05为差异有统计学意义。
2 结果
2.1 一般资料60例患者中男42例(70%),女18例(30%),汉族人群58例(96.7%),藏族2例(3.3%),年龄17~86岁,体重37~75 kg,BMI 15.37~26.22 kg/m2,异烟肼的血药浓度为0.25~2.11 μg /ml,利福平0.25~19.75 μg /ml,吡嗪酰胺1.00~63.39 μg /ml。
2.2 患者GSTs检测基本情况GSTM1基因突变22例,突变频率为36.7%;GSTT1基因突变27例,基因突变频率为45.0%;GSTP1基因中,野生型(AA型)37例,杂合型(AG型)22例,纯合突变型(GG型)1例,总突变频率(AG型+GG型)为23例。
2.3 基因分布信息Hardy-weinberg遗传平衡检验Hardy-weinberg遗传平衡检验显示,GSTM1的基因分布频率与药物基因组库 (PharmGKB)中215名中国人的基因分布频率满足Hardy-weinberg遗传平衡 (P>0.05);GSTT1的基因分布频率与药物基因组库中445名中国人群的基因分布频率满足Hardy-weinberg遗传平衡(P>0.05);GSTP1的基因分布频率与药物基因组库中286位中国人群的基因分布相符(P>0.05)。
2.4 方法学验证
2.4.1精密度试验 对异烟肼、吡嗪酰胺、利福平血药浓度检测进行了低、中、高药物浓度(异烟肼、利福平1.0、5.0、40.0 μg/ml;吡嗪酰胺4.0、20.0、160.0 μg/ml)的精密度试验,批内、批间精密度CV值均≤15%满足要求。
2.4.2稳定性试验 对异烟肼、吡嗪酰胺、利福平血药浓度检测低、中、高药物浓度药物(异烟肼、利福平1.0、5.0、40.0 μg/ml;吡嗪酰胺4.0、20.0、160.0 μg/ml)的室温、冻融稳定性进行了试验,相对偏差均<15%,异烟肼、吡嗪酰胺、利福平样品可在室温下维持8 h的稳定性,样品冻融3次检测结果仍稳定。
2.5 各基因型间血药浓度的比较
2.5.1不同基因型的血药浓度比较 GSTM1 基因未突变组异烟肼、利福平、吡嗪酰胺血药浓度与GSTM1突变组相比较,差异无统计学意义(P>0.05);GSTT1 基因未突变组异烟肼、利福平、吡嗪酰胺血药浓度与GSTT1缺失突变组比较,差异无统计学意义(P>0.05);GSTP1 AA组、AG组、GG组异烟肼、利福平、吡嗪酰胺血药浓度相比较,差异无统计学意义(P>0.05)。吡嗪酰胺血药浓度中位数GSTP1 AG+GG组为6.032(7.360) μmol/ml,GSTP1 AA组为11.74(21.170) μmol/ml,两组间差异有统计学意义(P< 0.05)。见表1。
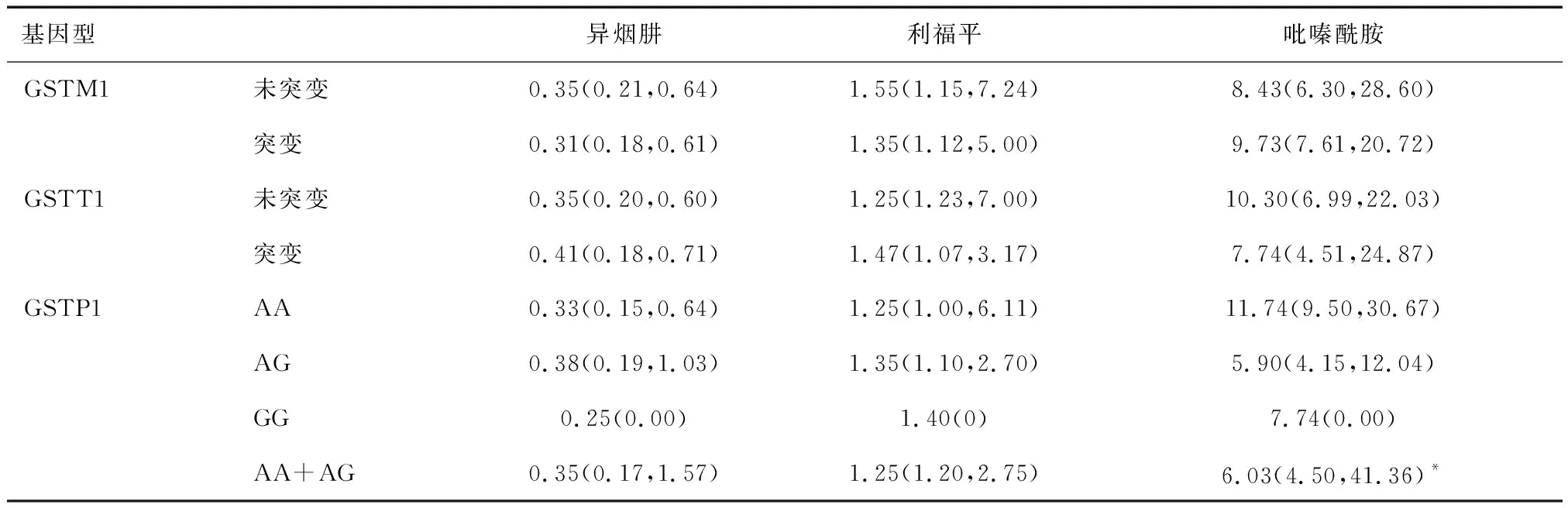
表1 不同基因型的血药浓度比较 (μmol/ml)
2.5.2GSTM1&GSTT1不同基因型与异烟肼、利福平、吡嗪酰胺血药浓度相关性 GSTM1&GSTT1单突变型/缺失型或双突变型/缺失型四组间异烟肼、利福平、吡嗪酰胺血药浓度比较,差异无统计学意义(P>0.05),见表2。
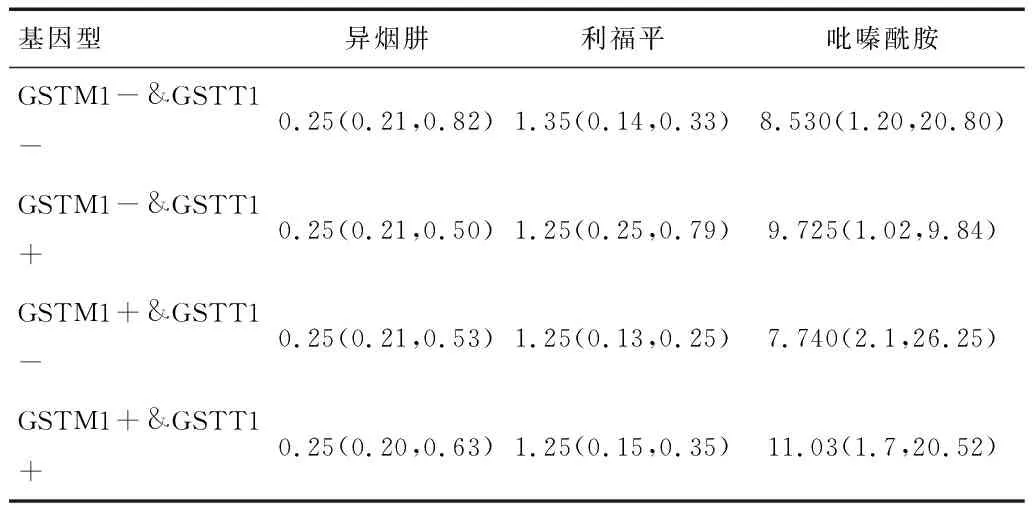
表2 GSTM1&GSTT1不同基因型的血药浓度比较 (μmol/ml)
3 讨论
GSTs通过催化谷胱甘肽(GSH)与具有亲电官能团的底物相互反应且促进反应产物排出体外发挥解毒作用[13],对有毒中间代谢物的形成和解毒有重要影响,其家族GSTM1和GSTT1的基因型是目前国内外研究较多的目标基因,其与AT-DILI相关性目前研究仍存在争议。GSTs基因多态性与抗结核药物性肝损伤的相关性却鲜有报道。本次研究的患者异烟肼均采用0.3 g/d的剂量给药,其平均血药浓度为0.46 mg/L,高于文献中的临界浓度值0.2 mg/L[14],GSTs会加速异烟肼有毒代谢物转化为极性物质从而排出体外,根据化学平衡原理,体内有毒代谢物减少,则异烟肼转化为有毒代谢物的转化速率也可能会增快,从而间接影响异烟肼的血药浓度。然而本次实验的数据分析显示GSTs的突变对异烟肼的血药浓度无明显相关性,从而推测GSTs并非影响异烟肼血药浓度的主要因素。利福平的有效临界血药浓度为0.0625 mg/L[14,15],本次研究的患者利福平平均血药浓度为1.57 mg/L,且在GSTs突变组和未突变组之间没有显著差异,GSTs酶不是利福平诱导的AT-DILI的主要因素。
吡嗪酰胺的血药浓度对结核杆菌的抑制效果有重要作用[16],同样也可能对不良反应的发生有影响。本研究结果显示GSTP1 rs1695不同基因型的吡嗪酰胺血药浓度有差异,证明GSTP1的基因多态性影响吡嗪酰胺血药浓度,这一发现在之前的文献研究中并无报道,为进一步研究GSTs与抗结核药物血药浓度以及AT-DILI相关性的研究提供了新的基础数据参考。基于本研究样本量有限,仅进行了GSTs基因多态性与异烟肼、利福平、吡嗪酰胺血药浓度之间的单因素相关性分析,然而AT-DILI的发生是一个多因素影响结果,在今后的研究中会进一步设立多中心大样本的研究,可对更多的因素进行探讨,建立预测AT-DILI发生的模型,为结核患者的个体化用药治疗提供临床参考工具。

