盐胁迫下外源2,4-表油菜素内酯对颠茄氮代谢及TAs代谢的影响
辛正琦 代欢欢 辛余凤 何 潇 谢海艳 吴能表,*
盐胁迫下外源2,4-表油菜素内酯对颠茄氮代谢及TAs代谢的影响
辛正琦1代欢欢2辛余凤1何 潇1谢海艳1吴能表1,*
1西南大学生命科学学院/ 三峡库区生态环境教育部重点实验室, 重庆 400715;2甘肃庆阳市第五中学, 甘肃庆阳 745000
以颠茄(L.)幼苗为材料, 采用盆栽试验, 使用外源2,4-表油菜素内酯(2,4-Epibrassinolide, EBR)处理幼苗, 研究在100 mmol L-1 NaCl胁迫下不同浓度(0.05、0.1、0.2、0.4 mg L-1)外源EBR在不同处理时间(5、10、15、20 d)内对颠茄氮代谢、次生代谢产物含量以及托品烷类生物碱(tropane alkaloids, TAs)合成途径中前体物质含量、关键酶基因表达量的影响, 旨在明确外源EBR调控颠茄耐盐性的生理机制。盐胁迫下颠茄氮代谢受到抑制, 而施加外源EBR能够有效增强颠茄的氮代谢能力, 硝态氮含量显著升高, 铵态氮含量降低, 游离氨基酸、可溶性蛋白含量以及氮代谢关键酶活性均有不同程度的上升。盐胁迫不利于生物碱的合成和积累, 显著降低了TAs途径中前体物质的合成和关键酶基因的表达。外施0.1 mg L-1 EBR能够有效提高鸟氨酸、精氨酸、多胺含量以及腐胺合成关键酶活性, 并通过上调TAs途径中关键酶基因的表达量来提高莨菪碱和东莨菪碱的含量。表明适宜浓度的外源EBR能够有效缓解盐胁迫对颠茄生理代谢的破坏, 通过提高氮代谢能力、促进TAs的产生和积累, 提高颠茄幼苗的耐盐性。
颠茄; 盐胁迫; 氮代谢; 次生代谢
颠茄(L.)也叫做“颠茄草”、“美女草”、“野山茄”, 属于茄科颠茄属的一种多年生草本植物, 其叶、草粉及根均可入药[1]。2010年版《中国药典》收录并规定其为唯一的托品烷类生物碱(tropane alkaloids, 简称TAs)的药源植物, 在临床上应用广泛。
土壤盐渍化现象已成为一个世界性的资源和环境问题, 对人类社会进步和发展造成严重的影响, 在社会上受到越来越多的关注[2]。目前, 我国土地面积中约有1/4为盐渍土, 并且由于灌溉不合理、气候变化等因素, 导致盐渍土面积仍在逐年增加[3]。土壤中盐浓度过高会造成盐胁迫, 盐胁迫会对植物的生长以及多种生理代谢过程造成不同程度的影响, 严重时甚至导致植株死亡[4], 严重抑制了植物生长发育以及农林业生产。任文奇等[5]研究发现, Ca(NO3)2胁迫使2种甜瓜幼苗体内铵态氮含量升高, 氮代谢关键酶活性降低, 从而严重影响了甜瓜幼苗的氮代谢平衡, 且自身可以通过不同方式积累氨基酸来缓解胁迫。还有研究发现, 短时间的NaCl处理可使甘草次生代谢产物含量的提高, 而长时间高浓度的NaCl胁迫抑制其次生代谢, 甘草酸含量显著下降[6]。
油菜素内酯(brassionolide, BR), 也称芸薹素, 是1970年首次在油菜花粉中发现第六大类植物激素。油菜素内酯在植物界中广泛存在, 具有协调植物体内多种内源激素的相对水平, 促进生长发育、次生代谢及提高植物抗逆性多种生理功能[7], 因此被广泛使用于农林业生产。张华等[8]在滇紫草细胞悬浮培养体系中加入适宜浓度的BR, 可显著促进紫草素的形成。并显著增强了植物次生代谢途径中关键酶之一苯丙氨酸裂解酶的活性。池剑亭等[9]研究发现, 外施BR处理青蒿, 能使青蒿素生物合成相关的关键酶基因、和的表达上调, 进而显著提高了青蒿素的含量。迄今为止, 研究者已从植物中分离鉴定出70多种类似于BR的化合物, 统称为油菜素内酯。但植物体内含有的油菜素内酯的非常少, 因此科研人员一般采用人工合成的BRs来进行科学研究, 其中2,4-表油菜素内酯(EBR)就是人工合成的高活性油菜素内酯类似物。
本试验以颠茄幼苗为材料, 采用室内模拟盐胁迫环境, 通过喷施不同浓度EBR研究盐胁迫下外源EBR对颠茄氮代谢及次生代谢的影响, 并对其调控机理进行初步探究, 以期缓解盐胁迫对颠茄生长造成的胁迫伤害, 提高颠茄的抗逆性。为实际生产过程中解决盐害问题提供一定的理论依据, 同时为提高颠茄次生代谢产物含量提供参考。
1 材料与方法
1.1 材料及处理
颠茄(L.)种子, 由西南大学三峡库区生态环境教育部重点实验室提供。挑选健康的颠茄种子, 用50 mg L-1赤霉素溶液浸泡2 d后, 取出用清水清洗干净, 然后均匀地铺在湿润的滤纸上, 25℃条件下进行萌发, 每隔24 h浇1次水。种子萌发出苗后, 移栽至直径12 cm, 高10 cm的营养钵中, 基质配比为泥炭土∶珍珠∶岩蛭石=3∶1∶1, 每钵3株, 共300钵, 每7 d浇灌1次稀释10倍的MS营养液, 光照周期为12 h, 光照强度为5000mmol m-2s-1; 培养温度为25℃/20℃ (昼/夜); 相对湿度为60%~70%。生长45 d后, 挑选300钵长势基本一致的颠茄苗进行NaCl胁迫试验。
将NaCl溶于稀释10倍的MS营养液中, 配制成100 mmol L-1 NaCl溶液浇灌颠茄植株来提供盐胁迫环境。共设4个不同浓度梯度的EBR溶液, 于每天上午定时对叶片喷施对应浓度的EBR溶液至液体欲滴, 具体方式见表1。于NaCl胁迫的第5、10、15和20天时进行采样, 将采集的颠茄叶片一部分低温保存在-80℃冰箱中, 用于后续各项指标的测定。另一部分颠茄叶片放置于烘箱中烘干, 磨成细粉存放在干燥处, 用于生物碱和多胺含量的测定。另采集20 d时颠茄叶片、根组织材料, 放入液氮冷冻后转移至-80℃冰箱中, 用于相对基因表达量的测定。
1.2 测定方法
1.2.1 氮代谢相关指标的测定 参照李合生[10]方法测定硝态氮、游离氨基酸(free amino acids, FAA)和可溶性蛋白(soluble proteins, SP)含量; 参照汤绍虎和罗充[11]的方法测定谷氨酰胺合成酶(glutamine synthase, GS)活性; 采用上海优选生物科技有限公司的测试盒测定铵态氮、硝酸还原酶(nitrate reductase, NR)和谷氨酸脱氢酶(glutamate dehydrogenase, GDH)活性。
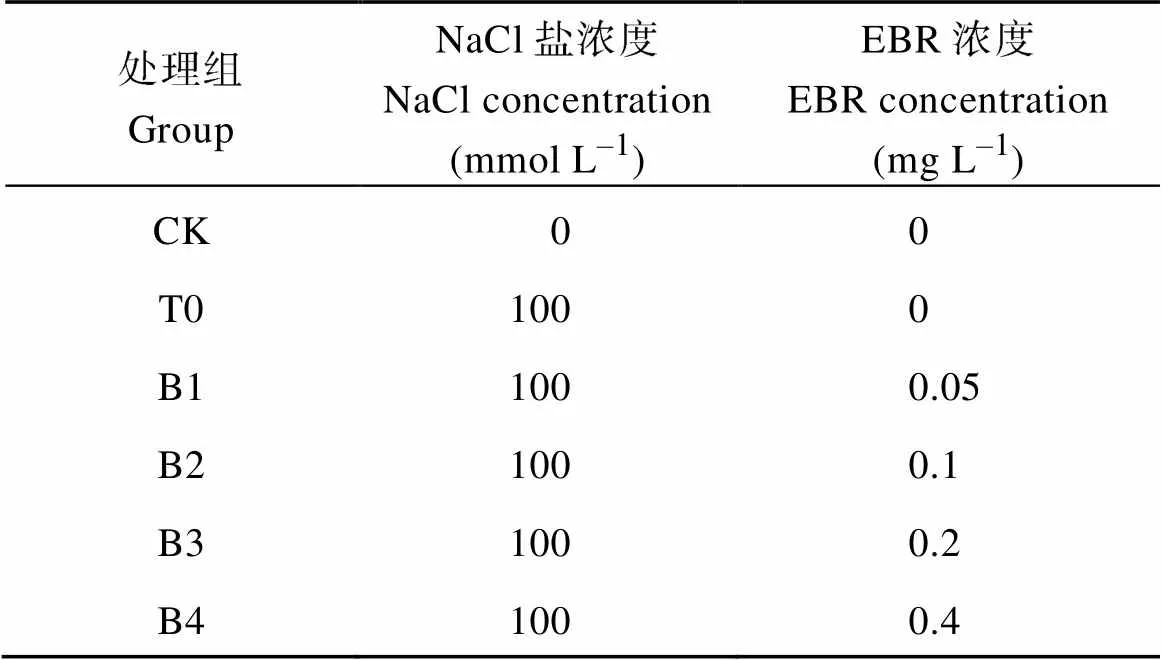
表1 颠茄幼苗的不同处理组合
1.2.2 生物碱含量测定 参照Zárate等[12]提取方法提取生物碱, 略改动。采用HPLC测定莨菪碱、东莨菪碱含量。色谱仪: 日本岛津(Shimadzu) LC-60A高效液相色谱仪(泵: LC-20AD、柱温箱: CTO-10AS vp、控制器: SPD-20A); 色谱柱: Xtimate-C18液相色谱柱(5 µm, 4.6 mm × 250.0 mm); 流动相: 甲醇-醋酸缓冲液(20 mmol L-1醋酸铵, 0.1%甲酸, pH 4.0, 体积比1∶4); 进样量: 10 µL; 检测波长: 226 nm; 流速: 1.0 mL min-1; 柱温: 40℃。
1.2.3 多胺合成相关指标的测定 参照黄爱清等[13]方法测定鸟氨酸含量, 参照胡桂娟等[14]方法测定精氨酸含量, 均略有改动; 称取处理至20 d的颠茄叶片0.1 g, 参照赵福庚和刘友良[15]方法测定鸟氨酸脱羧酶(ornithine decarboxylase, ODC)和精氨酸脱羧酶(arginine decarboxylase, ADC)活性, 略有改动; 参照康朵兰[16]方法提取并甲酰化叶片中的游离多胺, 样品液过0.45 μm滤膜后采用HPLC测定多胺含量。色谱仪、色谱柱同上; 流动相为: 甲醇∶水= 64∶36; 流速: 0.7 mL min-1; 检测波长: 230 nm; 柱温: 30℃; 进样量: 10 µL。
1.2.4 生物碱合成途径中关键酶基因表达量的检测 按照Biospin多糖多酚植物总RNA提取试剂盒使用说明提取总RNA。按照Hifair II 1st Strand cDNA Synthesis SuperMix for qPCR (gDNA digester plus)说明书操作步骤进行颠茄根、叶RNA的逆转录, 合成用于荧光定量所需的cDNA模板。根据NCBI上公布的序列及参照强玮等[17-18]的引物序列设计和基因引物, 参照邱飞等[19]的引物序列设计基因引物, 由英潍捷基(上海)贸易有限公司合成(表2)。以反转录得到的cDNA作为模板, 使用Promega GoqPCR Master Mix (A6001)试剂盒进行荧光定量PCR。以为内参基因[20], 样本和内参基因分别设3个重复和1个阴性对照, 基因表达量均以内参基因作为标准进行相对定量, 采用2-ΔΔCt法计算。
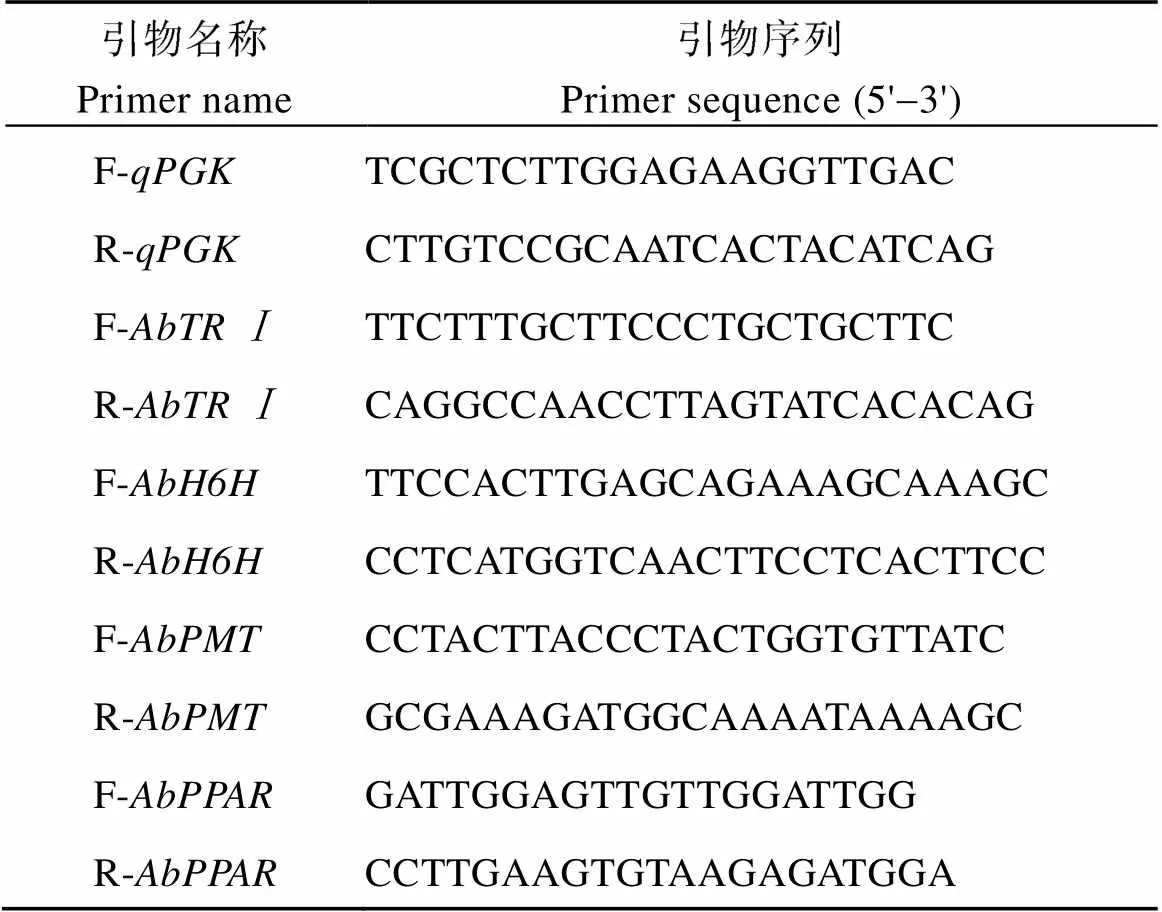
表2 荧光定量PCR检测所用引物
1.3 数据处理
2 结果与分析
2.1 盐胁迫下外源EBR处理后颠茄幼苗的生长情况
由图1可知, 与CK组相比, T0组颠茄的生长受到了明显的抑制, 出现叶面积减小、植株矮小等显著症状。添加不同浓度的外源EBR后, 颠茄的生长均有不同程度的恢复, 其中B2、B3组长势较好。表明外源EBR能够缓解盐胁迫处理对颠茄叶形成和发育的抑制作用。
2.2 外源EBR对盐胁迫下颠茄叶片中含氮化合物含量的影响
硝态氮(NO3--N)和铵态氮(NH4+-N)是2种主要的无机氮源, 能够转化形成游离氨基酸、可溶性蛋白等有机含氮化合物, 供植物利用[21], 含氮化合物的含量可以反映氮代谢的水平。由表3可知, 盐胁迫下颠茄叶片中硝态氮含量较对照显著下降, 且随着胁迫时间的延长, 下降程度增加。铵态氮含量在胁迫初期(5 d)时, 较对照组CK有所下降。而在胁迫的第10、15和20天时, T0组的铵态氮含量显著提高, 分别较CK组提高19.240%、56.082%和75.282%。喷施不同浓度EBR后显著提高了颠茄叶片中硝态氮的含量, 降低了铵态氮的含量。第20天时, 0.1 mg L-1的EBR处理效果最显著, 较T0组硝态氮显著提高51.577%, 而铵态氮显著降低33.691%。盐胁迫下, 颠茄叶片中游离氨基酸和可溶性蛋白较对照组均显著下降。20 d时, 二者含量降到最低, 较CK组分别降低22.788%和33.346%。经不同浓度EBR处理后, 二者含量较CK2组显著提高,总体来看, 0.1 mg L-1、0.2 mg L-1 EBR的处理效果最为显著。表明外源EBR能够缓解盐胁迫对颠茄叶片NO3--N同化的抑制作用, 加速NH4+-N的代谢速度, 提高游离氨基酸和可溶性蛋白含量, 改善了盐胁迫下颠茄氮代谢的进程。
处理同表1。标尺为10 cm。
Treatments are the same as those given in Table 1. Bar: 10 cm.
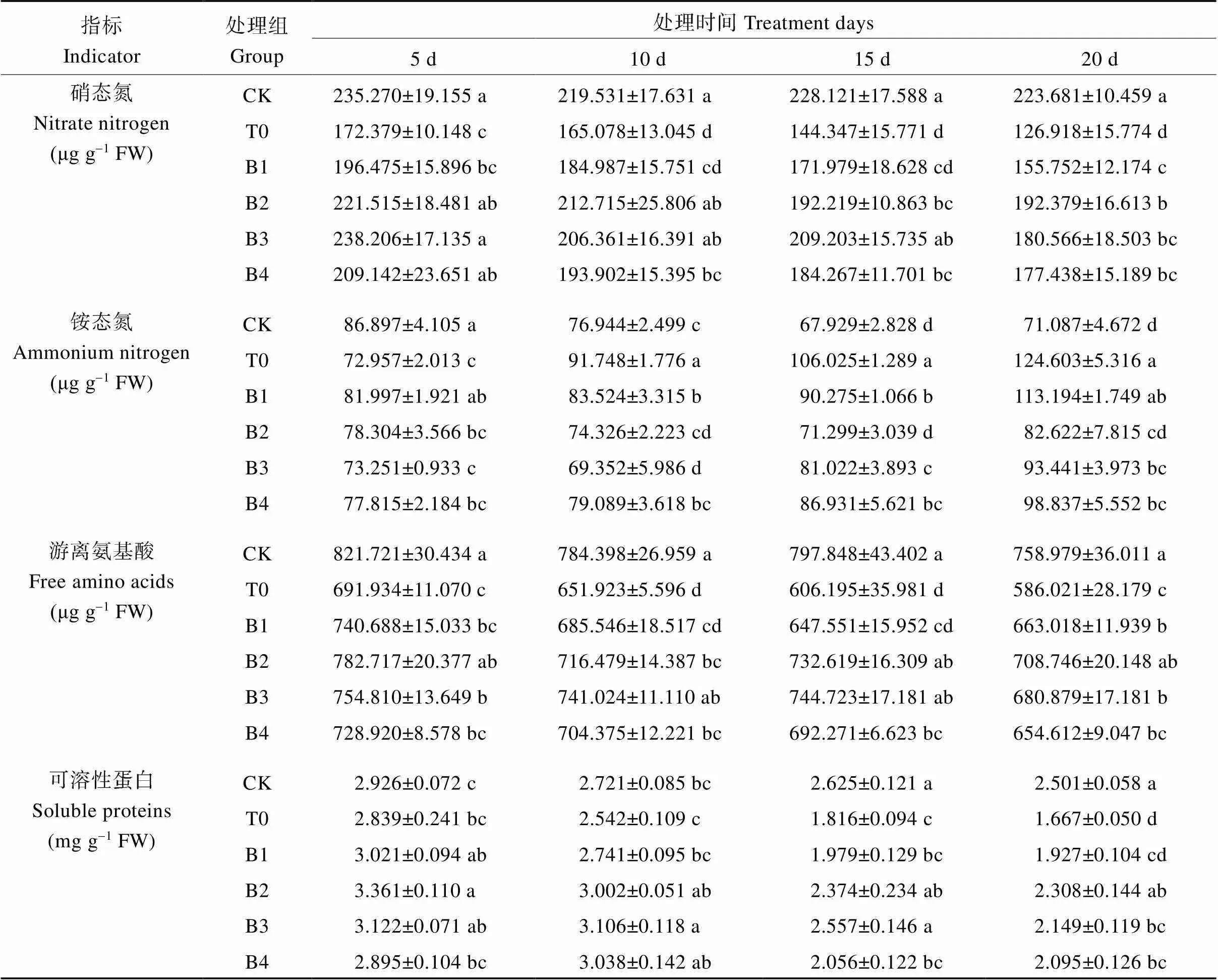
表3 不同浓度外源EBR对盐胁迫下颠茄叶片含氮化合物含量的影响
同列数据不同小写字母表示同一指标不同处理间在0.05水平差异显著。处理同表1。
Values within a column followed by different lowercase letters represent significantly different at the 0.05 probability level in the same indicator among the treatments. Treatments are the same as those given in Table 1.
2.3 外源EBR对盐胁迫下颠茄氮代谢关键酶活性的影响
硝酸还原酶(NR)、谷氨酰胺合成酶(GS)和谷氨酸脱氢酶(GDH)在植物氮代谢途径中起着关键作用。由表4可知, 与对照相比, 盐胁迫下颠茄叶片中NR、GS和GDH的活性均受到显著抑制, 除GDH活性在5 d时较CK略有升高, 随着胁迫时间的延长, 3种酶活性受到的抑制程度也越大。20 d时, T0组NR、GS和GDH活性较CK组分别降低45.416%、32.104%和34.982%。添加不同浓度EBR后, 3种酶的活性均有不同程度的升高, 且在各个处理时间内,随着EBR浓度的升高酶活性呈先上升后下降的趋势。整体来看, 0.1 mg L-1 EBR对于提高NR和GS活性效果最显著, 而对于GDH, 则是0.2 mg L-1 EBR的处理效果最好。表明, 短期盐胁迫可提高GDH活性, 但总体来看, 盐胁迫下NR、GS和GDH的活性均被抑制, 严重影响了氮代谢的进行。一定浓度的外源EBR可使NR、GS和GDH的活性增强, 提高了颠茄氮代谢速率, 从而缓解盐胁迫对颠茄氮代谢关键酶活性的抑制作用。
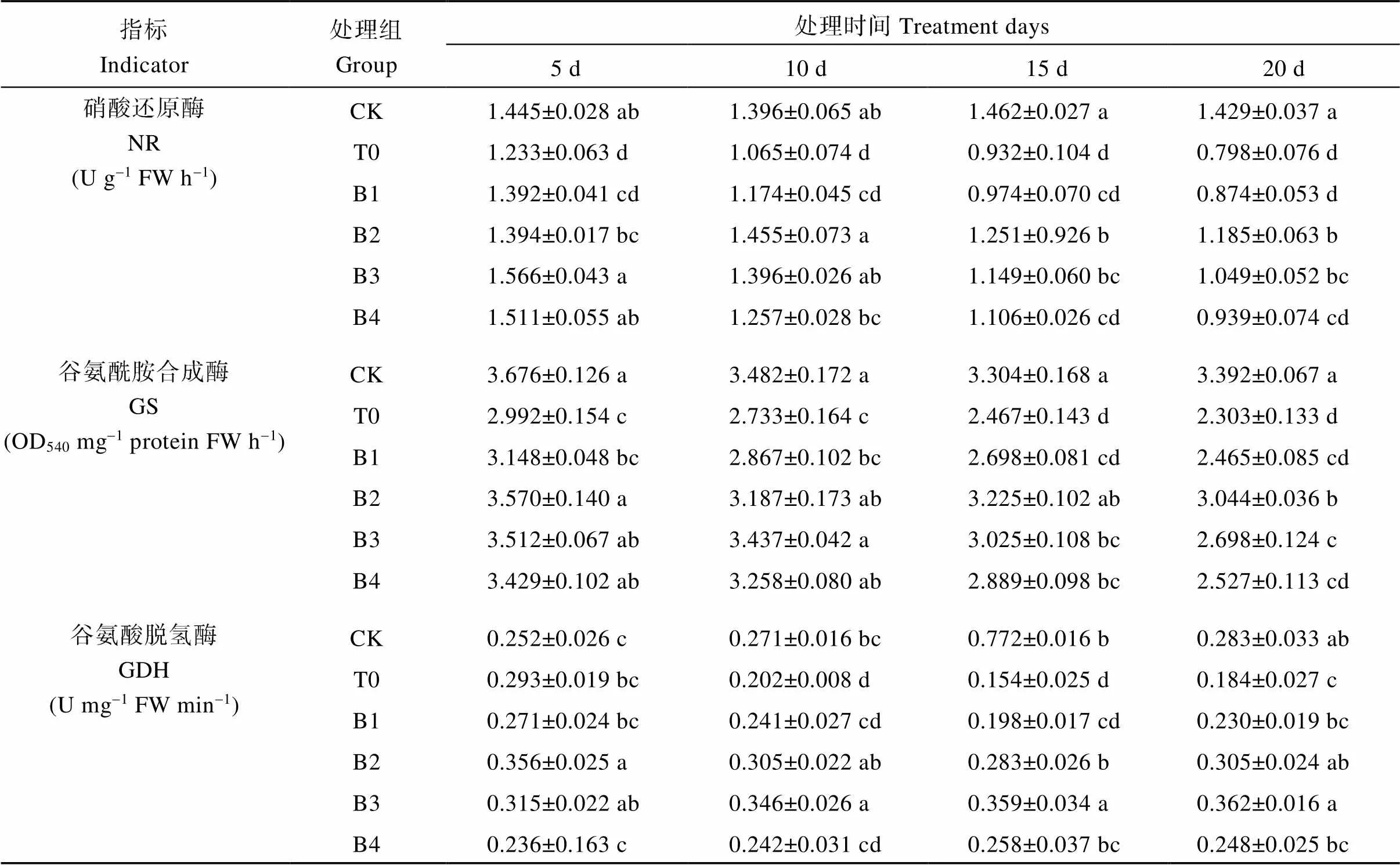
表4 不同浓度外源EBR对盐胁迫下颠茄叶片硝酸还原酶, 谷氨酰胺合成酶和谷氨酸脱氢酶活性的影响
同列数据不同小写字母表示同一指标不同处理间在0.05水平差异显著。处理同表1。
Values within a column followed by different lowercase letters represent significantly different at 0.05 probability level in the same indicator among treatments. NR: nitrate reductase; GS: glutamine synthase; GDH: glutamate dehydrogenase. Treatments are the same as those given in Table 1.
2.4 外源EBR对盐胁迫下颠茄叶片TAs含量的影响
颠茄中主要的次生代谢产物莨菪碱和东莨菪碱具有较高的药用价值。由图2可知, 处理5 d时, 盐胁迫下莨菪碱含量较CK组略有升高, 随着天数增加, 莨菪碱含量逐渐降低。而东莨菪碱在整个处理期内均显著低于CK组。添加不同浓度EBR处理后, 在同一处理时间下, 各处理组莨菪碱和东莨菪碱含量较T0组均有不同程度的回升, 且随着EBR浓度的升高表现出先增后降的趋势。20 d时, 0.1 mg L-1 EBR处理后莨菪碱和东莨菪碱含量最高, 分别是T0组的0.247倍和0.688倍。表明短期的盐胁迫处理可以促进莨菪碱的积累, 但随着盐胁迫时间的增加, 对颠茄生物碱的合成产生了显著的抑制作用。外施适宜浓度的EBR能够促进生物碱的积累, 表现在当EBR浓度为0.1 mg L-1时效果最佳。
2.5 外源EBR对盐胁迫下颠茄叶片鸟氨酸和精氨酸含量的影响
精氨酸和鸟氨酸既是氮代谢的产物, 也是TAs合成途径中的底物氨基酸, 为TAs的合成提供了前体物质。由图3可知, 盐胁迫下鸟氨酸和精氨酸含量均有所降低, 较对照组CK分别下降43.935%和26.569%。说明颠茄受到了盐胁迫的影响, 体内鸟氨酸和精氨酸的合成受到了抑制。添加不同浓度EBR处理后, 两者含量较单纯盐胁迫组有所增加, 随着EBR浓度的升高, 0.1 mg L-1 EBR处理时两者含量达到最高, 分别较T0组增加57.229%和25.219%, 随后含量又下降。说明适宜浓度的EBR可有效提高盐胁迫下颠茄叶片中精氨酸和鸟氨酸的含量。
不同小写字母表示处理间在0.05水平差异显著。处理同表1。
Different lowercase letters represent significantly different at the 0.05 probability level among the treatments. Treatments are the same as those given in Table 1.
不同小写字母表示处理间在0.05水平差异显著。处理同表1。
Different lowercase letters represent significantly different at the 0.05 probability level among treatments. Treatments are the same as those given in Table 1.
2.6 外源EBR对盐胁迫下颠茄叶片多胺含量的影响
多胺(polyamines, PAs)是一类普遍存在于生物体代谢过程中具有生物活性的低分子量脂肪族含氮碱[22]。主要由腐胺(putrescine, Put)、精胺(spermine, Spm)和亚精胺(spermidine, Spd) 3种形式组成。图4-A为处理20 d时颠茄叶片中多胺含量的变化情况, 表明各处理组中Put含量最高, 盐胁迫显著降低了Put和Spd的含量, 而Spm较对照组CK有略微升高。不同浓度EBR处理下, 相较于T0组, 各处理组中3种多胺含量均有显著升高, T3处理组中Put和Spd含量升高最多, 而B2组中Spm含量增长幅度最多; B2组和B3相比, Put含量更低, Spd含量虽然略低于B3组但并不显著。图4-B为多胺总量的变化情况, 可以看出, 盐胁迫使多胺总量显著降低, 喷施EBR后有所缓解, 其中以0.1 mg L-1、0.2 mg L-1 EBR处理效果较好, 两组之间差异性不显著。说明, 长时间盐胁迫处理不利于颠茄叶片中多胺的积累, Put、Spd及多胺总量较CK均显著下降, 0.1 mg L-1、0.2 mg L-1 EBR能使多胺含量及多胺总量均维持在较高水平。
2.7 外源EBR对盐胁迫下颠茄叶片ODC和ADC酶活性的影响
为明确EBR对盐胁迫下Put的影响机制, 测定了盐胁迫处理20 d时颠茄叶片中ODC和ADC的活性。由图5可知, 盐胁迫降低了颠茄叶片中ODC和ADC的活性, 分别较CK组下降20.697% 和30.855%。喷施不同浓度EBR后酶活性均有一定程度的增加, 且2种酶的变化趋势相似, 同时在0.1 mg L-1、0.2 mg L-1 EBR处理下活性最高, 2组之间无显著性差异。根据各组Put含量的变化情况来看, B3组中Put含量最高且显著高于B2组, 而B2与B3组中ODC与ADC活性却相差不大, 再结合B2处理组下生物碱含量增加, 推测Put的积累较少是由于生成的Put迅速进入次生代谢途径中用于TAs的合成造成的。
不同小写字母表示处理间在0.05水平差异显著。处理同表1。
Different lowercase letters represent significantly different at the 0.05 probability level among treatments. Treatments are the same as those given in Table 1.
不同小写字母表示处理间在0.05水平差异显著。处理同表1。
Different lowercase letters represent significantly different at the 0.05 probability level among treatments. Treatments are the same as those given in Table 1.
2.8 外源EBR对盐胁迫下颠茄根、叶中TAs合成关键酶基因表达量的影响
托品酮还原酶I (tropinone reductase I, TR I)、甲基-腐胺-转移酶(putrescine n-methyltransferase, PMT)、莨菪碱6β-羟基化酶(hyoscyamine 6β-hydroxylase, H6H)和苯丙酮酸还原酶(phenylpyruvate reductase, PPAR)是从颠茄中已经鉴定出的TAs合成途径中的关键酶, 其相应编码基因的表达量直接决定合成途径的中间产物流向及生物碱的产量。表明, 颠茄中、和的表达具有组织特异性, 只在根中表达, 因此本试验仅在叶片中检测到明显表达。由图6可知, 盐胁迫20 d时, 颠茄叶片中T0组的表达量较CK组有所上升。经0.1 mg L-1 EBR处理后, B2组中的表达量与T0组相比得到了显著提高, 且根和叶中的表达情况基本相同。是TAs合成途径中的中间分支点基因, 其高效表达可促进托品烷类生物碱直接前提物质托品的生成。盐胁迫20 d时颠茄根中T0组、和的相对表达量较CK组均有所降低, 其中的表达量降低幅度较大。在盐胁迫下喷施0.1 mg L-1 EBR处理后, 显著提高了的相对表达量,是下游的重要基因, 高水平的表达可促进莨菪碱转化为东莨菪碱。说明, 盐胁迫抑制了根中、和的表达水平, 但可使根和叶中的相对表达量上调; 而外施0.1 mg L-1 EBR对、、和的表达量均有一定的提高, 其中对和表达量上调的诱导效果更为显著, 有效缓解了盐胁迫对2个基因表达量的抑制作用。
3 讨论
氮代谢作为植物初生代谢的一种重要途径, 对植物生长发育和新陈代谢有重要影响。本研究中, NaCl胁迫对植株幼苗体内的氮代谢造成明显的抑制作用。Yuan等[23]研究表明, 外源EBR能够通过提高植物氮代谢能力缓解盐胁迫对自身造成的伤害, 从而增强其在非生物逆境环境下的抗性。马月花等[24]的研究表明, EBR可以通过增强黄瓜根系NR活性及叶片NAD+-GDH活性, 增强硝酸还原, 加强氮代谢, 从而缓解逆境对植株的伤害。寇江涛[25]研究发现, 盐胁迫下喷施外源EBR能够显著增强苜蓿幼苗体内NR、GS和GOGAT活性, 提高植物氮代谢能力。本试验也得到了类似的结果, 0.1 mg L-1和0.2 mg L-1EBE能够促进游离氨基酸和可溶性蛋白的积累, 显著提高了颠茄氮代谢关键酶的活性, 有利于硝态氮的吸收和转运, 以及铵态氮更多地向Glu转化, 铵态氮大量积累易产生氨毒, 抑制幼苗正常生长[26]。推测EBR通过提高颠茄氮代谢能力来增强自身的抗盐性(图7)。
不同小写字母表示处理间在0.05水平差异显著。处理同表1。
Different lowercase letters represent significantly different at the 0.05 probability level among treatments. Treatments are the same as those given in Table 1.
氮代谢与次生代谢产物的合成机制密切相关, 氮同化可以直接为生物碱的合成提供合成原料氨基酸精氨酸或者鸟氨酸, 进而影响生物碱合成。鸟氨酸在鸟氨酸脱羧酶(ODC)的催化作用下可直接催化脱羧形成TAs合成前体物质腐胺[27]; 精氨酸在精氨酸脱羧酶(ADC)的催化作用下生成精胺, 然后经过一系列酶促反应生成腐胺[28]。腐胺的继续转化有2个方向, 一是进入多胺生物合成途径, 可逆形成亚精胺(Spd)后, 亚精胺又可逆形成多胺生物合成的末端物质精胺(Spm); 二是在PMT催化下形成 N-甲基-腐胺, 直接进入到TAs合成途径。本试验结果显示, 盐胁迫下, 鸟氨酸和精氨酸含量均下降, 外源EBR处理后二者含量均显著增加, 从而为腐胺的合成提供更多的底物。有研究表明, ODC在颠茄TAs生物合成中起重要作用, 过量表达能够显著提高颠茄中腐胺, 莨菪碱的含量[29]。本研究中外源EBR能够有效增强ODC、ADC的活性, 减弱盐胁迫对ODC和ADC活性的降低。且EBR处理能够提高多胺含量, 缓解盐胁迫对多胺积累的抑制作用。研究表明, 多胺能够稳定膜的结构和功能, 提高活性氧清除酶(SOD、CAT和APX)的活性来降低活性氧的水平, 对植物环境胁迫过程中的信号转导以及生理代谢有重要作用[30]。推测EBR通过提高多胺含量来增强颠茄的抗盐性。本研究中, Put含量的增加更多, 而Spm含量的增加相对较少, 推测EBR能够使腐胺向亚精胺方向转化减少, 更多的进入TAs合成途径。结合表达水平上调的结果也可以验证此结论。在联系多胺合成和TAs合成中起着枢纽作用。
东莨菪碱和莨菪碱作为颠茄中重要的2种次生代谢产物, 具有很高的药用价值。已有研究表明, 油菜素内酯作为一种新型激素, 不仅可以提高植物的抗逆性也对植物次生代谢产物的积累有着促进作用。乔晶等[31]研究发现, BR处理可显著升高甘草的株高地茎, 并提高甘草酸、甘草苷等次生代谢产物的含量。本研究发现, 100 mmol L-1NaCl处理下, 东莨菪碱含量持续降低, 而莨菪碱含量仅在胁迫初期有所上高, 随后降低。说明较长时间的盐胁迫处理不利于颠茄叶片莨菪碱和东莨菪碱的积累, 这与杨怡[32]的研究结果相一致。外施不同浓度油菜素内酯能够有效缓解盐胁迫对颠茄生物碱合成的阻碍, 当EBR浓度为0.1 mg L-1时效果最好。为进一步研究外源EBR对盐胁迫下颠茄生物碱代谢的调控机制, 对20 d时3个处理组基因的相对表达量进行qRT-PCR检测发现, 盐胁迫降低了根中和的表达水平, 显著上调了根和叶中的表达量, 且表达量相较于其他关键酶基因处于较高水平, 说明根和叶中对于环境刺激更加敏感。的高效表达能够促进TAs的直接前体物质托品的合成; H6H是拓品烷类生物碱合成途径最末端的限速酶, 其高效表达能促进莨菪碱向东莨菪碱转化, 从而增加生物碱积累。本试验中, 外源EBR添加后能够有效促进和的高效表达, 而和的表达量虽有变化, 但仍低于和。推测EBR主要通过调节和表达水平提高生物碱的含量。有研究表明, 次生代谢物质在植物抵御和适应各种生物和非生物胁迫而获得生存的过程中起到重要作用[33], 推测盐胁迫下, EBR可能通过增强次生代谢途径, 使颠茄产生更多的次生代谢产物来增强自身的抗逆性(图7)。但是关于EBR下游是否存在信号分子直接调控TAs途径仍有待进一步研究。
红色代表显著上升; 绿色代表显著降低; 白色代表无明显变化; FAA: 游离氨基酸; SP: 可溶性蛋白; Orn: 鸟氨酸; Arg: 精氨酸; Hyo: 莨菪碱; Sco: 东莨菪碱。
Red represents a significant increase; green represents a significant decrease; white represents no obvious change; FAA: free amino acids; SP: soluble protein; Orn: ornithine; Arg: arginine; Hyo: hyoscyamine; Sco: scopolamine.
4 结论
0.1 mg L-1外源EBR处理可显著提高盐胁迫下含氮化合物的含量, 并诱导NR、GS和GDH活性升高, 使被吸收的无机氮源加速进行同化, 为TAs的合成提供物质基础; 同时降低铵态氮积累, 避免氨积累可能造成的对呼吸过程中电子传递系统的抑制。盐胁迫显著抑制了生物碱的合成和积累, 外源EBR能够显著增加TAs合成途径中前体物质多胺Put的含量、多胺合成关键酶活性, 并通过调控TAs途径上下游关键酶基因和的表达, 促进下游产物莨菪碱的合成以及莨菪碱向东莨菪碱转化。综上所述, 外源EBR可以通过调控盐胁迫下颠茄体内氮代谢和TAs代谢途径来提高颠茄的耐盐性。在实际生产中, 可考虑通过喷施适宜浓度的EBR来应对颠茄培育过程中可能遇到的盐害问题, 提高其抗逆性以及获得更多的药用成分。
[1] 朱虹, 祖元刚, 王文杰, 闫永庆. 盐碱地的植被恢复与盐碱地改良方法的评述. 吉林林业科技, 2007, 36(5): 14–27.
Zhu H, Zu Y G, Wang W J, Yan Y Q. Assessment of vegetation restoring and artificial interference in the saline-alkaline soil., 2007, 36(5): 14–27 (in Chinese with English abstract).
[2] 李建国, 濮励杰, 朱明, 张润森. 土壤盐渍化现状及未来研究热点. 地理学报, 2012, 67: 1233–1245.
Li J G, Pu L J, Zhu M, Zhang R S. The present situation and hot issues in the salt-affected soil research., 2012, 67: 1233–1245 (in Chinese with English abstract).
[3] 杨伟, 王坚强, 刘勇, 白鸿雁, 武擘, 赫艳芳, 施宝安. 植物盐胁迫研究进展. 园艺与种苗, 2018, 38(5): 55–57.
Yang W, Wang J Q, Liu Y, Bai H Y, Wu Q, He Y F, Shi B A. Research progress of plant salt stress., 2018, 38(5): 55–57 (in Chinese with English abstract).
[4] 吴雪霞. 外源一氧化氮对盐胁迫下番茄幼苗生理特性影响的研究. 南京农业大学博士学位论文, 江苏南京, 2007.
Wu X X. Studies on Influences of Exogenous Nitric Oxide on Physiological Characteristics in Tomato Seedlings under Salt Stress. PhD Dissertation of Nanjing Agricultural University, Nanjing, Jiangsu, China, 2007 (in Chinese with English abstract).
[5] 任文奇. 外源γ-氨基丁酸对Ca(NO3)2胁迫下甜瓜幼苗氮代谢和光合作用的调控. 西北农林科技大学硕士学位论文, 陕西杨凌, 2016.
Ren W Q. Effect of Exogenous Gamma-aminobutyric Acid on Nitrogen Metabolism and Photosynthesis of Melon Seedlings under Ca(NO3)2Stress. MS Thesis of Northwest A & F University, Yangling, Shaanxi, China, 2016 (in Chinese with English abstract).
[6] 万春阳, 王丹, 侯俊玲, 王文全, 李卫东. 氯化钠胁迫对甘草生长、生理及有效成分含量的影响. 中国实验方剂学杂志, 2011, 17(18): 118–122.
Wan C Y, Wang D, Hou J L, Wang W Q, Li W D. Effects of NaCl stress on growth, physiological index and content of effective composition of. C, 2011, 17(18): 118–122 (in Chinese with English abstract).
[7] 王凤茹, 王志勇. 油菜素内酯信号转导的研究进展. 华北农学报, 2008, 23(增刊2): 29–39.
Wang F R, Wang Z Y. The research of brassinosteroids signal transduction., 2008, 23(S2): 29–39 (in Chinese with English abstract).
[8] 张华, 向阳海, 杨永华. 油菜素内酯促进滇紫草细胞产生紫草色素初探. 南京大学学报(自然科学版), 1999, 35(2): 28–32.
Zhang H, Xiang H Y, Yang Y H. Preliminary study oncell producting shikonin derivatives promoted by brassinolide.(Nat Sci), 1999, 35(2): 28–32 (in Chinese).
[9] 池剑亭, 申亚琳, 舒位恒, 王红. 油菜素内酯促进药用植物青蒿中青蒿素的生物合成. 中国科学院大学学报, 2015, 32: 476–481.
Chi J T, Shen Y L, Shu W H, Wang H. Artemisinin biosynthesis ofL. promoted by brassinosteroid., 2015, 32: 476–481 (in Chinese with English abstract).
[10] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000. pp123–194.
Li H S. Principles and Techniques of Plant Physiology and Biochemistry Experiments. Beijing: Higher Education Publishers, 2000. pp 123–194 (in Chinese).
[11] 汤绍虎, 罗充. 植物生理学实验教程. 重庆: 西南师范大学出版社, 2012. pp57–58.
Tang S H, Luo C. Plant Physiology Experiment Course. Chongqing: Southwest Normal University Publishers, 2012. pp57–58 (in Chinese).
[12] Zárate R, Hermosin B, Cantos M, Troncoso A. Tropane alkaloid distribution inplants., 1997, 23: 2059–2066.
[13] 黄爱清, 苏国成, 王璋. L-鸟氨酸快速定量检测方法. 食品与发酵工业, 2005, (12): 98–102.
Huang A Q, Su G C, Wang Z. Rapid quantitative determination for L-ornithine analysis., 2005, (12): 98–102 (in Chinese with English abstract).
[14] 胡桂娟, 刘寄明, 刘嘉芬. 化学法测定精氨酸总量. 落叶果树, 1995, (1): 22.
Hu G J, Liu J M, Liu J F. Chemical determination of total arginine., 1995, (1): 22 (in Chinese).
[15] 赵福庚, 刘友良. 精氨酸脱羧酶和谷酰胺转移酶活性的测定方法. 植物生理学通讯, 2000, 36: 442–445.
Zhao F G, Liu Y L. Methods of measuring arginine decarboxylase and transglutaminase activity., 2000, 36: 442–445 (in Chinese with English abstract).
[16] 康朵兰. 马铃薯大西洋块茎在休眠萌发和低温贮藏期的生理生化变化. 湖南农业大学硕士学位论文, 湖南长沙, 2007.
Kang D L. Physiological and Biochemical Changes of Potato Atlantic Tuber during Dormancy, Sprouting and Cold Storage. MS Thesis of Hunan Agricultural University, Changsha, Hunan, China, 2007 (in Chinese with English abstract).
[17] 强玮. 颠茄基因的克隆、功能验证及超量表达对颠茄托品烷生物碱合成的影响. 西南大学硕士学位论文, 重庆, 2012.
Qiang W. Cloning and Characterization of Tropinone Reductase I fromand Its Overexpression for Enhancing the Tropane Alkaloids Production in. MS Thesis of Southwest University, Chongqing, China, 2012 (in Chinese with English abstract).
[18] 强玮, 王亚雄, 张巧卓, 李金弟, 夏科, 吴能表, 廖志华. 颠茄托品烷生物碱合成途径基因表达分析与生物碱积累研究. 中国中药杂志, 2014, 39(1): 52–58.
Qiang W, Wang Y X, Zhang Q Z, Li J D, Xia K, Wu N B, Liao Z H. Expression pattern of genes involved in tropane alkaloids biosynthesis and tropane alkaloids accumulation in., 2014, 39(1): 52–58 (in Chinese with English abstract).
[19] Qiu F, Yang C X, Yuan L, Xiang D, Lan X Z, Chen M, Liao Z H. A phenylpyruvic acid reductase is required for biosynthesis of tropane alkaloids., 2018, 20: 7807–7810.
[20] 李金弟. 颠茄qPCR内参基因筛选及TR II基因表达分析. 西南大学硕士学位论文, 重庆, 2013.
Li J D. Reference Genes Slection for qPCR inand the Expression Analysis of Tropinone Reductase II. MS Thesis of Southwest University, Chongqing, China, 2013 (in Chinese with English abstract).
[21] 刘丽, 甘志军, 王宪泽. 植物氮代谢硝酸还原酶水平调控机制的研究进展. 西北植物学报, 2004, 24: 1355–1361.
Liu L, Gan Z J, Wang X Z. Advances of studies on the regulation of nitrate metabolism of plants at nitrate reductase level.-, 2004, 24: 1355–1361 (in Chinese with English abstract).
[22] 郭紫娟, 孙风国, 张慎好. 多胺对果树生长发育的影响研究进展. 河北农业科学, 2005, 9(3): 99–102.
Guo Z J, Sun F G, Zhang S H. The studies of polyamines in fruits., 2005, 9(3): 99–102 (in Chinese with English abstract).
[23] Yuan L Y, Yuan Y H, Du J, Sun J, Guo S. Effects of 24-epibrassinolide on nitrogen metabolism in cucumber seedlings under Ca(NO3)2stress., 2012, 61: 29–35.
[24] 马月花, 郭世荣, 杜南山, 山溪, 孙锦, 王磊, 王颖, 束胜. 外源2,4-表油菜素内酯对低氧胁迫下黄瓜幼苗氮代谢的影响. 南京农业大学学报, 2015, 38: 538–545.
Ma Y H, Guo S R, Du N S, Shan X, Sun J, Wang L, Wang Y, Shu S. Effect of exogenous 2,4-epibrassinolide on nitrogen assimilation of cucumber seedlings under hypoxia stress., 2015, 38: 538–545 (in Chinese with English abstract).
[25] 寇江涛. 2,4-表油菜素内酯诱导下紫花苜蓿耐盐性生理响应研究. 甘肃农业大学硕士学位论文, 甘肃兰州, 2016.
Kou J T. Physiological Mechanism of 2,4-epibrassinolide-Regulated Salt Stress Tolerance in. MS Thesis of Gansu Agricultural University, Lanzhou, Gansu, China, 2016 (in Chinese with English abstract).
[26] 张扬欢. 增强UV-B辐射及干旱复合处理对长春花()碳氮代谢及生物碱含量的调控. 西南大学硕士学位论文, 重庆, 2011.
Zhang Y H. Studies on the Regulation of Enhanced UV-B Radiation and Drought Stress on Carbon and Nitrogen Metabolism and Alkaloid Content in. MS Thesis of Southwest University, Chongqing, China, 2011 (in Chinese with English abstract).
[27] Patterson S, O’Hagan D. Biosynthetic studies on the tropane alkaloid hyoscyamine in; hyoscyamine is stable tooxidation and is not derived from littorinea vicinal interchange process., 2002, 61: 323–329.
[28] 李霞, 程运河, 马晓东, 韩蕾, 孙振元. 多胺在植物抗逆中的生理机制. 世界林业研究, 2018, 31(4): 23–28.
Li X, Cheng Y H, Ma X D, Han L, Sun Z Y. Physiological mechanism of polyamines in plant resistance., 2018, 31(4): 23–28 (in Chinese with English abstract).
[29] Zhao T, Li S, Wang J, Zhou Q, Yang C, Bai F, Lan X, Chen M, Liao Z. Engineering tropane alkaloid production based on metabolic characterization of ornithine decarboxylase in., 2020, 9: 437–448.
[30] 陆芳勤, 王欣, 沈潼, 周峰. 多胺代谢与植物环境胁迫. 天津农业科学, 2014, 20(3): 15–17.
Lu F Q, Wang X, Shen T, Zhou F. Relationship between polyamine metabolism and environmental stress., 2014, 20(3): 15–17 (in Chinese with English abstract).
[31] 乔晶, 胡峻, 李妍芃, 任广喜, 项妤, 臧艺玫, 刘勇, 刘春生. 油菜素内酯对甘草性状及7种化学成分含量的影响. 中国中药杂志, 2016, 41(2): 197–204.
Qiao J, Hu J, Li Y F, Ren G X, Xiang S, Zang Y M, Liu Y, Liu C S. Effect of exogenous Brassinolide on morphological characters and contents of seven chemical constituents of., 2016, 41(2): 197–204 (in Chinese with English abstract).
[32] 杨怡. 外源NO对盐胁迫下颠茄生理特性及次生代谢调控的影响. 西南大学硕士学位论文, 重庆, 2019.
Yang Y. The Effect of Exogenous Nitric on Physiological Characteristics and Secondary Metabolites Accumulation ofL. Seedling under NaCl Stress. MS Thesis of Southwest University, Chongqing, China, 2019 (in Chinese with English abstract).
[33] 王东辉. 环境要素对玄参次生代谢的影响. 中国科学院水土保持与生态环境研究所博士学位论文, 陕西西安, 2010.
Wang D H. The Effects of Environmental Factors on Secondary Metabolism of. PhD Dissertation of Institute of Soil and Water Conservation, Chinese Academy of Sciences & Ministry of Water Resources, Xi’an, Shaanxi, China, 2010 (in Chinese with English abstract).
Effects of exogenous 2,4-Epibrassinolide on nitrogen metabolism and TAs metabolism ofL. under NaCl stress
XIN Zheng-Qi1, DAI Huan-Huan2, XIN Yu-Feng1, HE Xiao1, XIE Hai-Yan1, and WU Neng-Biao1,*
1School of Life Science, Southwest University / Key Laboratory of Eco-environments in Three Gorges Region, Ministry of Education, Chongqing 400715, China;2The Fifth Middle School of Qingyang, Qingyang 745000, Gansu, China
To explore the physiological mechanism of exogenous 2,4-Epibrassinolide (EBR) regulating NaCl tolerance of,pottedseedlings was used as the experimental materials, and exogenous EBR was applied toseedlings with the different concentrations (0.05, 0.1, 0.2, and 0.4 mg L–1) of exogenous EBR and different treatment times (5, 10, 15, and 20 days) on the nitrogen metabolism, the contents of the secondary metabolites and precursor substances in the synthesis pathway of TAs, and the relative expression levels of key enzyme genes. NaCl stress caused inhibitory effect on nitrogen metabolism in, however the content of nitrate nitrogen increased significantly, the content of ammonium nitrogen decreased, the content of free amino acids, soluble protein, and the activity of key enzymes of nitrogen metabolism increased to some extent under exogenous EBR treatment, which indicating the exogenous EBR could effectively enhance the nitrogen metabolism capacity. NaCl stress was not conducive to the synthesis and accumulation of alkaloids. The synthesis of precursor substances and the relative expression levels of key enzyme genes in TAs pathway significantly were reduced under NaCl stress. The contents of ornithine, arginine, polyamine, and the activities of key enzymes in putrescine synthesis were increased with the exogenous EBR of 0.1 mgL–1. Moreover, exogenous EBR could effectively enhance the contents of hyoscyamine and scopolamine by increasing the relative expression levels of key enzyme genesandin TAs pathway. In conclusion, the appropriate concentration of exogenous EBR could effectively relieve the damage of NaCl stress to the physiological metabolism in, andthe exogenous EBR could improve NaCl tolerance ofseedlings by increasing nitrogen metabolism and promoting the production and accumulation of TAs.
L.; NaCl stress; nitrogen metabolism; secondary metabolism
10.3724/SP.J.1006.2021.04238
本研究由国家自然科学基金项目(30500041)资助。
This study was supported by the National Natural Science Foundation of China (30500041).
吴能表, E-mail: wunb@swu.edu.cn
E-mail: 490992699@qq.com
2020-11-01;
2021-01-13;
2021-02-25.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20210225.1312.008.html

