菠萝蜜叶绿素缺失突变体幼苗茎的解剖结构
董俊娜 谢柳青 楚文清 于旭东 蔡泽坪 罗佳佳 瞿倩

摘 要:木本植物茎的发育在木材形成中具有重要意义。以菠萝蜜叶绿素缺失突变体幼苗(Chlorophyll deficient mutant, CDM)为研究材料,选取正常幼苗作为对照(Control check, CK),观察并测量其株高和基部茎粗。使用石蜡切片法和光学显微技术对茎各节间进行观察,测量木质部、韧皮部、表皮和周皮的厚度,比较CDM与CK之间的差异。结果显示,CDM的株高和基部茎粗的增长受到一定的抑制,各节间木质部、韧皮部以及周皮的厚度均减小;相比次生木质部,次生韧皮部的抑制作用更显著。
关键词:菠萝蜜;叶绿素缺失突变体;茎;解剖结构
中图分类号:S667.8 文献标识码:A
Structural Analysis of the Stem of the Chlorophyll Deficient Mutant from Artocarpus heterophyllus Seedlings
DONG Junna1, XIE Liuqing2, CHU Wenqing1, YU Xudong1, CAI Zeping1*, LUO Jiajia2,3, QU Qian1
1. College of Forestry, Hainan University / Key Laboratory of Genetics and Germplasm Innovation of Tropical Special Forest Trees and Ornamental Plants, Ministry of Education, Haikou, Hainan 570228, China; 2. College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 3. Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Crop Gene Resources and Germplasm Enhancement in Southern China, Ministry of Agriculture & Rural Affairs, Danzhou, Hainan 571737, China
Abstract: The stem development of woody plants plays an important role in wood formation. In this study, the seedlings of the chlorophyll deficient mutants (CDM) of Artocarpus heterophyllus were selected as the research material and normal seedlings were selected as the control check (CK) to observe and measure plant height and basal stem diameter. The internodes of seedlings were observed by paraffin section and optical microscopy. The thickness of xylem, phloem, epidermis and periderm were measured, and the difference between CDM and CK was compared. The results showed that the increase of plant height, basal stem diameter of CDM were inhibited to some extent, and the thickness of xylem, phloem and periderm of each internode decreased. Compared with the secondary xylem, the inhibition of secondary phloem was more significant.
Keywords: Artocarpus heterophyllus; chlorophyll deficient mutant; stem; anatomic structure
DOI: 10.3969/j.issn.1000-2561.2021.06.021
茎在植株中起到支撑和运输的重要作用,且在木材形成过程中具有重要意义[1]。木本植物茎的生长包括初生生长和次生生长两部分。初生生长发生在茎的幼嫩组织中,茎顶端分生组织细胞的分裂和伸长共同决定了茎的伸长,使植株长高。在此过程中,产生初生木质部和初生韧皮部,并分化出表皮。次生生长在初生生长完成之后发生,此时维管形成层分别向内、向外产生次生木质部和次生韧皮部,同时周皮取代表皮,于是茎不断增粗[2-3]。
光合作用为绿色植物的生长发育提供必要的物質和能量[4-5]。叶绿素是光合作用的重要色素,在光能的吸收、传递和转换过程起着重要的作用[6-7]。叶绿素缺乏会导致植物对光能的利用率下降,从而影响其正常的能量供应,在植物外观形态上表现为叶片及茎出现黄化或白化现象[8]。白化现象在植物界中普遍存在,但是目前的研究大多在草本植物中开展,如拟南芥(Arabidopsis thaliana)、小麦(Triticμm aestivμm)、玉米(Zea mays)、水稻(Oryza sativa)等[9-12],对于木本植物的研究相对较少[13]。
菠萝蜜(Artocarpus heterophyllus)是一种珍贵的木材树种[14]。本课题组在野外考察中发现菠萝蜜叶绿素缺失突变体(chlorophyll deficient mutants, CDM),利用其母株成熟果实中的种子进行栽种,分离得到子代CDM幼苗,作为实验材料进行深入研究。付影等[15]对菠萝蜜CDM形态和生理进行了研究,结果表明CDM的茎粗减小。郑李婷等[16]和谢柳青等[17]分别对CDM嫩茎和次生生长茎进行了转录组分析。然而茎中各节间的解剖结构还未知。本研究通过石蜡切片法和光学显微镜技术,观测并比较CDM茎中各节间的结构变化,分析菠萝蜜CDM茎的发育,为木本植物茎发育的研究提供新的思路。
1 材料与方法
1.1 材料
采用谢柳青等[17]的实验材料,母株为具有隐性叶绿素缺失遗传基因的植株,从母株的成熟果实中剥离出种子,挑选饱满的种粒种植于含有营养土的花盆中,在光照和水分充足的条件下栽种,通过栽种分离出完全白化的CDM幼苗,选取正常幼苗作为对照(CK)。
1.2 方法
1.2.1 株高、基部茎粗测量 待种子萌发后,分别对苗龄1、5、10、15、20、25、30、35、40 d的CDM及CK的株高和基部茎粗进行观察和测量,并拍照记录。
1.2.2 材料的固定与石蜡切片 萌发至40 d时,植株株高和基部茎粗的增长趋于平缓。此时参照Jagadish等[18]的方法,由上至下采取CDM及CK的每个节间,浸入FAA固定液[(50%酒精90 mL)+冰醋酸(5 mL)+甲醛(5 mL)]中固定24 h。在LEICA RM2245切片机上将固定好的材料进行切片,切片厚度为10 μm,切片后采取番红(2.5 g番红+100 mL 70%酒精)和固绿(1 g固绿+100 mL 95%酒精)对染,封片后使用LEICA DFC295光学显微镜观察和拍照。
1.3 数据处理
用刻度尺对植株的株高和基部茎粗进行测量,采用Image J软件对CDM及CK茎切片的横切面、木质部、韧皮部、表皮和周皮的厚度进行测量,每项指标均重复12组,并计算平均值和标准差,数值以“平均值±标准差”表示,采用u值检验法对CDM与CK各项指标进行差异显著性分析。
2 结果与分析
2.1 株高和基部茎粗分析
CK在发育阶段其茎为绿色,CDM则呈现出白色,同一苗龄,CDM相比CK,整体长势较弱(图1A~图1E)。二者的生长发育均呈现出先快速生长(1~15 d)、后缓慢生长(16~40 d)的趋势。在发育过程中,同一时期CDM的株高均小于CK,且二者之间的差异逐渐增大。发育至10 d时,CDM的株高为12.42 cm,是CK(16.22 cm)的76.57%,差异极显著(图1B、图1F);发育至40 d时,CDM的株高为20.06 cm,是CK(35.56 cm)的56.41%,差异极显著(图1E、图1F)。可见CDM株高的增长受到严重的抑制。同时CDM茎的加粗生长也受到一定的影响。顶芽出土后1~15 d,CDM与CK的基部茎粗尚未出现显著差异(图1G)。发育至20 d时,CDM基部茎粗为3.56 mm,是CK(4.28 mm)的83.18%,二者开始出现极显著差异(图1C、图1G)。发育至40 d时,CDM的基部茎粗为3.81 mm,是CK(5.13 mm)的74.27%(图1E、图1G),差异极显著,可见CDM基部茎粗的增长受到明显的抑制作用。
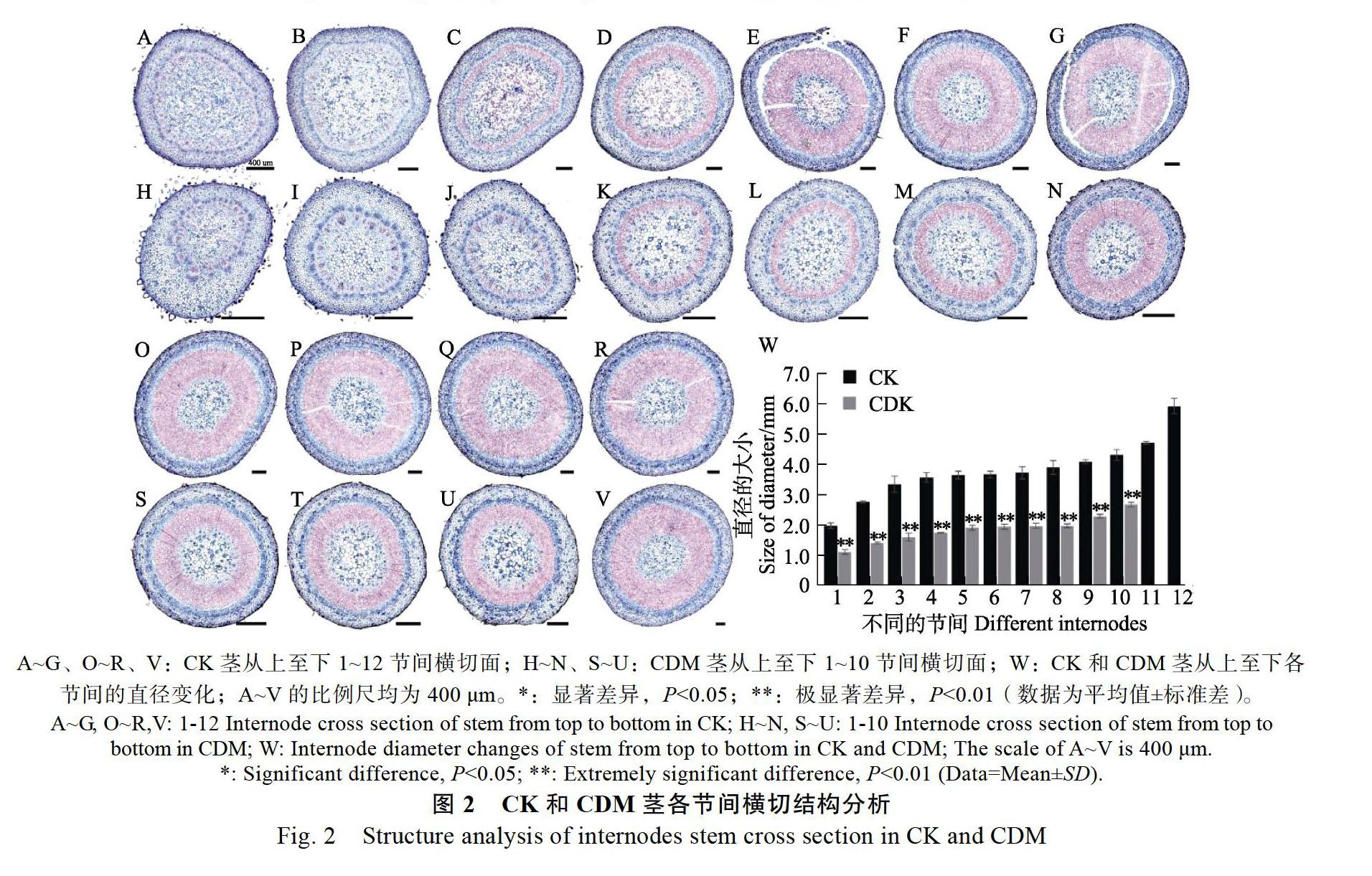
CDM茎节间1的直径为1150.76 μm,是CK(2003.93 μm)的57.43%,二者差异极显著(图2A、图2H、图2W)。此后,在发育的同一时期,CDM茎节间的直径均小于CK,且二者的增长速度趋于一致,均呈现出先快速生长(节间1~4)再缓慢生长(节间5~10)的趋势(图2W)。CDM节间10的直径为2711.92 μm,是CK(4360.24 μm)的62.20%,差异极显著(图2Q、图2U、图2W)。二者在相同环境中生长同样的时间,CDM只发育了10个节间,比CK(12个)少2个,CK直径在11~12节间迅速生长,CDM则死亡(图2R、图2V、图2W)。可见CDM茎的加粗生长受到了抑制。
2.2 木质部结构分析
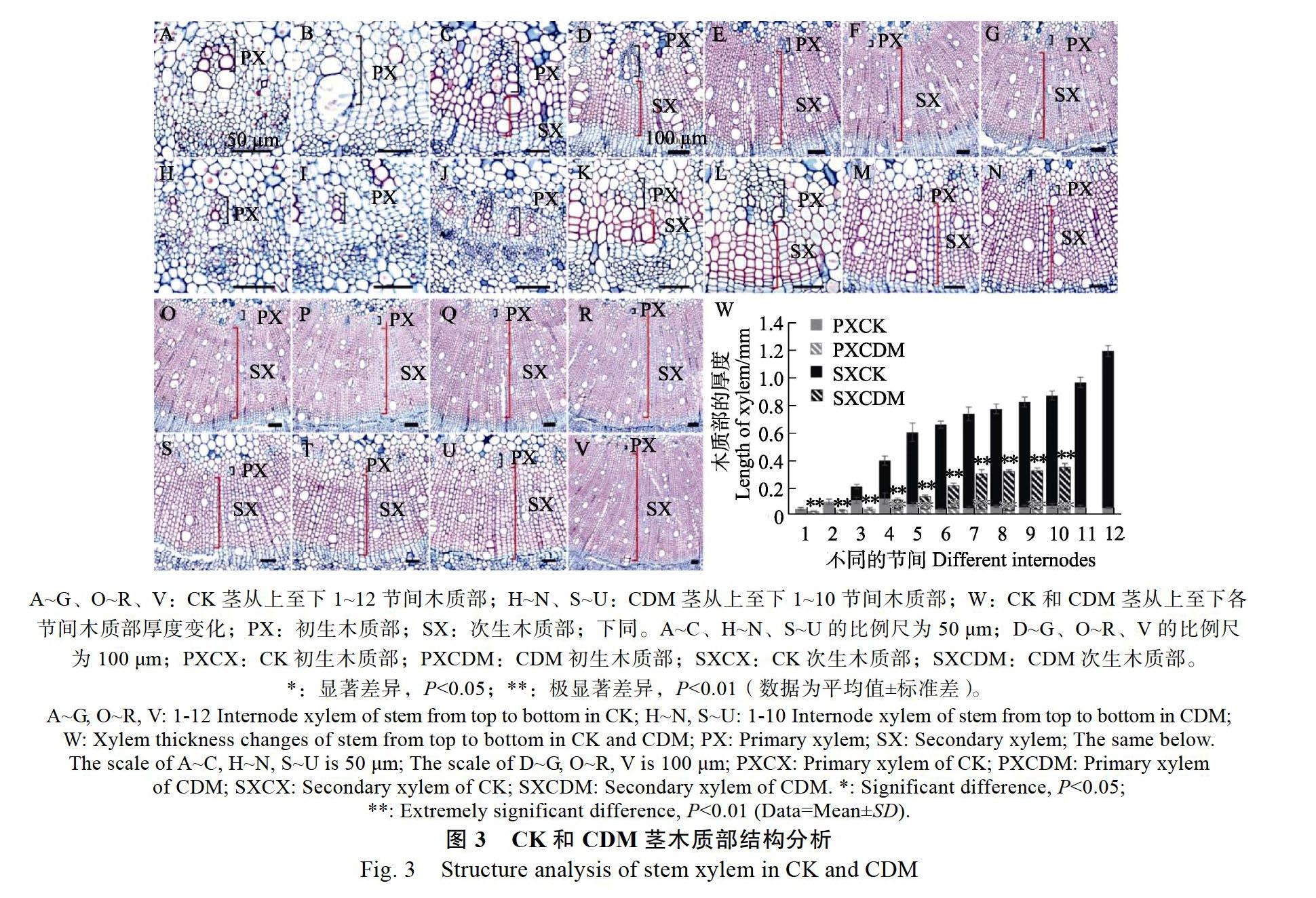
CDM初生木质部在1~10节间生长较为平缓;CK初生木质部则在节间4出现一个生长高峰(图3W)。节间1,CDM初生木质部的厚度为32.03 μm,是CK(46.93 μm)的68.25%,差异极显著(图3A、图3H、图3W)。可见CDM茎初生木质部的生长受到影响。同时CDM茎次生木质部的生长也受到了抑制。CK在节间3开始出现次生木质部,CDM则在节间4出现,与CK相比较晚(图3C、图3K、图3W)。节间4,CDM的次生木质部的厚度为74.16 μm,是CK(278.21 μm)的26.66%,差异极显著(图3D、图3K、图3W)。CDM及CK次生木质部的生长发育均呈现先快速生长(节间4~6)后缓慢生长(CDM:节间7~10、CK:节间7~12)的趋势。发育至节间10时,CDM次生木质部的厚度为313.58 μm,是CK(801.62 μm)的39.12%,差异达极显著(图3Q、图3U、图3W)。在发育过程中,同一时期CDM初生木质部及次生木质部的厚度均小于CK,尤其在次生木质部生长过程中,二者之间的差异逐渐增大(图3W),可见CDM茎木质部的发育受到严重抑制。
2.3 韧皮部结构分析
发育至40 d时,CDM节间1初生韧皮部的厚度为38.61 μm,是CK(43.29 μm)的89.19%,二者差异达显著(图4A、图4H、图4W);节间3,CDM初生韧皮部的厚度为37.27 μm,是CK(47.95 μm)的77.73%,二者差异极显著(图4C、图4J、图4W)。每一个对应的节间,CDM初生韧皮部的厚度均小于CK(图4W)。节间10,CDM初生韧皮部的厚度为33.47 μm,是CK(51.33 μm)的65.21%,差异极显著(圖4Q、图4U、图4W)。可见CDM茎初生韧皮部的发育受到抑制。CK在节间3出现次生韧皮部,CDM则在节间6出现,晚于CK(图4C、图4M、图4W)。节间6,CDM次生韧皮部的厚度为36.32 μm,是CK(70.08 μm)的51.83%,二者差异极显著(图4F、图4M、图4W)。CDM次生韧皮部厚度呈现先增加后减少的趋势,CK则一直增加,且每一对应节间,CDM次生韧皮部的厚度均小于CK(图4W)。节间10,CDM次生韧皮部的厚度为38.79 μm,是CK(98.03 μm)的39.57%,差异极显著(图4Q、图4U、图4W);可见CDM茎次生韧皮部的发育同样受到了抑制。
2.4 表皮和周皮结构分析
发育至40 d时,CDM节间1的表皮厚度为12.23 μm,是CK(9.47 μm)的129.14%,二者差异极显著(图5A、图5H、图5W);节间1~7,每一个对应的节间,CDM表皮的厚度均大于CK(图5W)。节间10,CDM的表皮厚度为7.12 μm,是CK(6.06 μm)的117.49%,二者差异极显著。CDM在节间8出现周皮,晚于CK节间5(图5S、图5E、图5W)。出现周皮后,二者的表皮均退化,厚度逐渐减小(图5W)。CDM与CK的周皮长势相同,呈逐渐增加的趋势(图5W)。节间8,CDM周皮厚度为31.58 μm,是CK(32.23 μm)的97.98%,二者无显著性差异(图5O、图5S、图5W)。节间10,CDM周皮的厚度为35.80 μm,是CK(38.93 μm)的91.96%,差异显著(图5Q、图5U、图5W)。可见CDM茎周皮出现的时间被延迟。
2.5 茎中次生结构起始节间比较
由表1可知,CK幼苗茎中有25%的次生木质部在第2个节间出现,75%在第3节间出现;次生韧皮部有75%在第3节间出现,25%在第4节间出现。CDM幼苗茎中约33%的次生木质部在第3节间出现,约67%在第4节间出现,次生韧皮部约33%在第4节间出现,67%在第6节间出现。计算可知,CDM与CK茎中出现次生韧皮部的节间之差大于次生木质部,说明相对于次生木质部,CDM次生韧皮部的起始受到的抑制作用更大。
CK幼苗茎中有75%的周皮在第5节间出现,25%在第6节间出现。CDM幼苗茎中各有约33%的周皮分别在第6节间、第8节间和第9节间出现。CDM与CK茎中出现周皮的节间之差大于次生韧皮部。
3 讨论
茎的加粗生长包括木质部和韧皮部的加粗生长,二者的次生生长在整个加粗生长的过程中起着重要作用。本研究中CDM的茎比CK细弱,其主要原因是CDM茎中次生木质部和次生韧皮部的发育受到了抑制。谢柳青等[17]发现,在生长40 d的CDM次生生长茎中下调的基因在氨基酸的生物合成、碳代谢、氧化磷酸化等途径中显著富集;同时其上调基因主要富集在半乳糖代谢、碳水化合物代谢、脂质代谢等过程,表明此时CDM次生生长茎中基础代谢受到影响。此外,CDM茎中初生木质部、初生韧皮部的发育也受抑制。有研究表明,蔗糖可以刺激韧皮部细胞的分裂和分化[19]。在郑李婷等[16]对菠萝蜜嫩茎的转录组进行分析后发现,CDM嫩茎中糖代谢途径的基因下调表达。可见,能量供应出现异常可能是导致茎初生生长和次生生长受到抑制的原因之一。
相比于次生木质部,CDM茎中次生韧皮部受到的抑制作用更为明显。茎中次生木质部将水分和矿质营养从下向上运输到植物体的形态学上端,次生韧皮部则将叶片中的光合产物从上至下运输到根部[20]。光合作用的核心色素叶绿素在植物的绿色组织中均有分布,其中在叶中的含量最多[21]。因此和根部相比,叶绿素缺失导致光合产物的减少对CDM叶片中有机物合成的影响更大。叶片中有机物含量减少,对于韧皮部的卸载功能要求降低。因此,CDM茎中次生韧皮部形成受到的抑制作用更大可能是对上述过程的一种响应,但其分子机理目前尚不明确。
本研究从结构方面报道了菠萝蜜CDM与CK在株高、基部莖粗、木质部、韧皮部、表皮和周皮上的差异,然而影响CDM茎发育的分子机制还需要进一步研究,本研究为木本植物茎发育的研究提供新的思路。
参考文献
[544] Plomion C, Grégoire Leprovost and Alexia Stokes. Wood formation in trees[J]. Plant Physiology, 2001, 127(4): 1513-1523.
[545] Rachel S, Andrew G. Evolution of development of vascular cambia and secondary growth[J]. New Phytologist, 2010, 186(3): 577-592.
[546] Gunning B E S, Pate J S, Green L W. Transfer cells in the vascular system of stems: Taxonomy, association with nodes, and structure[J]. Protoplasma, 1970, 71(1-2): 147-171.
[547] Zheng J, Hu M J, Guo Y P. Regulation of photosynthesis by light quality and its mechanism in plants[J]. The journal of applied ecology, 2008, 19(7): 1619-1624.
[548] Saveyn A N, Steppe K, Ubierna N, et al. Woody tissue photosynthesis and its contribution to trunk growth and bud development in young plants[J]. Plant Cell & Environment, 2010, 33(11): 1949-1958.
[549] Qun H X, Xin Z H, Lin D C, et al. Chlorophyll-deficit rice mutants and their research advances in biology[J]. Acta Botanica Boreali-occidentalia Sinica, 2005, 25(8): 1685-1691.
[550] 叶子飘. 光合作用对光和CO2响应模型的研究进展[J]. 植物生态学报, 2010, 34(6): 727-740.
[551] 朱明库, 胡宗利, 周 爽, 等. 植物叶色白化研究进展[J] 生命科学, 2012, 24(3): 255-261.
[552] Huang X, Zhang X, Yang S. A novel chloroplast-localized protein EMB1303 is required for chloroplast development in Arabidopsis[J]. Cell Research, 2009, 19(10): 1205-1216.
[553] Hou D Y, Xu H, Du G Y, et al. Proteome analysis of chloroplast proteins in stage albinism line of winter wheat (Triticμm aestivμm) FA85[J]. Biochemistry and Molecular Biology, 2009, 42(7): 450-455.
[554] 王婷婷, 翟立紅, 苏 旭, 等. Mutator诱导的玉米白化突变体插入位点的遗传分析及代谢途径的构建[J]. 中国农业科学, 2010, 43(22): 4571-4578.
[555] 陈 涛, 张亚东, 赵 凌, 等. 一个新的水稻白化转绿突变体的生理特性和基因定位[J]. 遗传学报, 2007, 34(4): 331-338.
[556] 刘美娟. 桑树叶色突变体色素变化及其分子机理的研究[D]. 苏州: 苏州大学, 2004.
[557] 毛 琪, 叶春海, 李映志, 等. 菠萝蜜研究进展[J]. 中国农学通报, 2007, 23(3): 439-443.
[558] 付 影, 于旭东, 蔡泽坪, 等. 菠萝蜜白化突变体的性状研究[J]. 热带作物学报, 2018, 39(6): 1081-1086.
[559] 郑李婷, 于旭东, 蔡泽坪, 等. 波罗蜜叶绿素缺失突变体嫩茎转录组分析[J]. 热带作物学报, 2020, 41(8): 1513-1521.
[560] 谢柳青, 董俊娜, 于旭东, 等. 菠萝蜜叶绿素缺失突变体茎次生生长转录组分析[J]. 分子植物育种, 2020, 18(18): 5958-5969.
[561] Jagadish K S V, Craufurd P, Shi W, et al. A phenotypic marker for quantifying heat stress impact during microsporogenesis in rice (Oryza sativa L.)[J]. Functional Plant Biology, 2013, 41(1): 48-55.
[562] Gamalei Y. Phloem loading and its development related to plant evolution from trees to herbs[J]. Trees, 1991, 5(1): 50-64.
[563] Barry C S. The stay-green revolution: Recent progress in deciphering the mechanisms of chlorophyll degradation in higher plants[J]. Plant Science, 2008, 176(3): 325-333.
[564] Krause G H, Weis E. Chlorophyll fluorescence and photosynthesis: the basics[J]. Annual Review of Plant Physiology, 1991, 42(1): 313-349.
责任编辑:白 净

