基于常压基质辅助激光解吸电离质谱成像技术原位检测三维肿瘤细胞球内代谢小分子
谢佩斯,段晓琨,蔡宗苇
(1.香港浸会大学环境与分析国家重点实验室,香港 999077;2.华质泰科生物技术有限公司,北京 100102)
当前,二维细胞培养技术被广泛用于抗癌药物试剂的体外测试[1]。然而,二维细胞不能模拟体内组织三维结构的特性,其生长特点和状态与体内细胞差别较大,这使得体外测试难以准确地评价抗癌药物的实际疗效。动物模型能够很好地模拟人体肿瘤的微环境,但实际操作耗时、耗费,使得依靠动物模型进行大规模的药物筛选十分困难[2]。三维细胞培养是介于动物模型和二维细胞模型之间的一种技术[3],其能够较大程度地模拟体内肿瘤细胞的生长环境,同时大幅度降低成本,易于实现药物筛选的标准化。
在三维细胞模型中,肿瘤细胞球能很好地模拟实体瘤的生长状态和内部结构[4]。在生长初期,肿瘤细胞球和实体瘤的体积呈指数增长,随后两者的体积增长速度逐渐减缓,直至到达平台期。在体积逐渐增大的过程中,由于营养物质和氧气渗透性的限制,肿瘤细胞球逐渐形成了中心区域的细胞凋亡区和细胞静止区,以及外围区域的细胞增殖区[4]。同样,在实体瘤的内部结构中也能发现肿瘤细胞的增殖区和凋亡区。
质谱成像能够检测多种生物样本中生物分子的分布[5]。目前,已有多种电离技术应用于质谱成像分析中,主要包括二次离子质谱电离(SIMS)、电喷雾解吸电离(DESI)和基质辅助激光解吸电离(MALDI)[6]。其中,SIMS能够提供高空间分辨率,然而由于该技术需要通过高能量的一次离子轰击样本,使其局限于小分子的检测和分析。MALDI是一种软电离技术,根据选择基质的不同,能够同时对不同的小分子(例如,代谢物、药物、脂质分子)和大分子(例如蛋白)进行检测[7]。与真空MALDI技术相比,大气压MALDI更容易实现同其他离子源的切换,能够对一些真空状态下不稳定的物质和基质进行分析,同时获得更少的离子碎裂峰[8]。
有文献[9-10]报道应用真空MALDI技术检测三维细胞内的内源性和外源性物质的分布。例如,当结肠癌HCT116细胞球暴露20.6 μmol/L伊立替康药物后,在最初的6 h内,药物仅在外围区有分布;随着暴露时间的延长,24 h后,药物逐渐渗透到细胞的全部区域[11]。另外,本课题组[12]最近开发了一种快速简便制备3D细胞球冰冻切片的方法,即采用冰包裹细胞球并在冰层上包裹一层冰冻切片包埋剂(OCT)胶的策略,解决了传统方法中明胶包裹多细胞球导致细胞球不易被发现的问题,同时保证了冰冻切片的完整性,该方法结合真空MALDI技术已应用于内源性脂质分子和外源性物质双酚A在肿瘤细胞球内的检测。然而,目前未见应用大气压MALDI技术研究细胞球内代谢分子分布的报道。
基于此,本实验拟利用大气压MALDI-串联超高分辨质谱检测并分析三维肿瘤细胞球内22种代谢小分子的分布。这些代谢小分子涉及三羧酸循环、甘油磷脂的合成和降解两条代谢通路。希望为研究肿瘤微环境和肿瘤代谢提供参考,为开展原位质谱成像研究提供方法支持。
1 实验部分
1.1 仪器与试剂
大气压MALDI源:美国MassTech公司产品;HPLC-Orbitrap Fusion质谱仪:美国Thermo Fisher Scientific公司产品;96孔超低吸附培养皿:美国Corning公司产品。
1640培养基、牛血清、0.25%双抗:美国Thermo Fisher Scientific公司产品;甲醇、乙腈、二氯甲烷、氯仿、异丙醇:德国Merck公司产品;羧甲基纤维素、基质2,5-二羟基苯甲酸(DHB)、9-氨基吖啶(9AA)、反式-2-[3-(4-叔丁基苯基)-2-甲基-2-亚丙烯基]丙二腈(DCTB):美国Sigma公司产品;
1.2 二维和三维细胞培养
结肠癌细胞系HCT116生长于10 cm含有6 mL的1 640完全培养基的培养皿中。细胞在温度37 ℃,含5%二氧化碳的培养箱中培养。完全培养基由89%培养基、1%双抗和10%牛血清配制而成。细胞每2天传1次代,传3代后,制备细胞悬浮液,用细胞自动计数仪计算细胞密度。将计算好的细胞悬浮液加入96孔超低吸附板中,每孔加入200 μL细胞悬浮液,每孔细胞数为6 000个,放入细胞培养箱中。3天后,给细胞球换液,用排枪小心吸取100 μL旧液,加入100 μL新培养液。之后,每隔2天换1次液。细胞球生长第11天时,细胞直径大于800 μm,准备开始搜集细胞球用于代谢物的提取和成像样品的制备。
1.3 脂质的提取与分析
收取15个细胞球于2 mL离心管中,用磷酸盐缓冲液(PBS)清洗细胞球3次,加入300 μL冰甲醇以及75 μL去离子水,加入一小勺钢珠,在组织捣碎机中破裂细胞球。收集悬浮液于新的离心管内,用液氮反复冻融5次后,加入225 μL氯仿,混匀后,再加入75 μL去离子水。将离心管涡旋1 min,室温下放置5 min后,转移至-6 ℃离心机中,在12 000 g离心力下离心15 min。取最下层液体,置于1.5 mL离心管内,在冷冻干燥器中旋干,加入100 μL复溶剂(由65%乙腈,30%异丙醇和5%去离子水配制而成),超声仪内超声直至黄色脂质沉淀完全溶解,然后在4 ℃以8 000 g离心力下离心5 min,取80 μL上清液至进样小瓶中,待上机检测。
采用C18反向色谱柱进行脂质分离,流动相A为含有0.1%甲酸、10 mmol/L甲酸铵的异丙醇-乙腈混合液(90∶10,V/V),B为含有0.1%甲酸、10 mmol/L甲酸铵的乙腈-水混合液(60∶40,V/V),流速0.26 mL/min;进样体积10 μL;梯度洗脱条件:0~1 min(30%A),1~2 min(30%~45%A),2~7 min(45%~70%A),7~9 min(70%~85%A),9~17 min(85%~100%A),17~19 min(100%A),19~20 min(100%~30%A),20~24 min(30%A);样品温度8 ℃,柱温箱温度50 ℃;质量扫描范围m/z100~1 200。将采集的数据导入Lipidsearch 4.0软件中,选定负模式搜索,母离子和子离子的质量偏差设为1×10-5,离子加合形式选择[M-H]-。
1.4 冰冻切片的制备和基质的喷涂
三维肿瘤细胞球冰冻切片的制备:在样品载物台上滴加2%羧甲基纤维素,待液体冷却形成冰块后,置于冰冻切片机内切割,直至冰块表面形成完整的切面。用记号笔标记样品载物台放置方向,取出样品载物台至机内预冷台面。用生理盐水清洗细胞球3次,用预先修剪过的200 μL枪头吸取细胞球,待细胞球落至枪头底部时,将细胞球小心地转移至冰块上。由于冰块上方的温度很低,包有细胞球的液滴会被立即冻住。此时取出样品载物台至室温,在冰冻的液滴周围滴加OCT胶,放回冰冻切片机内冷却。待OCT胶冰冻后,将样品载物台按先前标记的位置放好,进行切片。选择切片厚度50 μm,快切至肉眼看到细胞球时,将切片厚度设置为14 μm,慢慢切割,直至切出含有细胞球的切片。将切片转移至氧化铟锡(ITO)导电玻璃板上,放入真空干燥瓶内,直至样品抽干。
将DHB溶于纯甲醇中,终浓度为15 g/L;将9AA溶于95%乙腈中,终浓度为 3 g/L;将DCTB溶于纯二氯甲烷中,终浓度为5 g/L。用手动喷枪将基质喷涂至载有细胞球的ITO玻璃板上,其中DHB、9AA、DCTB的喷涂量分别为150、45、40 mg。
1.5 质谱成像数据的采集与处理
按照供货商推荐的数值设置大气压MALDI参数,其中激光能量为30%,激光频率为3 000 Hz,采集速率8 mm/min,采集方向为横扫,行间距为20 μm。质量扫描范围m/z80~1 000,负离子扫描模式,离子传输管温度350 ℃,喷雾电压3.25 kV。
数据采集完成后,首先通过MSconvert软件将原始文件格式转换成imzML格式;然后将多行数据合并为一个完整的数据,并导入Sclislab2020软件进行数据处理分析。数据矫正模式为TIC,图像显示选择weak denoising。为确认成像数据中对应的质荷比是何种物质,首先将需要确认的质荷比与脂质分析得到的数据库进行匹配,若匹配不上,则再与Lipidmap数据库进行匹配。对于非脂质分子化合物,则选择与Metlin数据库进行匹配。匹配的质荷比偏差设置为1×10-5,离子加合形式选择[M-H]-。
2 结果与讨论
2.1 三维肿瘤细胞球区域分割分析

注:标尺长度为500 μm图1 三维细胞球的外层区质谱图(a)、区域分割分析(b)以及内层区质谱图(c)Fig.1 Mass spectrum in the outer region of 3D cell spheroid (a), segmentation analysis (b) and mass spectrum in the centre region of 3D cell spheroid (c)
有研究[4]指出,随着细胞球体积逐渐增大,培养基中的营养物质和氧气越来越难渗透到细胞球内部,这使得内部的细胞开始逐渐不生长甚至发生凋亡,而细胞球外围的细胞易于从培养基中获取营养物质和氧气,因此它们有着较快的生长增殖速度[1]。为验证这一说法,利用Sclislab2020软件中的区域分割功能对细胞切片球进行分析。由于不同状态的细胞代谢特征有着明显差异,细胞球切片可以清晰地分为外围黄色区域以及内层蓝色区域,其分别由2 192、1 538特征谱图构成,示于图1b。
为了证明细胞球外围区和内层区代谢谱图的差异,使用MSIreader软件对细胞球外层和内层的谱图进行比较,谱峰范围在m/z750~900之间。实验发现,m/z887.560 5、885.549 6峰的信号强度在外围区高于内层区;m/z769.400 5、753.410 0峰的信号强度在内层区高于外层区;而m/z835.525 0、788.525 4峰的信号强度在外层区和内层区无明显差异,示于图1a,1c。这些峰在细胞球不同层间的信号强度差异在成像数据中得到了证明。
2.2 三羧酸循环中4种代谢物的空间分布
三羧酸循环是有氧呼吸第二阶段发生的反应,也可称为Krebs循环或者柠檬酸循环,该反应主要发生在线粒体基质[13]。三羧酸循环可以将糖酵解过程中产生的丙酮酸氧化为二氧化碳,产生还原型烟酰胺腺嘌呤二核苷酸(NADH),促进氧化磷酸化。该代谢途径在能量代谢过程中起着重要作用。据文献[9,14]报道,DHB和9AA两种基质对能量代谢相关的小分子具有良好的信号响应,因此本实验选取了这两种基质进行实验,结果列于表1。可以发现,在质荷比偏差小于1×10-5范围内,苹果酸、草酰乙酸以及琥珀酸能够在DHB基质中检测到,而α-酮戊二酸、苹果酸以及琥珀酸能够在9AA基质中检测到,这表明不同基质对不同物质的信号响应有差异。三羧酸循环中的柠檬酸和延胡索酸代谢物没有被检测到。

表1 大气压MALDI串联四极杆-轨道离子阱质谱仪检测到的代谢小分子信息Table 1 Information of metabolites detected by an atmospheric pressure matrix-assisted laser desorption/ionization-quadrupole-exactive-focus mass spectrometry platform
本课题组发现[10],低剂量的双酚S暴露能够显著促进乳腺癌三维细胞球增殖,代谢组学数据分析表明,三羧酸循环通路中苹果酸、柠檬酸、琥珀酸以及延胡索酸的含量水平发生了显著性地上调。然而,使用真空MALDI飞行时间(TOF)质谱仪以及相同的基质并没有检测到细胞球内三羧酸循环中相关的代谢物。本实验采用的高分辨四极杆-轨道离子阱质谱仪的检测灵敏度和质量分辨率优于飞行时间质谱仪。进一步的成像分析数据显示,检测到的4种代谢物均分布于细胞球的全部区域,表明它们在不同细胞状态下的代谢水平没有显著性差别,示于图2。
2.3 甘油磷脂的空间分布
甘油磷脂是一类主要参与维持细胞膜结构和功能的生物分子,在维持机体的生命活动中起着重要作用[15]。根据极性头部取代基团的不同,可将甘油磷脂分为磷脂酰肌醇(phosphatidylinositol, PI)、磷脂酸(phosphatidic acid, PA)、磷脂酰乙醇胺(phosphatidylethanolamine, PE)和磷脂酰甘油(phosphati-dylglycerol, PG)等。为了研究甘油磷脂分子在细胞球内的分布,在负离子模式下选用DCTB基质进行实验。在质荷比偏差小于1×10-5范围内,检测到了18种脂质分子,包括6种PI,5种PA,1种PE,2种溶血磷脂酸(lysophosphatidic acid, LPA),1种溶血磷脂酰肌醇(lysophosphatidylinositol, LPI),2种磷脂酰甘油磷酸(phosphatidylglycerol phosphate, PGP)和1种PG。在6种PI中,有3种分布在全区域,2种分布在外围区,1种分布在内层区;在5种PA中,有4种分布在外围区,1种分布在全区域;1种PE(18∶1/22∶6)分布在全区域;在LPA中,LPA(O-18∶2)分布在全区域,而LPA(20∶1)分布在内层区;1种LPI(18∶0)分布在全部区域;在PGP中,PGP(O-30∶3)和PGP(30∶2)均分布在内层区;1种PG分布在外围区,示于图3。以上数据与区域分割分析的数据吻合,表明甘油磷脂在三维细胞球内的空间分布具有多样性。
本课题组[12]对使用真空MALDI-TOF仪研究三维细胞内的脂质分布进行了报道。本实验数据也表明了甘油磷脂的分布具有空间多样性,例如,发现PE(18∶0/20∶4)分布在细胞球的外围区,PI(18∶0/18∶1)分布在内层区,PE(16∶0/18∶1)则分布在全部区。这可能是由于甘油磷脂不仅在维持细胞膜的结构和功能方面起作用,还参与细胞内其他的生物过程,例如细胞的增殖和凋亡[15]。据报道,棕榈油酸能够通过PI生物合成通路选择性地与PI结合,从而引起细胞的增殖[16]。LPA能够与鞘氨醇-1-磷酸协同促进G蛋白通路,提供LPA和鞘氨醇-1磷酸受体,从而影响细胞存活[17]。

注:标尺长度为500 μm图2 三羧酸循环中代谢物离子在三维细胞内的空间分布图,以及代谢物离子在三维细胞内层和外层的信号强度箱线图Fig.2 Ion images of metabolites in TCA cycle and box-and-whisker plots corresponding to the intensity of metabolites in the centre and outer regions of 3D cell spheroids
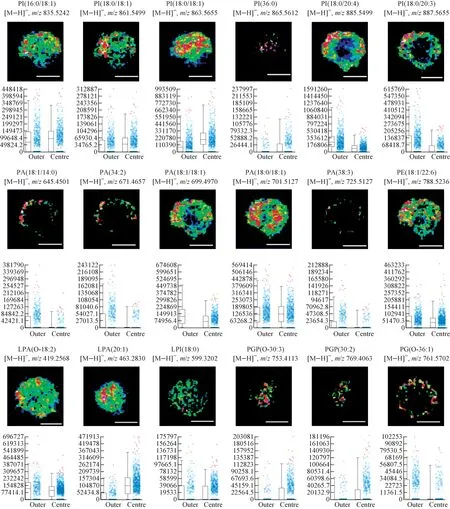
注:标尺长度为500 μm图3 不同脂质离子在三维细胞内的空间分布图,以及对应脂质离子在三维细胞内层和外层的信号强度箱线图Fig.3 Ion images of different lipids and box-and-whisker plots corresponding to the intensity of different lipids in the centre and outer regions of 3D cell spheroids
2.4 代谢通路联合分析
通过代谢网络分析,本实验分析检测的22种代谢物主要涉及三羧酸循环通路、甘油磷脂的合成和分解通路两种代谢途径,示于图4。在三羧酸循环中,丙酮酸进入线粒体基质后发生氧化,与辅酶A反应生成乙酰辅酶A、还原型辅酶I和二氧化碳。甘油三磷酸在乙酰辅酶A和甘油三磷酸脂肪酸转移酶的共同作用下生成LPA,继续通过一系列的合成通路生成其他不同类型的甘油磷脂(例如,PA、PG、PE和PI)。甘油磷脂也可以通过分解通路生成溶血甘油磷脂(例如LPI)。在生物体内,甘油磷脂的合成与分解之间的内稳态平衡确保了生命活动的有序进行。

图4 三羧酸循环(a)和甘油磷脂合成及降解(b)的代谢通路Fig.4 Pathways of TCA cycle (a) and biosynthesis and degradation of glycerophospholipids (b)
3 结论
本实验建立了大气压MALDI串联四极杆-轨道离子阱质谱法原位检测三维肿瘤细胞球内的代谢物,分析了22种内源代谢物在细胞球内的空间分布,包括4种涉及三羧酸循环的代谢物以及18种涉及甘油磷脂合成和分解的脂质分子。结果表明,三羧酸循环中,4种代谢物分布在细胞球的全部区域。在甘油磷脂合成和分解通路中,脂质分子在细胞球的中心区域、外围区域和全部区域均有分布。区域分割分析数据表明,外围区域和中心区域内的细胞代谢特征有明显差异。本工作可为研究肿瘤内分子代谢机制提供思路,也可为利用分子成像技术探究药物对肿瘤细胞的作用机制提供方法参考。

