ERK5对人肺成纤维细胞自噬、凋亡和增殖的调控
华晓敏,王昌明
(桂林医学院附属桂林市人民医院呼吸内科,广西桂林 541000)
细胞外信号调节激酶5(ERK5)是一种促分裂原活化蛋白激酶,在许多组织中普遍表达,并被多种细胞外刺激信号激活,以调节细胞增殖和分化、细胞存活、抗凋亡信号传导[1]。ERK5属于促分裂原活化蛋白激酶(MAPK)信号家族,其氨基末端激酶结构域具有相对较大的羧基末端,由于此独特的结构和功能使其与其他MAPK成员区分开[2]。研究表明ERK5作为不同癌症的靶向因子,抑制ERK5活性或沉默ERK5在癌细胞中具有抗增殖活性,并在动物模型中阻断肿瘤生长[3]。已有研究发现ERK5抑制剂有缓解博来霉素诱导的小鼠肺纤维化的作用[4],但其对减轻肺纤维化的机制尚未有充足的研究。本研究通过细胞实验探讨ERK5对成纤维细胞增殖、凋亡和自噬的调控及对成纤维细胞向肌成纤维细胞转化的影响,为研究肺纤维化的发生机制提供新的思路。
1 材料与方法
1.1 实验细胞
人肺成纤维样细胞系(HLFs),细胞编号KCB200695,来源于中国科学院昆明细胞库。细胞培养箱条件:5% CO2、37 ℃培养箱。完全培养基:DMEM高糖培养基+10%胎牛血清(美国Gibco公司)+0.5%青霉素-链霉素混合液。
1.2 主要实验试剂
Recombinant Human转化生长因子β1(TGF-β1)2 μg粉剂(美国PeproTech公司),用含海藻糖溶液溶解至10 μg/mL,分装后于-80 ℃储存。Vector-flag空载体、ERK5-flag(吉玛基因)各50 μg干粉分别经短暂高速离心后溶于50 μL ddH2O,溶解为1 μg/μL的储存液,分装后于-20 ℃储存。DMEM高糖培养基(美国Gibco公司),胎牛血清(Gibco FBS-10099-141,美国Gibco公司),1%青霉素及链霉素(美国Gibco公司),0.25%含乙二胺四乙酸(EDTA)胰酶(美国Gibco公司)。α-SMA、Fibronectin、Bcl-2、Cleaved-Caspase3和增殖细胞核抗原(PCNA)一抗(美国Abcam公司),辣根过氧化物酶标记过的二抗(北京中杉金桥生物技术有限公司)。细胞增殖/毒性检测(CCK8)试剂盒(美国MCE公司)。细胞凋亡双染试剂盒(美国BD公司)。
1.3 方法
1.3.1实验分组
(1)建立肺纤维化细胞模型:NC组、TGF-β1组。(2)检测细胞增殖、凋亡:vector组、ERK5组、vector+TGF-β1组、ERK5+TGF-β1组。(3)检测细胞自噬:vector组、ERK5组、 ERK5+TGF-β1组、vector+TGF-β1组、ERK5+TGF-β1+Rapamycin组、Rapamycin对照组。
1.3.2Western blot
建立浓度为10 ng/mL的TGF-β1作用24 h诱导HLFs肺纤维化模型,采用Western blot检测各组细胞表型转化标志性蛋白Fibronectin、α-SMA的表达水平;HLFs经过转染过表达ERK5基因的质粒(ERK5)48 h后,再用TGF-β1处理,采用Western blot分别检测各组自噬相关蛋白P62、Beclin-1和LC3Ⅱ的表达水平,凋亡相关因子Cleaved-Caspase-3和Bcl-2的蛋白表达水平,PCNA的表达水平。细胞培养完成后,经RIPA裂解液裂解后提取总蛋白,蛋白定量采用BCA试剂盒定量方法,制备等质量上样蛋白样品,经过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳后使蛋白质转移到聚偏氟乙烯(PVDF)膜上,封闭和孵育抗体后,在暗室中压片,将胶片扫描到电脑后进行条带灰度值量化分析。
1.3.3CCK8检测细胞增殖
HLFs在96孔板中培养24 h,每组设置6个复孔,经过TGF-β1处理24 h、转染48 h后加入用完全培养基稀释10倍的CCK8试剂,设置3个空白对照组,加入CCK8试剂后孵育4 h后,用多功能酶标仪检测吸光度(A)值,波长取460 nm。计算:细胞增殖率(%)=[实验组A值-空白对照组A值]/[NC组A值-空白对照组A值]。
1.4 统计学处理
应用SPSS20.0软件进行数据统计学分析。用单因素方差分析,先进行正态性检验和方差齐性检验,符合正态分布、方差齐者两两比较采用S-N-K法分析,方差不齐者采用Dunnett′st3检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 HLFs中Fibronectin和α-SMA的表达
TGF-β1处理后,Western blot检测结果显示TGF-β1组中Fibronectin和α-SMA蛋白相对表达较NC组明显增加,见图1。
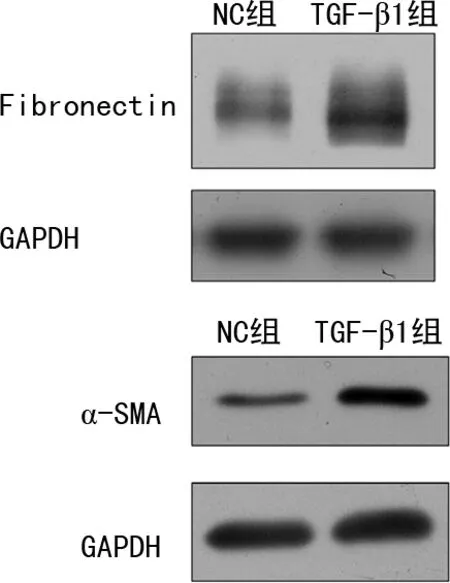
图1 Western blot检测HLFs中Fibronectin和α-SMA的表达
2.2 过表达ERK5促进HLFs中α-SMA的表达
Western blot检测结果显示:过表达ERK5组ERK5表达水平较vector组明显增加(图2)。过表达ERK5后,TGF-β1处理细胞24 h,Western blot检测α-SMA蛋白相对表达水平。结果显示:与vector+TGF-β1组相比,ERK5+TGF-β1组α-SMA蛋白相对表达水平增加(图3)。
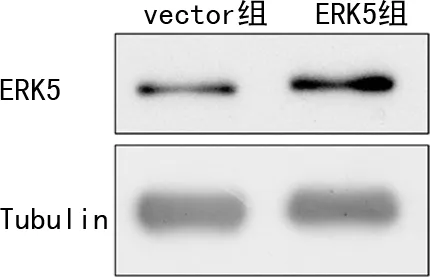
图2 Western blot检测过表达ERK5效果
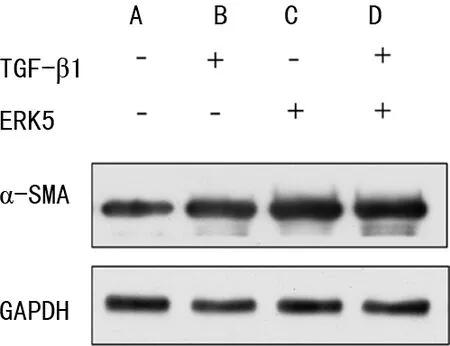
A:vector组;B:vector+TGF-β1组;C:ERK5组;D:ERK5+TGF-β1组。
2.3 过表达ERK5促进HLFs增殖
过表达ERK5基因后,TGF-β1处理细胞24 h,Western blot检测PCNA的表达,CCK8检测细胞增殖率。结果显示:与vector+TGF-β1 组相比,ERK5+TGF-β1组PCNA相对表达水平,见图4;vector+TGF-β1组较vector组细胞增值能力增强,ERK5+TGF-β1组较vector+TGF-β1 组细胞增殖能力增强,差异有统计学意义(P<0.01),见图5。
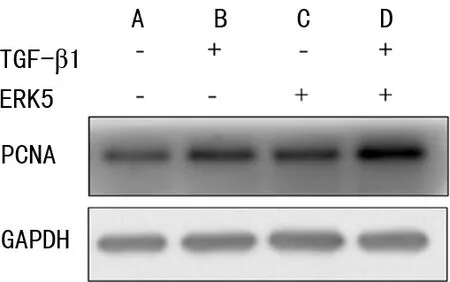
A:vector组;B:vector+TGF-β1组;C:ERK5组;D:ERK5+TGF-β1组。
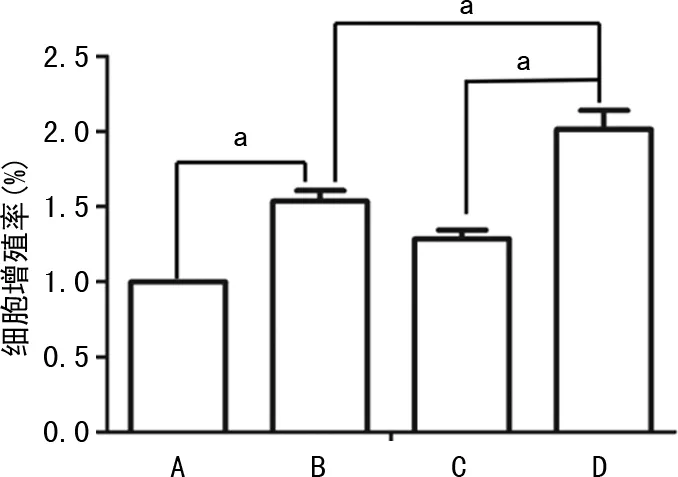
A:vector组;B:vector+TGF-β1组;C:ERK5组;D:ERK5+TGF-β1组。a:P<0.05。
2.4 过表达ERK5抑制HLFs凋亡
过表达ERK5基因后,TGF-β1处理细胞24 h,Western blot检测Bcl-2和Cleaved-Caspase-3的表达。与vector+TGF-β1组比较,ERK5+TGF-β1组Cleaved-Caspase-3蛋白相对表达水平降低,Bcl-2蛋白增加,见图6。
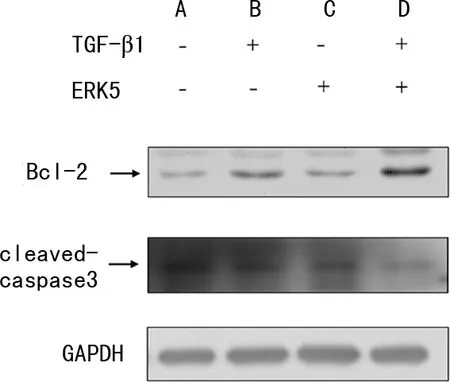
A:vector组;B:vector+TGF-β1组;C:ERK5组;D:ERK5+TGF-β1组。
2.5 过表达ERK5抑制HLFs自噬
ERK5+TGF-β1组较vector+TGF-β1组P62蛋白相对表达水平增加,LC3Ⅱ、Beclin-1蛋白相对表达水平降低,表明细胞自噬受到抑制;α-SMA蛋白相对表达水平增加,表明细胞表型转化增加。应用自噬激活剂后的ERK5+TGF-β1+Rapamycin组较ERK5+TGF-β1组α-SMA、P62蛋白相对表达水平均降低,LC3Ⅱ、Beclin-1蛋白相对表达水平增加,表明自噬受到激活后抑制了细胞表型转化,见图7。
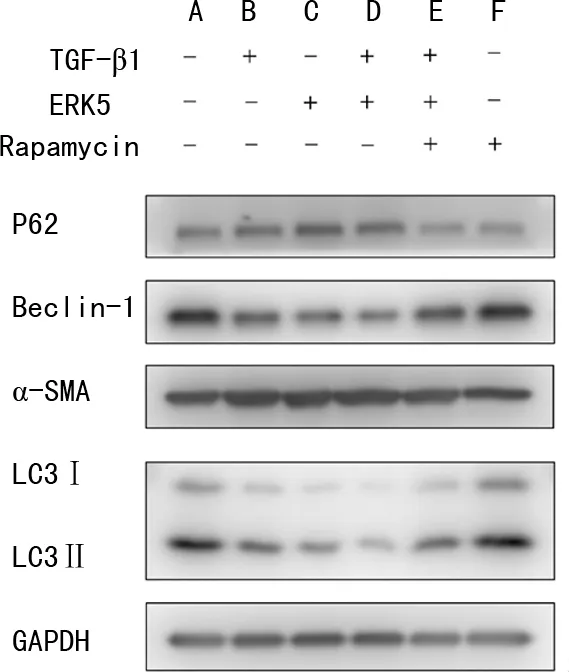
A:vector组;B:vector+TGF-β1组;C:ERK5组;D:ERK5+TGF-β1组;E:ERK5+TGF-β1+Rapamycin组;F:Rapamycin对照组。
3 讨 论
肺纤维化是一种以持续上皮细胞损伤和过量细胞外基质沉积为主要病理特征的慢性纤维增生性疾病。在疾病的发展过程中,成纤维细胞向肌成纤维细胞(MF)的转化,进而分泌胶原、促进细胞外基质的沉积[5]。TGF-β1是致肺纤维化关键性的细胞因子,其在促进肺成纤维细胞的表型转化和细胞外基质沉积过程发挥着重要作用。已有研究表明在肺纤维化中 TGF-β1 mRNA 水平高表达[6]。Fibronectin、α-SMA、Collagen-Ⅰ等是成纤维细胞转化为肌成纤维细胞的标志因子,在肌成纤维细胞中,此类因子的表达水平明显高于在成纤维细胞[7]。在本研究中,以Fibronectin和α-SMA的蛋白表达水平反映HLFs向肌成纤维细胞的表型转化情况。经TGF-β1处理HLFs后,Western blot检测结果显示α-SMA和Fibronectin的蛋白表达水平明显增加,证明实验中TGF-β1成功诱导HLFs的表型转化。过表达ERK5后,Western blot检测结果显示α-SMA蛋白表达量增加,说明ERK5可促进TGF-β1诱导的HLFs表型转化过程。
体内细胞增殖的测量通常通过检查静态方法来进行,比如检测标记物指数,包括DNA合成标记物如溴脱氧尿苷,或固有标记物如Ki67和增殖细胞核抗原(PCNA)[8]。PCNA是存在于真核细胞核中的一种多功能蛋白质,它作为DNA复制和修复的组成部分发挥重要作用[9]。通过Western blot检测PCNA的表达水平,结果表明过表达ERK5 后,PCNA表达水平升高,CCK8细胞增殖检测到过表达ERK5后细胞增殖率上升,说明ERK5促进HLFs增殖。但在HLFs表型转化过程中,ERK5调控细胞增殖的分子机制及其与在表型转化中发挥的作用需要进一步探讨。
细胞凋亡是指机体细胞在发育过程中或在某些因素作用下通过细胞内基因及其产物的调控而发生的程序性细胞死亡过程[10]。细胞凋亡被认为是各种过程的重要组成部分,细胞凋亡对组织内正常细胞群的稳定、机体的防御和免疫反应、疾病或中毒时引起的细胞损伤、老化、肿瘤的发生进展起着重要作用[11]。非正常的细胞凋亡(太少或太多)是许多人类疾病的一个重要因素,包括自身免疫性疾病和许多类型的癌症。Bcl-2是凋亡调节蛋白家族的创始成员,破坏Bcl-2会导致细胞死亡,抗凋亡的Bcl-2被归为致癌基因,研究表明Bcl-2基因的损伤会引起多种癌症,包括淋巴瘤等[12]。Caspase-3是一种凋亡效应类蛋白,Caspase-3的活化(Cleaved-Caspase-3即Caspase-3的活化形式)可直接促使细胞发生凋亡,因此,检测Cleaved-Caspase-3的蛋白表达水平可直观地反映HLFs凋亡情况。而Bcl-2的过度表达可抑制Caspase-3的活化,阻断凋亡进程[13]。所以Bcl-2的表达水平,可在一定程度上反映细胞凋亡抑制情况。在本研究中,过表达ERK5后,Cleaved-Caspase-3的蛋白表达水平明显降低,而Bcl-2的蛋白表达水平增加,说明在TGF-β1诱导的细胞表型转化过程中,ERK5起到抑制凋亡的作用。
细胞自噬导致真核细胞内一部分受损、多余的或老化的细胞器及大分子蛋白质被吞噬和降解,从而更利于细胞的存活,该过程的功能障碍导致许多疾病的发生[14]。Beclin-1、LC3、P62是目前研究相对较成熟的自噬相关蛋白。Beclin-1介导细胞自噬起始过程,在启动阶段发挥了重要作用,研究表明在哺乳动物中Beclin-1的过表达可刺激自噬[15];LC3是自噬标志物,自噬形成时,胞浆型LC3(即LC3-Ⅰ)酶解掉一小段多肽,转变为膜型LC3(即LC3-Ⅱ),LC3Ⅱ参与自噬溶酶体的形成,所以LC3-Ⅱ的蛋白表达水平可反映细胞自噬水平的高低[16];P62 可作为将要被自噬作用降解的小泡的受体,在自噬形成的过程中不断被消耗,所以其表达水平可间接反映细胞自噬情况[17]。在TGF-β1诱导HLFs表型转化过程中,过表达ERK5后,Western blot检测结果显示LC3Ⅱ与Beclin-1的表达水平降低,P62表达水平升高,说明ERK5抑制HLFs自噬;过表达ERK5后,表型转化的标志性蛋白α-SMA表达水平升高,说明ERK5参与了TGF-β1诱导的细胞表型转化。应用自噬激活剂后,与未激活自噬组相比,α-SMA组的表达水平下降,说明ERK5有可能通过抑制自噬来促进α-SMA的表达。这为进一步研究ERK5、自噬、肺成纤维细胞表型转化过程的相互关系提供了一定的基础依据,但细胞自噬是一个复杂的动态过程,若要明确ERK5是否通过在细胞自噬过程中发挥作用,进而影响表型转化过程,需要更深入的研究。

