三七总皂苷通过激活PI3K/AKT/mTOR 信号通路调控低氧高二氧化碳环境下大鼠PASMCs的自噬和增殖*
陈玲珑, 武垣伶 , 张 赛 , 黄丹娜, 王万铁△
(1温州市人民医院急诊医学科,浙江温州325000;2温州医科大学生理学与病理生理学系,浙江温州325035;3山西白求恩医院检验科,山西太原030000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以肺气流慢性阻塞为特征、会干扰正常呼吸且不能完全逆转的疾病[1],进一步发展可能导致慢性肺心病的发生。肺动脉高压(pulmonary hypertension,PH)是肺心病的特征性改变,直接影响肺心病的预后,其病理特征是阻塞性血管重构,部分原因是过度的肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)增殖[2]。
三七总皂苷(Panax notoginsengsaponins,PNS)为三七根茎的主要活性成分,主要含有人参皂苷Rg1、人参皂苷 Rb1 及三七皂苷 R1[3]。PNS 具有抑制血管平滑肌细胞增殖和迁移[4],减少血小板聚集[5]和抗动脉粥样硬化的作用[6]。但PNS 干预低氧高二氧化碳性肺动脉高压(hypoxic hypercapnia-induced pulmonary hypertension,HHPH)的具体作用机制尤其在涉及到自噬相关通路方面并不是十分明了。因此,本研究以基于磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB/AKT)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路的细胞自噬为切入点,探讨PNS在低氧高二氧化碳(hypoxia and hypercapnia,HH)环境下对大鼠PASMCs 自噬和增殖的调控作用。
材料和方法
1 细胞和主要试剂及仪器
大鼠PASMCs 购于北京中科质检生物技术有限公司。PNS 购于成都德思特生物技术有限公司;LY294002及兔抗大鼠AKT、p-AKT、mTOR、p-mTOR、LC3B、P62 和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体购于MCE;HRP 标记的山羊抗兔IgG 购于Biosharp;高糖DMEM 培养基和胎牛血清购于Gibco;CCK-8 试剂盒购于Dojindo。酶标仪(Bio-Rad);电泳仪(北京六一仪器厂);荧光显微镜(Nikon);蛋白电泳/转膜仪(Bio-Rad);透射电镜(HITACHI);化学发光成像仪(上海勤翔科学仪器)。
2 实验方法
2.1 细胞模型的制备及分组 取符合条件的细胞,随机分为5组,饥饿处理 24 h。(1)对照(control,CON)组:置于常氧(21% O2,5% CO2,37 ℃)箱内用DMEM 高糖培养基培养24 h;(2)HH 组:置于造模箱(5%O2,6%CO2,37 ℃)内用DMEM 高糖培养基培养24 h;(3)HH+PNS 组:在 DMEM 高糖培养基中加入200 mg/L PNS 并置于造模箱内培养24 h;(4)PI3K 抑制剂 LY294002 组(HH+LY 组):在DMEM 高糖培养基中加入20 μmol/L LY294002 并置于造模箱内培养24 h;(5)HH+PNS+LY 组:在DMEM 高糖培养基中加入 20 μmol/L LY294002 和 200 mg/L PNS 并置于造模箱内培养24 h。
2.2 CCK-8 法检测细胞活力 按每孔1×104个细胞数铺96 孔板(每组3 或4 个复孔)于37 ℃培养24 h。造模结束后,弃去培养基混合液,PBS 洗涤,每孔加入 110 μL 混合液(100 μL 纯培养基+10 μL CCK-8 溶液),不要有气泡。放入37 ℃常氧培养箱。孵育适当时间(50 min左右),用酶标仪测定450 nm处A值。
2.3 RT-qPCR 检 测 AKT、mTOR、LC3 和 p62 的mRNA 表达 分组处理完毕的细胞去除培养液洗涤后,每孔加960 μL Trizol,用细胞刮刀刮下细胞,加入192 μL 氯仿混匀静置,吸取上层水相(约400 μL)加等体积异丙醇使RNA 沉于管底,弃上清加960 μL 75%乙醇使沉淀悬浮,再次离心收集RNA。测完RNA 浓度后,按说明书进行第1 链cDNA 合成和gDNA 去除及RT-qPCR 体系与条件的操作。引物序列设计与合成见表1。

表1 RT-qPCR引物序列Table 1.The sequences of the primers for RT-qPCR
2.4 Western blot 检 测 PASMCs 中 AKT、p-AKT、mTOR、p-mTOR、LC3B、P62 和 PCNA 的蛋白水平分组处理完毕的细胞用PBS清洗后加入1 mL细胞裂解混合液(PMSF∶RIPA=1∶100),离心后收集上清于新的1.5 mL EP 管。用BCA 浓度测定试剂盒检测所收集的上清液蛋白总浓度。将测好浓度的蛋白样品与相应体积的loading buffer 混合后,于100 ℃煮沸5 min 备用。每孔20 μg 的蛋白上样量进行电泳,并转膜至PVDF 膜后将其置于5%脱脂牛奶中室温摇晃封闭2 h。加Ⅰ抗(抗AKT、mTOR、p-mTOR、LC3B、PCNA 和 GAPDH 抗体稀释比例均为 1∶1 000,抗 p-AKT 抗体稀释比例为1∶2 000)于4 ℃冰箱中孵育过夜。次日取出PVDF 膜用TBST 快速漂洗后,加Ⅱ抗(用TBST 稀释辣根过氧化物酶标记的山羊抗兔Ⅱ抗,比例为1∶10 000)于室温缓慢孵育1 h。配制化学发光液,将漂洗后的PVDF 膜置于曝光仪中,滴加发光液,曝光并保存结果。
2.5 透射电镜观察PASMCs 中自噬小体 取长势良好的对数期的血管平滑肌细胞制成细胞悬液并离心,加入预冷的2.5%戊二醛固定液于4 ℃固定,经0.1 mol/L PBS 漂洗后每管加入1 滴1%锇酸固定液后放入37 ℃烘箱1 h 进行后固定。再次漂洗后每管加入1 滴1%醋酸铀染色液放置1 h 进行块染。将标本分别浸入70%、80%和90%丙酮脱水各10 min,后浸入纯丙酮2次,共20 min(通风柜中进行)。浸透时分3 步:丙酮∶包埋液=1∶1,37 ℃烘箱1 h;丙酮∶包埋液=1∶4,37 ℃烘箱过夜;纯包埋液45 ℃烘箱1 h。包埋聚合后,依次进行半薄切片,超薄切片,最后用透射电镜观察及拍片。
3 统计学处理
采用SPSS 21 软件对各组实验数据进行统计学分析。所有实验数据均进行正态性检验,计量资料以均数±标准差(mean±SD)表示。多组样本的均数比较采取单因素方差分析(one-way ANOVA)。若方差齐,则采用SNK-q检验进行两两组间比较;若方差不齐,则采用 Dunnett's T3 检验。以P<0.05 为差异有统计学意义。
结 果
1 PNS浓度的确定
CCK-8 结果显示 ,与 0 mg/L组相比 ,3.125、6.25、12.5、25、50 和 100 mg/L 组细胞存活率的差异无统计学显著性(P>0.05),200 mg/L 组的细胞存活率明显降低(P<0.05),400、800 和1 600 mg/L 组的细胞存活率过分降低。因此,选择200 mg/L 作为此研究中PNS的浓度,见图1。

Figure 1.Effects of different concentrations of PNS on the survival rate of PASMCs.Mean±SD. n=3.*P<0.05 vs 0 mg/L group.图1 不同浓度三七总皂苷对大鼠PASMCs存活率的影响
2 各组细胞活力
结果显示,与CON 组相比,HH 组细胞活力减弱(P<0.05);与HH 组相比,HH+PNS组及HH+LY 组细胞活力均减弱(P<0.05);与HH+PNS 组相比,HH+PNS+LY组细胞活力无显著改变(P>0.05),见图2。

Figure 2.The viability of PASMCs in each group.Mean±SD.n=4.*P<0.05 vs CON group;#P<0.05 vs HH group.图2 各组大鼠PASMCs活力的变化
3 各组细胞AKT、mTOR、LC3和P62的mRNA表达
与 CON 组 相 比 ,HH 组 AKT、mTOR 及 P62 的mRNA 表达水平降低(P<0.05);与HH 组相比,HH+PNS 组 AKT、mTOR 及 P62 的 mRNA 表达水平升高,HH+LY 组 AKT、mTOR 及 P62 的 mRNA 表达水平降低(P<0.05);与 HH+PNS 组相比,HH+PNS+LY 组AKT、mTOR 及 P62 的 mRNA 表 达水 平降 低(P<0.05)。与 CON 组相比,HH 组 LC3 的 mRNA 表达水平升高(P<0.05);与HH 组相比,HH+PNS 组LC3 的mRNA 表达水平降低,HH+LY 组 LC3 的 mRNA 表达水平升高(P<0.05);与 HH+PNS 组相比,HH+PNS+LY 组 LC3 的 mRNA 表 达 水 平 升 高(P<0.05)。见图3。
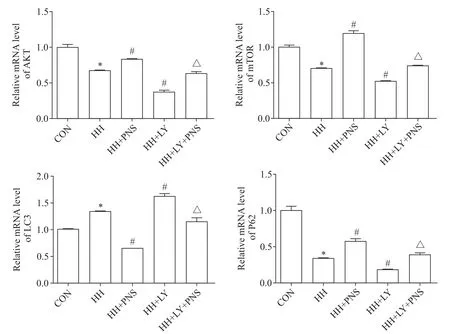
Figure 3.The mRNA levels of AKT,mTOR,LC3 and P62 in each group.Mean±SD. n=3.*P<0.05 vs CON group;#P<0.05 vs HH group;△P<0.05 vs HH+PNS group.图3 各组细胞AKT、mTOR、LC3及P62的mRNA表达情况
4 各组细胞p-AKT、p-mTOR、P62、LC3B和PCNA蛋白水平的比较
与 CON 组相比,HH 组 p-AKT、p-mTOR 和 P62 的蛋白水平降低(P<0.05);与HH 组相比,HH+PNS 组p-AKT、p-mTOR 和 P62 的蛋白水平升高,HH+LY 组p-AKT、p-mTOR 和 P62 的蛋白水平降低(P<0.05);与 HH+PNS 组相比,HH+PNS+LY 组 p-AKT、p-mTOR和P62 的蛋白水平降低(P<0.05)。与CON 组相比,HH 组 LC3B 的蛋白水平升高(P<0.05);与 HH 组相比,HH+PNS 组 LC3B 的蛋白水平降低,HH+LY 组LC3B 的蛋白水平升高(P<0.05);与 HH+PNS 组相比 ,HH+PNS+LY 组 LC3B 的蛋 白水 平升 高(P<0.05)。与 CON 组相比,HH 组 PCNA 的蛋白水平升高(P<0.05);与 HH 组相比,HH+PNS 组 PCNA 的蛋白水平降低,HH+LY 组PCNA 的蛋白水平升高(P<0.05);与 HH+PNS 组相比,HH+PNS+LY 组 PCNA 的蛋白水平升高(P<0.05)。见图4。
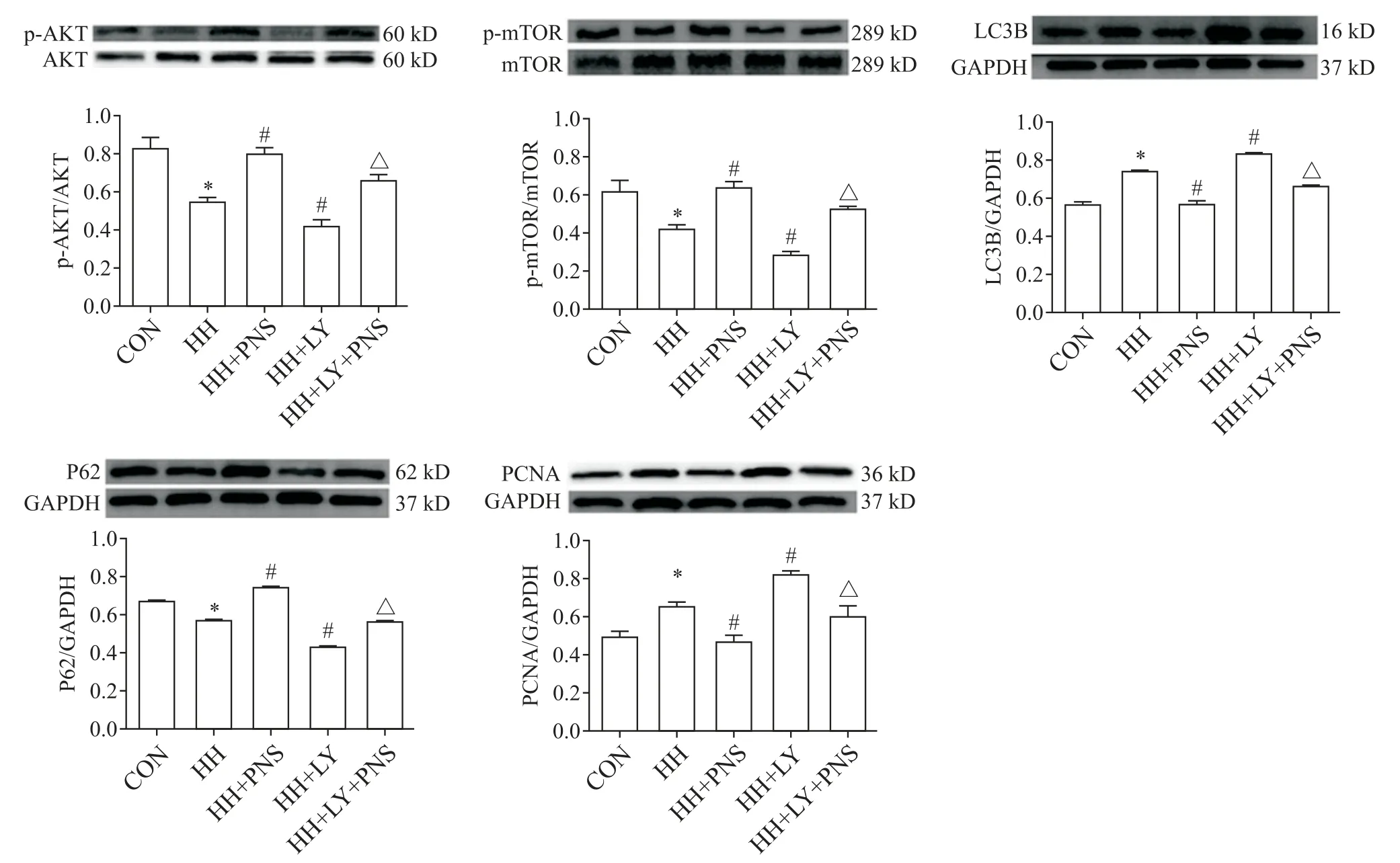
Figure 4.The protein levels of p-AKT,p-mTOR,LC3B,P62 and PCNA in each group.Mean±SD. n=3.*P<0.05 vs CON group;#P<0.05 vs HH group;△P<0.05 vs HH+PNS group.图4 各组细胞p-AKT、p-mTOR、LC3B、P62及PCNA蛋白的表达情况
5 透射电镜观察大鼠PASMCs内自噬小体形成情况
与CON 组相比,HH 组的自噬小体数量增多;与HH 组相比,HH+PNS 组的自噬小体数量明显减少,HH+LY 组的自噬小体数量明显增多;与HH+PNS 组相比,HH+PNS+LY组的自噬小体数量增多,见图5。

Figure 5.The ultrastructural changes of the PASMCs in each group observed by electron microscopy(×25 000).The scale bar=0.2 μm.图5 各组细胞电镜超微结构
讨 论
HHPH 是一个多因子参与的病理生理学过程,包括肺血管收缩(pulmonary vasoconstriction,PV)、肺血管重构(pulmonary vascular structural remodeling,PVSR)及血栓形成等方面[7],其中 PV 和 PVSR 是两个主要的发病环节[8]。在PVSR 中,存在管壁平滑肌细胞、内膜弹力纤维及胶原纤维增生。而PASMCs的增殖和迁移是重要的形成因素。简言之,HH 引起PASMCs 增殖,导致PVSR,加重PH 的发展。对于肺部疾病和(或)低氧引起的PH 而言,其发生往往同时伴随着肺泡和血液中二氧化碳分压的升高[9]。因此,制备低氧伴高二氧化碳混合气体细胞模型能更好地模拟患者的临床发病情况。
自噬普遍存在于真核生物中,是一种细胞在压力条件下的自我适应性机制。这是一把“双刃剑”:在生理条件下低水平自噬作为细胞自稳的保护性机制存在;当受到损伤刺激时,自噬信号高表达参与疾病进程。有研究发现,自噬可以通过调节血管壁细胞的一系列变化从而影响肺血管的稳态[10],从自噬的角度研究PVSR可能会有所突破。
前期动物实验结果显示,PNS 可通过抑制PVSR而减轻 HHPH[11],但它是否通过 PI3K/AKT/mTOR 信号通路介导的细胞自噬来缓解PH 尚未见详细报道,需进一步研究。
本研究在使用PNS 后检测了细胞自噬及增殖的相关指标。结果表明,PNS 可改变HH 环境下PASMCs 的自噬和增殖相关指标,即PNS 可引起HH环境下 PASMCs 中 AKT、mTOR 和 P62 的 mRNA 及 p-AKT、p-mTOR 和 P62 的蛋白水平上调,LC3 的 mRNA和蛋白水平下调,自噬小体数量减少,PCNA 的表达下调。这表明在HH 条件下,加入PNS 有助于降低PASMCs的自噬和增殖,有助于缓解PVSR,维持正常的肺血管形态。
本实验将LY294002 与PNS 合用,结果表明,与HH+PNS 组相比,HH+PNS+LY 组自噬相关指标AKT、mTOR 和 P62 的 mRNA 及 p-AKT、p-mTOR 和P62 的蛋白水平下调,LC3 的mRNA 和蛋白水平上调,自噬小体数量增加,PCNA 的表达上调。这表明加入PI3K/AKT/mTOR 信号通路抑制剂LY294002后,PNS对PASMCs自噬的缓解程度有所减弱。
综上所述,在HH 环境下,PNS 有助于降低大鼠PASMCs的自噬,减弱其增殖,机制可能与激活PI3K/AKT/mTOR信号通路有关。

