HPGD基因表达量与绝经后骨质疏松症的关系探讨
刘枫秀 刘言言 袁璧钗 邱楚佳 杨川
骨质疏松症是一种与年龄相关的骨骼疾病,主要是以单位体积骨量减少,导致骨脆性增加,从而易于发生骨折为特征。流行病学调查显示,目前,全世界约有2 亿人患骨质疏松症[1],而我国在过去12 年中骨质疏松症的患病率明显增加(2008 年以前患病率为14.94%,2012~2015 年期间患病率为27.96%),其中女性患病率明显高于男性(25.41% VS 15.33%)[2]。因此,提高绝经后骨质疏松症防治的水平意义重大。研究表明,绝经后骨质疏松症及其骨折的发生是遗传因素和非遗传因素相互作用的结果,双生子及家系研究表明,骨密度的变异50%~85%是由遗传所决定的[3]。随着遗传变异逐渐认识其在骨质疏松症发病过程的重要性,绝经后骨质疏松症的遗传学已经成为骨生物学研究最为活跃的研究领域之一。厚皮性骨膜病是一种以皮肤增厚、回状颅皮、骨膜肥厚、关节肿胀、杵状指(趾)为临床特征的遗传性骨代谢疾病,HPGD 基因突变被证实其通过改变下游因子前列腺素E2(PGE2)浓度起而成为该病的致病原因[4],而PGE2也是骨质疏松症发病过程中重要的调节因子,而关于HPGD 基因表达与骨质疏松症的关系,目前尚无相关报道,本研究通过测定实验组及对照组HPGD 基因表达水平,探讨HPGD 基因表达量与绝经后骨质疏松症的关系。
1 资料与方法
1.1 一般资料 收集揭阳市人民医院内分泌科 2019 年4 月~2020 年2 月住院的54 例绝经5 年内女性患者作为研究对象,经DAX 检测骨密度,将L1~2T 值≤-2.5 确诊为绝经后骨质疏松症的患者作为实验组(20 例),L1~2T 值>-2.5 确诊为非骨质疏松症患者作为对照组(34 例)。所有研究对象均为无血缘关系的汉族人群。排除标准:排除严重肝肾功能不全、严重心脑血管疾病、恶性肿瘤、其他系统严重器质性病变及服用影响骨代谢的药物,排除其他继发性骨质疏松症。
1.2 方法
1.2.1 临床资料收集和生化指标测定 所有患者为绝经后5 年内女性患者,记录患者的年龄、身高、体重,计算体质量指数(body mass index,BMI):体重(kg)/身高(m)2,记录吸烟、饮酒情况。受检者空腹8 h 以上,清晨采集静脉血,用奥林巴斯AU400 全自动生化仪检测FBG、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)。
1.2.2 性激素6 项测定 清晨空腹抽取所有患者外周血2 ml,离心提取血清,采用放射免疫法测定E2、孕酮(P)、促黄体生成素(LH)、促卵泡刺激素(FSH)、雄激素(T)、泌乳素(PRL)。
1.2.3 骨代谢生化指标及骨密度测定 采用全自动生化分析仪测定所有患者的Ga、IP、ALP、PTH 等骨代谢生化指标;应用法国DMS 公司生产的双能DAX 检测患者腰椎前后位骨密度,自动测出T 值,骨密度检测人员为经过专门培训的同一个技术人员。
1.2.4 HPGD 基因表达水平检测
1.2.4.1 提取人外周血单个核细胞(PBMC)取3 ml装于乙二胺四乙酸(EDTA)管中的人外周全血,按顺序加入磷酸缓冲盐溶液(PBS)等比例稀释,混匀,稀释后的人血(6 ml)沿管壁缓慢加入装有淋巴细胞分离液(3 ml)的试管中,保持淋巴细胞分离液与人血界面明显,离心(420 r,30 min),可见分为四层,血清与淋巴细胞分离液之间的不透明层,即为PBMC,移至新试管中,加入PBS(3 倍PBMC 体积),吹匀,离心(1000 r,5 min),弃上清液,加入2 ml 的红细胞裂解液,吹匀,离心(1000 r,5 min),弃上清液,加入5 ml 的PBS,吹匀,离心(1000 r,5 min),弃上清液。
1.2.4.2 RT-qPCR 检测HPGD 基因表达水平 按照RNAiso Plus 试剂说明书(TAKAR,货号9109) 提取PBMC 总RNA,逆转录成cDNA(TAKARA 货号RR036A),以Actin 作为内参,RT-qPCR(型号Roche LightCycler 480 Ⅱ) 检 测HPGD 基因表达水平,用2-ΔΔCt统计方法分析所有患者HPGD 基因表达水平。RT-qPCR 反应条件:95℃预变性5 min,95℃变性10 s,60℃延伸40 s,共40 个循环。引物设计后外送广州天一辉远基因科技有限公司进行合成,序列见表1。

表1 PCR 引物序列
1.3 观察指标 比较两组年龄、FPG、Ca、IP、ALP、PTH、E2、骨密度T 值及HPGD 基因表达水平。
1.4 统计学方法 采用SPSS22.0 统计学软件进行数据统计分析。计量资料以均数±标准差 ()表示,采用t 检验;RT-qPCR 分析时,用2-ΔΔCt统计方法分析HPGD 基因相对表达量的差异。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组年龄、FPG、Ca、IP、ALP、PTH、E2及骨密度T 值比较 两组年龄、FPG、Ca、IP、ALP、PTH、E2比较,差异无统计学意义(P>0.05);实验组骨密度T值明显低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组年龄、FPG、Ca、IP、ALP、PTH、E2 及骨密度T 值比较()

表2 两组年龄、FPG、Ca、IP、ALP、PTH、E2 及骨密度T 值比较()
注:与对照组比较,aP<0.05
2.2 两组HPGD 基因表达量比较 实验组HPGD 基因表达量(1.079±1.190)明显低于对照组的(2.349± 3.131),差异有统计学意义(P<0.05)。见图1。这表明绝经后骨质疏松症患者HPGD 基因表达显著下调,该基因在绝经后骨质疏松症的发病过程中可能起到某种调控作用。
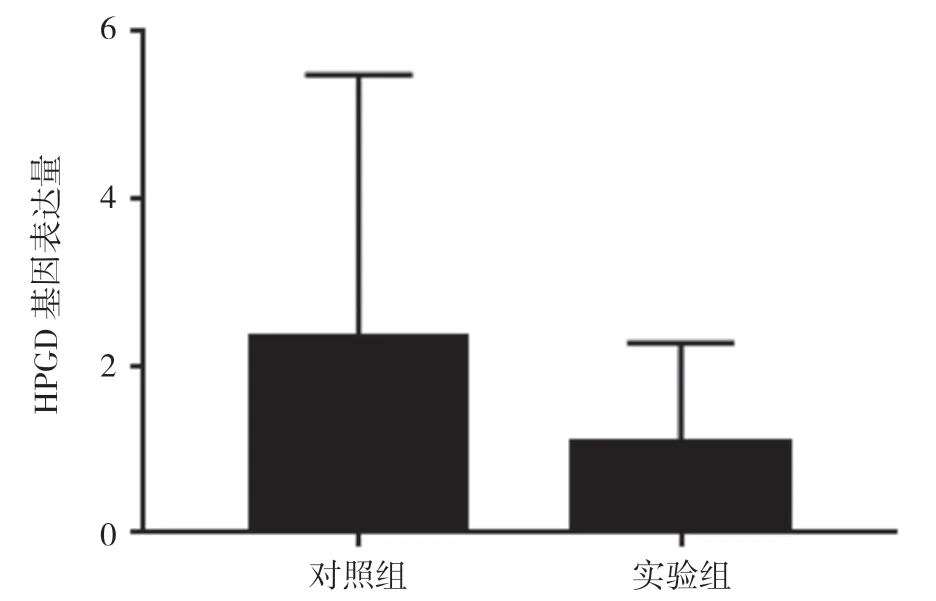
图1 两组HPGD 基因表达水平比较
3 讨论
2008 年,英国Uppal 等首次在厚皮性骨膜病家系中鉴定到HPGD 基因纯合突变,并证实该基因突变是该病的致病原因[4]。HPGD 基因位于染色体4q34.1,长度为31kb,由7 个外显子组成,并编码催化酶15-羟基前列腺素脱氢酶(15-PGDH)[5],该酶通过催化PGE2脱氢生成酮基前列腺素(PGE-M),从而促进前列腺素分解代谢,降低PGE2浓度[6]。厚皮性骨膜病患者因HPGD基因突变,使编码的15-PGDH 蛋白酶丧失正常功能,不能催化PGE2降解,体内PGE2长期慢性增高,导致细胞因子相关的血管扩张和组织重建,并促进成骨细胞和破骨细胞的活性,产生一系列骨膜炎、肢端骨质溶解和骨质增生,最终出现厚皮性骨膜病的病理特 征[7]。
PGE2是一种重要的骨代谢调节因子,在成骨细胞和破骨细胞中均存在受体,不同的受体通过不同的信号通路对骨质疏松起到双重作用,一方面可促进骨形成,另一方面可促进骨吸收,其发挥的作用主要取决于存在的环境条件。本研究检测了绝经后骨质疏松患者(实验组)和非骨质疏松患者(对照组)的临床生化、性激素、骨代谢、骨密度T 值等临床指标,结果显示,两组年龄、FPG、Ca、IP、ALP、PTH、E2比较,差异无统计学意义(P>0.05);实验组骨密度T 值明显低于对照组,差异有统计学意义(P<0.05)。实验组HPGD 基因表达量明显低于对照组,差异有统计学意义(P<0.05)。从而影响下游因子的PGE2的表达水平,而PGE2的生物活性与4 个G 蛋白藕连受体前列腺素E 受体1(EP1)、前列腺素E 受体2(EP2)、前列腺素E 受体3(EP3)、前列腺素E 受体4(EP4)有关[8]。PGE2通过与EP1结合,使Ca2+内流,激活蛋白激酶C(PKC)通路,导致成骨细胞增殖[9],另外可促进大鼠原代成骨细胞纤维连接素的表达[10],还可以通过调控缝隙连接蛋白的生成及转运,使细胞之间的信息传递增加,进而提高去分化脂肪细胞向成骨细胞分化的速度,加快了成骨细胞的成熟还有骨质的重建[11],从而起到抗骨质疏松作用。另外,PGE2可通过激活多个信号通路诱导护骨素(OPG)同源配基核因子-κB 受体激活物配基(RANKL) mRNA 表达,促进破骨细胞生成[12],抑制OPG mRNA 的表达[13],引起 RANKL/OPG 的相对表达增加,促进破骨细胞的分化、成熟和破骨细胞骨吸收。体外研究表明,PGE2可通过EP2抑制由PTH 刺激的骨髓间充质干细胞成骨细胞分化,从而抑制PTH 的成骨作用,而使骨量降低[14]。
综上所述,HPGD 的表达量与绝经后骨质疏松症具有一定的相关性,HPGD 基因低表达可能使绝经后的女性患者罹患骨质疏松症的风险升高。但本研究样本量少,且缺乏对下游因子的进一步研究,后续将进一步探讨HPGD 基因在绝经后骨质疏松症调控过程中可能的信号通路。

