老年人睡眠时间与关键认知功能脑区体积的相关性研究
袁梦雅,洪波,张微,柳安,王静华,刘园园,严峰,王涛*
阿尔茨海默病(Al zheimer's disease,AD)是一种严重威胁老年人健康的神经退行性疾病,是痴呆中最常见的类型[1]。随着人口老龄化,AD正在成为日益严重的公共卫生问题[2]。世界阿尔茨海默病报告[3]显示,2018年全球约有5000万痴呆患者,约每3 s新增1例,到2030年患病人数将增至约8200万,由AD所带来的经济负担和医疗护理负担越来越沉重。目前为止,AD并没有有效的治愈手段。因此,早期预防、早期诊断和早期治疗AD尤为关键。轻度认知功能损害(mil d cognitive impairment,MCI)是一种介于衰老和痴呆之间的状态,特征是认知功能存在损害,但是日常生活功能基本完好[4]。以记忆损害为主要表现的遗忘型轻度认知损害(amnestic MCI,aMCI)在5~10年内有60.5 %~100%的概率会进展为AD[5],通常被视为AD的前驱期。aMCI是能够对AD进行临床早期诊断、早期干预的最佳阶段。在出现aMCI认知功能损害的表现之前,大脑的表观特征已开始发生退行性变化,发现认知功能尚且正常的老年人相关脑区特征性改变的相关因素在AD早期诊治方面具有更大的意义。
越来越多的证据表明,睡眠问题和MCI或AD之间存在双向关系[6-7]。睡眠不足会促进脑淀粉样β蛋白的沉积[8],影响脑皮质的体积[9-10],继而引起较早的认知能力下降。中老年失眠患者3年后发生痴呆的风险是正常对照的2倍以上[11]。睡眠异常不仅是AD和MCI患病的危险因素,还是AD和MCI的临床症状的表现,超过60%的MCI和AD患者至少伴随某种睡眠障碍,其中失眠最为常见[12]。老年人睡眠时间可能是影响AD病理过程中大脑表征改变的重要因素。有荟萃分析表明[13],在MCI患者中,海马、杏仁核、丘脑以及内嗅皮质发生明显的萎缩。另有研究表明[14],在MCI患者中,颞叶内侧、顶叶、尾状核也有改变。本研究根据既往研究结果确定海马、杏仁核、内嗅皮质、顶上小叶、丘脑、尾状核为认知功能关键脑区,并将以上脑区作为本研究的ROI脑区。
本研究是一项横断面研究,探索尚在认知正常阶段的老年人,睡眠时间和关键认知功能脑区体积是否具有相关性,并提出假设:睡眠时间可能与早期MCI的大脑结构病理性改变相关。早期识别大脑表征的改变,在症状出现之前,调节睡眠时间,可能对减缓MCI的发生发展有重要意义。
1 材料与方法
1.1 研究对象
本研究共纳入118例于2011年5月至2012年5月参与中国纵向老龄化队列研究(CLAS,Cl inical Tr ial s.gov,标识符:NCT03672448)的上海市社区老年人。纳入标准:①年龄≥60岁,性别不限;②受试者为小学及以上文化程度,有能力完成方案规定的认知能力测定和其他测试;③无记忆减退;④不符合痴呆诊断标准;⑤临床痴呆评定量表(Cl inical Dement ia Rr at ing Scal e,CDR)评 估 为0分;⑥简易精神状态检查表(Mini-Ment al St at us Examinat ion,MMSE)总分为26~30分;⑦哈金斯基缺血量表总分≤4分;汉密尔顿抑郁量表/17项版总分≤10分;⑧神经系统检查没有明显体征。
本研究经上海市精神卫生中心伦理委员会批准(伦理批号:2012-19),并获得所有受试者或其法定监护人的书面知情同意。
1.2 研究方法
1.2.1 数据采集
所有的受试者都经过了严格的筛选,包括人口学资料的采集(年龄、性别、受教育年数),病史的采集,体格检查和神经心理学测验以及MRI的数据采集。睡眠时间由受试者自我报告,回忆老年阶段(>60岁)平均每天夜间的睡眠时间。专业的神经心理评估员进行神经心理评估,通过MMSE、蒙特利尔认知评估量表(Mont r eal Cognit ive Assessment,MoCA)评估受试者的认知功能。精神科主治医生进行临床访谈,并评定CDR、老年抑郁量表(Geriatric Depression Scal e,GDS)、焦虑自评量表(Sel f-Rating Anxiety Scal e,SAS),结合病史和体格检查进行诊断,排除焦虑和抑郁障碍。
1.2.2 MRI数据采集与处理
MRI扫描地点:上海交通大学医学院附属精神卫生中心。MRI扫描设备、序列:采用Siemens 3.0 T Verio MR扫描仪及32CH头部线圈,在受试者仰卧位状态下使用三维磁化快速准备回波序列(t hr ee-dimensional magnet izat ion-pr epar ed r apid gr adient-echo,3D MPRAGE)采集3D T1加权图像。参数为TE/TR=3.5/2530 ms,视野256 mm×256 mm,层厚1.3 mm,间距1 mm,层数176,矩阵256×176。
在ubant u 16.0 4系统中,使用Fr eesurf er 6.0 软件(ht tp://sur f er.nmr.mgh.har var d.edu/)对原始3D结构像进行数据格式转换、皮层表面的重建,根据Desikan-Kil l iany模板进行脑区分割,最后计算ROI的体积和估计颅内总体积(est imat ed t ot al int racr anial vol ume,eTIV)。
1.3 统计学方法
已有研究证明,睡眠时间和认知功能呈倒U型关系,睡眠7 h可能为最佳[8]。据此将受试者分为短睡眠组(n=46,睡眠时间<7 h)和长睡眠时间组(n=72,睡眠时间≥7 h)。采用SPSS 22.0 软件进行数据分析。在两组内分别对不同的ROI和睡眠时间进行相关性分析,并校正年龄、性别、受教育年数和eTIV对ROI体积的影响。为了平衡Ⅱ类错误和统计效力,用R软件对多个ROI体积和睡眠时间相关性分析的结果进行了FDR校正。当P<0.0 5,校正P<0.1 时,统计结果具有显著性。
2 结果
睡眠时间<7 h组的年龄为(69.2 6±6.6 4)岁,男23例,受教育年限为(9.4 0±3.3 8)年,MMSE分值为27.8 0±1.8 3,MoCA分值24.4 2±4.1 1;睡眠时间≥7 h组的年龄为(68.1 9±6.6 3)岁,男45例,受教育年限为(10.3 6±3.5 2)年,MMSE分值为28.2 6±1.7 3,MoCA分值25.3 2±3.4 8。分别在短睡眠时间组和长时间睡眠时间组对睡眠时间和eTIV进行相关性分析,校正了年龄、性别和受教育年数的影响;另对睡眠时间和左右两侧海马、杏仁核、内嗅、顶上小叶、丘脑、尾状核进行相关性分析,校正了年龄、性别、受教育年数和eTIV因素的影响。结果显示,睡眠时间和eTIV在短睡眠时间组(1 434 203.5 2±143 443.5 5,P=0.2 89)和长睡眠时间组(1 472 578.7 6±133 729.6 9,P=0.5 36)均不具有显著相关性。在短睡眠时间组,睡眠时 间 和 左 侧 丘 脑(r=0.4 45,P=0.0 30)、尾 状 核(r=0.3 71,P=0.0 48)以及右侧海马(r=0.3 34,P=0.0 76)、杏仁核(r=0.4 45,P=0.0 30)、丘脑(r=0.3 71,P=0.0 48)、尾状核(r=0.4 14,P=0.0 36)体积呈显著正相关(图1);睡眠时间和其余的ROI体积不具有显著相关性。在长睡眠时间组,睡眠时间和ROI体积不具有显著相关性(表1)。
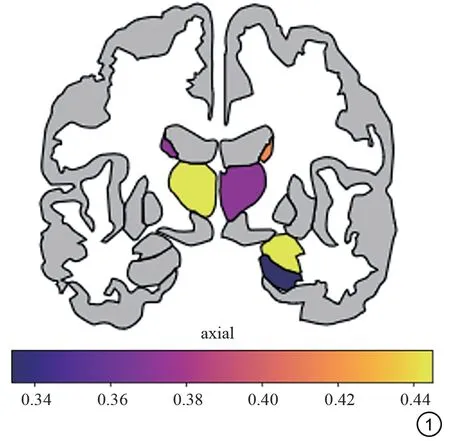
图1 与睡眠时间显著相关的ROI示例图Fig.1 ROIs related to sleep duration.
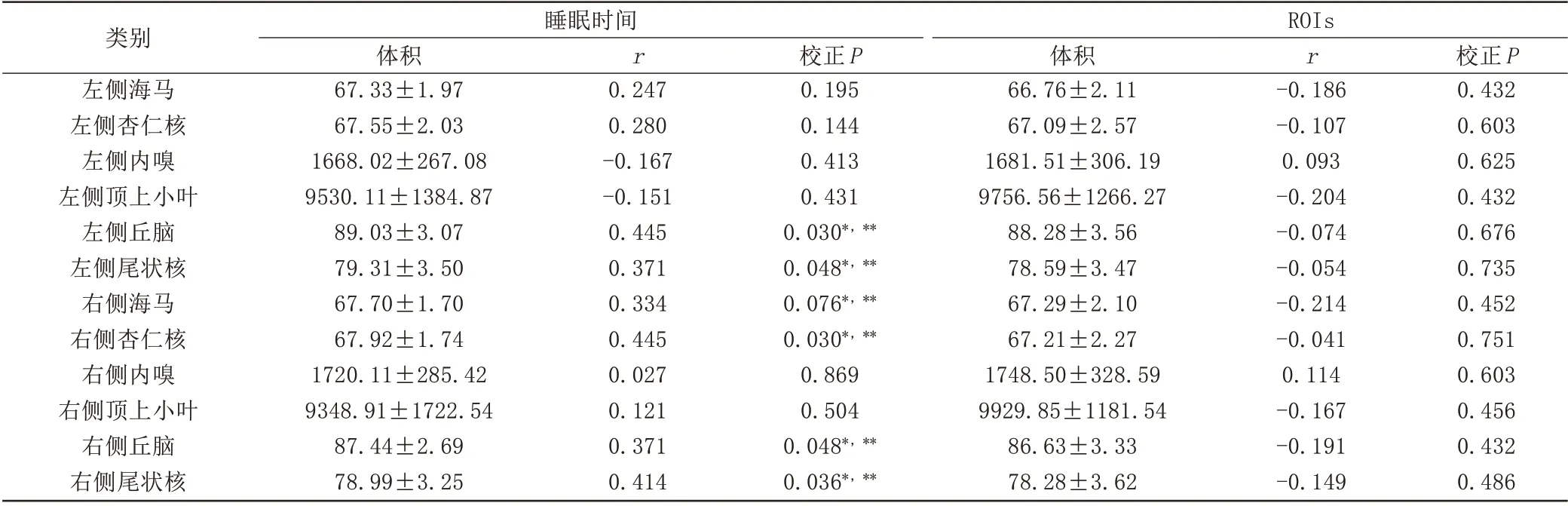
表1 睡眠时间和ROIs的相关性分析Tab.1 Correlation analysis of sleep duration and ROIs
3 讨论
本研究发现,在认知功能正常老年人睡眠时间≥7 h组,睡眠时间和关键认知功能脑区不具有显著相关性。在睡眠时间<7 h组,睡眠时间和大多数关键认知功能脑区皆呈显著正相关,包括右侧海马、右侧杏仁核、双侧丘脑及双侧尾状核,既往有研究[15]发现睡眠障碍的患者具有与aMCI患者大脑类似的萎缩模式,与本研究结果一致。
3.1 海马、杏仁核、丘脑及尾状核与睡眠、认知的关系
海马结构是情绪、记忆、认知等基本脑功能的中枢区域。海马结构的萎缩是AD的生物学标志物,也是MCI特征性的病理性改变[16]。本研究发现在短睡眠时间的老年人群中,睡眠时间和右侧海马体积呈显著正相关。既往也有研究显示失眠患者的双侧海马体积相比于拥有良好睡眠的人群而言明显减少[17-18],与本研究结果一致。睡眠对海马依赖性记忆的巩固起到支持作用,另有新研究发现非海马依赖性记忆也与睡眠期间海马依赖性机制的激活有关[19]。这可能是睡眠影响MCI患病率进而发展成AD的机制之一。虽然也有研究发现青年失眠患者的脑功能和脑形态在宏观上和良好睡眠的人群并没有差异[20],但这可能与失眠患者的睡眠时间缺乏程度不同、涉及到的人群年龄阶段不同有关。此外,本研究显示相关性仅出现在右侧海马,可能与左右两侧功能差异有关[21],在AD病理过程中,海马萎缩具有不对称性,结合本研究结果说明右侧海马对睡眠时间更为敏感,可能在AD病理过程中更早发生变化。
杏仁核由多个核团组成,与记忆、情绪、认知和学习等重要功能有关,是MCI和AD病理发展过程中的重要脑区[22]。本研究发现在短睡眠的老年人群中,睡眠时间和右侧杏仁核体积呈正相关。有研究发现,失眠患者的杏仁核萎缩呈局部性,右侧杏仁核的偏心性和失眠的严重程度呈正相关[23],与本研究结果一致。杏仁核可以调节非快动眼睡眠,并且其中央核与脑干中的快动眼睡眠调节区域密切相关,在快动眼睡眠的调节中也起到关键作用[24]。在失眠患者中,可出现杏仁核的活动异常[25],抑制海马皮层结构中c AMP级联激活,进而抑制记忆的形成[26]。这可能是睡眠时间不足影响认知功能的机制之一。另有研究发现[27],主观认知下降的中国社区老年人杏仁核萎缩存在不对称性,右侧萎缩较为显著。结合本研究的发现,暗示了右侧杏仁核体积可能和AD的病理学进展关系更为密切。
丘脑与觉醒维持密切相关,多个丘脑核团和相关环路均参与了觉醒调控。丘脑能整合觉醒睡眠相关信息,通过不同的脑区和功能特异性的方式调节觉醒睡眠行为的不同方面,比如觉醒量,诱发睡眠向觉醒转换,调控与睡眠相关的节律震荡活动、睡眠稳态活动、调控睡眠期间感觉信息的传导,产生促眠信号等[28-29]。本研究发现双侧的丘脑体积在短睡眠时间组中,与睡眠时间呈显著性正相关。既往研究[30]发现,在失眠患者中出现丘脑体积的减小和功能的改变,与本研究一致。而在AD患者中可以观察到下丘脑视交叉上核的改变以及昼夜节律时间钟的表达被破坏,临床前期AD受试者的静息活动节律破坏也与丘脑有关[31]。目前,是丘脑的变化引起了睡眠时间的变化,进而影响了AD的神经病理发展,或是AD的早期的睡眠问题引起了丘脑改变,亦或是双向相互作用,仍有待于进一步阐明。
尾状核作为基底神经节纹状体的一部分,涉及到许多功能的皮质下结构,包括学习和记忆、奖励加工、感觉加工、动机和皮质兴奋性的调节[32]。在本研究中,双侧的尾状核体积在短睡眠时间组中,与睡眠时间呈显著性正相关。有动物研究表明,尾状核可以调节睡眠,该区域的病变显著影响快动眼睡眠[33]。有荟萃分析显示,睡眠不足会影响情景记忆、工作记忆、问题解决等认知领域[34],而尾状核是支持上述认知领域神经元网络的重要节点[35]。在AD的临床前期和临床阶段,尾状核和基底神经节的其他部分均出现萎缩[36],也有少数研究报告了AD患者的尾状核体积增加,这可能是由于海马和尾状核参与不同类型的学习记忆,在AD进展过程中,海马逐渐萎缩,尾状核受到更多的刺激,导致海马体积和尾状核体积之间呈负相关[37]。总体而言,尾状核的体积变化在睡眠问题和认知领域的发展变化是相一致的,而三者之间的互相作用以及作用大小需要进行下一步研究。
3.2 本研究的局限性
本研究通过相关性分析发现了在认知功能正常的短睡眠老年人中,睡眠时间和关键认知功能脑区,海马、杏仁核、丘脑及尾状核体积呈显著正相关,讨论了可能存在的机制,但作为一项横断面研究,无法得出因果关系,后续的结论仍有待于进一步研究。本研究存在其他局限性,比如样本量过少;收集的是主观睡眠时间,可能存在误差影响结果。作为探索性分析,本研究参考以往文献采用了0.1 作为FDR的阈值,这可能增加结果中Ⅱ型错误的风险,但在实验设计时尽可能选择了具有针对性的ROI来减轻该风险。
综上,睡眠问题作为AD神经病理学的新型机制,新的干预重点值得更多人的关注。在认知正常的短睡眠时间老年人中,睡眠时间和多个认知功能脑区的体积呈正相关。本研究结果提示,调整老年人的睡眠时间,解决睡眠问题,提高睡眠质量,可能有助于减少相关脑区神经退行性改变。
作者利益冲突声明:全体作者均声明无利益冲突。

