番茄匍柄霉SlCmr1基因克隆及其敲除载体的构建
黄萍 刘洪 王慧 周倩


摘要:【目的】克隆番茄匍柄霉(Stemphylium lycopersici)SlCmr1基因,并構建SlCmr1基因敲除载体,为研究该基因功能打下基础。【方法】根据NCBI数据库提供的番茄匍柄霉基因组信息设计引物,PCR扩增得到SlCmr1基因的DNA全长和CDS序列,并对SlCmr1基因编码的蛋白进行生物信息学分析。利用SlCmr1基因上、下游1100 bp左右的序列设计引物,分别PCR扩增SlCmr1基因的上、下游片段,通过酶切连接的方法将SlCmr1基因的上、下游序列分别插入载体pCX62,构建SlCmr1基因敲除载体。【结果】SlCmr1基因的DNA全长为3275 bp,CDS长度为3018 bp,有3个内含子,编码蛋白序列全长1005 aa,分子式为C4882H7642N1404O1499S61,分子量为111.94 kD,理论等电点为(pI)6.64,半衰期30 h,不稳定指数58.72,亲/疏水性平均值为-0.424,预测亚细胞定位于细胞核,存在2个相邻的ZnF_C2H2结构域和1个GAL4结构域,推测SlCMR1为不含跨膜区域的非分泌、不稳定可溶性蛋白。分别将SlCmr1基因上、下游序列插入pCX62载体,成功构建了基因敲除载体pCX62-SlCmr1。【结论】SlCmr1可能是真菌调控色素合成的关键基因,在真菌的次级代谢产物合成中发挥重要作用。
关键词: 番茄匍柄霉;SlCmr1基因;基因克隆;生物信息学分析;基因敲除载体构建
中图分类号: S432.44 文献标志码: A 文章编号:2095-1191(2021)04-0976-08
Cloning and knockout vector construction of SlCmr1 gene in Stemphylium lycopersici
HUANG Ping, LIU Hong, WANG Hui, ZHOU Qian*
(College of Plant Protection,Hunan Agricultural University/Hunan Provincial Key Laboratory for Biology
and Control of Plant Diseases and Insects Pests, Changsha 410128, China)
Abstract:【Objective】In order to study the function of SlCmr1 gene in Stemphylium lycopersici, cloning of SlCmr1 gene was carried out, and gene knockout vector was constructed. 【Method】The primers of SlCmr1 gene were designed according to the S.lycopersici genome sequence provided by NCBI database. The full length DNA and CDS sequence of SlCmr1 gene were obtained by PCR amplification and the protein coded by SlCmr1 gene was analyzed through bioin formatics methods. Sequences around 1100 bp upstream and downstream of SlCmr1 gene were used to design primers. The upstream and downstream sequences of SlCmr1 were amplified by PCR and inserted into pCX62 vector by restriction enzyme digestion and SlCmr1 gene knockout vector was constructed. 【Result】SlCmr1 gene was 3275 bp in DNA sequence and 3018 bp in CDS sequence, including 3 introns, encoded 1005 amino acid protein sequence with molecular formula C4882H7642N1404O1499S61 and molecular weight 111.94 kD, predicted isoelectric point(pI) 6.64, half-life 30 h, instability index 58.72, mean value of hydrophilicity/hydrophobicity -0.424 and subcellular localization in nucleus. It was speculated that SlCMR1 was a non-secretory, unstable soluble protein without transmembrane region, and there were 2 adjacent ZnF_C2H2 domains and 1 GAL4 domain. SlCmr1 gene knockout vector pCX62-SlCmr1 was successfully constructed by inserting the upstream and downstream fragments of SlCmr1 gene into pCX62 vector. 【Conclusion】Slcmr1 may be a key gene regulating pigment synthesis and play an important role in the secondary metabolite synthesis in fungi.
Key words: Stemphylium lycopersici; SlCmr1 gene; gene cloning; bioinformatics analysis; construction of gene knockout vector
Foundation item: Hunan Natural Science Foundation(2018JJ3220); Scientific Research Project of Hunan Education Department(19K040)
0 引言
【研究意义】匍柄霉属(Stemphylium Wallroth)是无性真菌暗色丝孢科的重要类群,其中许多成员是植物上常见的弱寄生致病菌,可产生毒素杀死寄主细胞后从死亡的组织中获取营养。番茄匍柄霉(S. lycopersici)是其中致病力较强、危害较大、寄主范围较广的成员之一,常为害番茄、莴苣、辣椒和甘蓝等蔬菜,引起叶斑病。在我国由番茄匍柄霉引起的发生面积和危害程度最大的病害是番茄匍柄霉叶斑病,又称番茄灰叶斑病,该病在环境湿度大、气温不稳定的阴天发生快速,扩散能力强,现已在我国许多地方大面积暴发,严重影响番茄的产量和品质,造成巨大经济损失(李宝聚等,2010)。Cmr1基因普遍存在于真菌中,编码包含2个相邻的ZnF_C2H2结构域和1个Zn(II)2Cys6结构域的转录因子(Tsuji et al.,2000)。本课题组前期研究发现,引起莴苣叶斑病的番茄匍柄霉菌株致病力强弱与其橙色色素的产量呈正相关,转录组测序结果显示产色素少的菌株中Cmr1的同源基因表达量下调,这一发现与前人研究结果矛盾(Eliahu et al.,2007;Cho et al.,2012)。因此,开展对番茄匍柄霉SlCmr1基因克隆、生物信息学分析及基因敲除载体构建的研究,可为后续进一步探讨该基因编码的蛋白在真菌色素合成调控中的作用打下基础。【前人研究进展】有关Cmr1及其同源基因的研究最早在黄瓜炭疽菌(Colletotrichum lagenarium)和稻瘟病菌(Magnaporthe grisea)中报道,发现它们编码的蛋白是与真菌菌丝中黑色素合成相关的转录因子(Tsuji et al.,2000)。水稻胡麻病菌(Bipolaris oryzae)中Cmr1的同源基因Bmr1過表达导致黑色素的合成增加(Kihara et al.,2008)。链格孢(A.alternata)中Cmr1的同源基因CmrA沉默后黑色素合成抑制,导致菌落呈白色(Fetzner et al.,2014)。大丽轮枝菌(Verticillium dahliae)中VdCmr1基因也是调控黑色素合成的关键因子(Wang et al.,2018)。灰霉(Botrytis cinerea)和盾壳霉(Coniothyrium minitans)中Cmr1的同源基因均与黑色素合成相关(Schumacher,2016;Luo et al.,2018)。Eliahu等(2007)在研究玉米小斑病菌(Cochliobolus heterostrophus)时发现Cmr1基因缺失的突变体菌落不产生黑色素,但会产生橙粉色素。随后在芸薹生链格孢(Alternaria brassicicola)中报道,Cmr1同源基因Amr1缺失也在导致菌落黑色素合成抑制的同时橙色色素合成增加,并且Amr1缺失突变体对寄主的致病力显著增强(Cho et al.,2012)。目前,关于Cmr1及其同源基因功能的报道均是正调控黑色素的形成,在玉米小斑病菌(Eliahu et al.,2007)和芸薹生链格孢(Cho et al.,2012)的研究中还发现它们同时负调控橙色色素的合成,且芸薹生链格孢的Amr1基因还控制病菌的致病力。【本研究切入点】番茄匍柄霉在我国引起多种蔬菜叶斑病,严重影响我国蔬菜的质量和产量,但目前有关番茄匍柄霉色素合成及致病力相关基因的研究鲜见报道。【拟解决的关键问题】从橙色色素产量高、致病力强的番茄匍柄霉菌株CS12中克隆SlCmr1基因及其CDS序列,对其编码的蛋白进行生物信息学分析,并构建SlCmr1基因敲除载体,为下一步在番茄匍柄霉中敲除该基因,明确番茄匍柄霉中该基因的功能打下基础。
1 材料与方法
1. 1 试验材料
供试番茄匍柄霉菌株CS12由植物病虫害生物学与防控湖南省重点实验室分离培养并保存。pCX62载体为南京农业大学张正光教授惠赠。总RNA提取试剂盒、cDNA反转录试剂盒、Pfu酶、DNA纯化回收试剂盒、质粒提取试剂盒、大肠杆菌DH5α感受态细胞购自生工生物工程(上海)股份有限公司;限制性内切酶Hind III、Kpn I、BamH I和Xba I购自TaKaRa公司,T4连接酶购自Promega公司,其余试剂均为国产分析纯。
1. 2 试验方法
1. 2. 1 番茄匍柄霉DNA、总RNA提取及cDNA合成 将液体培养的菌株CS12用CTAB法(李焕宇等,2017)提取DNA,根据总RNA提取试剂盒说明书提取菌株CS12的总RNA,利用反转录试剂盒获得菌株CS12的cDNA。DNA和总RNA分别用1%琼脂糖凝胶电泳检测质量。
1. 2. 2 SlCmr1基因全长及CDS序列克隆 根据转录组测序数据和NCBI中番茄匍柄霉SlCmr1基因序列,用Primer 5.0设计引物,送生工生物工程(上海)股份有限公司合成(表1)。PCR反应体系50.0 μL:10×PCR Buffer 5.0 μL,2.5 mmol/L dNTP 4.0 μL,上、下游引物各2.0 μL,DNA或cDNA模板2.0 μL,Pfu酶1.0 μL,ddH2O补足至50.0 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min,进行34个循环;72 ℃延伸5 min。DNA和cDNA的PCR产物分别用1%琼脂糖凝胶电泳检测并委托生工生物工程(上海)股份有限公司进行测序。
1. 2. 3 SlCMR1蛋白的生物信息学分析 利用ProtParam、SOSUI、TMHMM Serverv.2.0、NetPhos 3.1和SignalP 5.0等在线工具对SlCMR1蛋白进行生物信息学分析。将SlCMR1在NCBI数据库BLAST中进行同源性比对,得到不同物种SlCmr1基因的氨基酸序列,在GeneDoc中进行多重序列比对,使用MEME分析3个相似度最高的Motif。使用MEGA 7.0对BLAST的结果进行氨基酸序列多重比对,采用邻接法构建系统发育进化树。
1. 2. 4 SlCmr1基因敲除载体的构建 根据番茄匍柄霉SlCmr1基因的上、下游1000 bp左右的序列,各设计1对加入酶切位点的引物(表1)。构建基因敲除载体的方法为在pCX62载体潮霉素基因的两端分别插入SlCmr1基因的上、下游片段(图1)。具体过程与方法:对SlCmr1基因的上、下游分别进行PCR扩增(PCR反应体系50.0 μL:10×PCR Buffer 5.0 μL,2.5 mmol/L dNTP 4.0 μL,上、下游引物各2.0 μL,DNA模板2.0 μL,Pfu酶1.0 μL,ddH2O补足至50.0 μL。扩增程序:94 ℃预变性5 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min,进行34个循环;72 ℃延伸5 min),PCR产物用1%琼脂糖凝胶电泳检测并委托生工生物工程(上海)股份有限公司测序。测序结果正确的上、下游PCR产物(SlCmr1SY和SlCmr1XY)分别纯化回收,紫外分光光度计测量浓度、检测质量。提取pCX62质粒,分别将质粒和下游PCR纯化产物进行双酶切(BamH I和Xba I)处理,酶切体系10.0 μL:10×M Buffer 5.0 μL,限制性内切酶各2.0 μL,DNA 2.0 μL(约400 ng/μL),ddH2O补足至10.0 μL。反应条件:37 ℃ 4 h。将酶切产物分别用1%琼脂糖凝胶电泳检测,用试剂盒进行纯化回收。T4连接酶连接回收的载体和下游酶切产物,连接体系20.0 μL:T4 Buffer 2.0 μL,T4酶1.0 μL,载体质粒酶切纯化产物1.0 μL(约100 ng/μL),下游酶切纯化产物5.0 μL(约160 ng/μL)。反应程序:22 ℃ 20 min,65 ℃ 10 min。连接产物转化DH5α感受态细胞,挑取单菌落进行PCR验证,将阳性克隆送至生工生物工程(上海)股份有限公司进行测序验证。测序正确的载体质粒(pCX62-SlCmr1XY)与上游PCR产物(SlCmr1SY)分别进行双酶切(Kpn I和Hind III)、連接转化处理,体系与反应程序同上,选择测序正确的敲除载体pCX62-SlCmr1。
2 结果与分析
2. 1 SlCmr1基因克隆结果
分别以番茄匍柄霉菌株CS12的DNA和cDNA为模板进行PCR扩增,PCR产物测序,得到SlCmr1基因的DNA全长为3275 bp,CDS长度为3018 bp(图2);在NCBI数据库BLASTn中将DNA序列与CDS序列进行比对,结果显示其存在3个内含子。
2. 2 SlCMR1蛋白理化性质预测分析结果
由ProtParam可知SlCmr1基因编码蛋白序列全长1005 aa,理论等电点(pI)为6.64,分子式为C4882H7642 N1404O1499S61,分子量为111.94 kD,原子总数为15488,其带有负电荷残基总数(Asp+Glu)97个,带正电荷残基总数(Arg+Lys)92个。在理论数据的基础上得出半衰期为30 h,不稳定指数58.72,亲/疏水性平均值为-0.424(图3),故推测其为不稳定的可溶性蛋白。
2. 3 SlCMR1蛋白保守结构域分析结果
利用SMART在线预测网站分析SlCMR1蛋白的保守结构域,可得到其存在2个相邻的ZnF_C2H2结构域(Cys2His2 zinc finger:2~24 aa和30~52 aa)和1个GAL4结构域[Zn(II)2Cys6:73~116 aa](图4-A)。在SOPMA中预测SlCMR1蛋白的二级结构,结果显示α-螺旋占34.93%,无规则卷曲占52.74%,延伸链占9.85%,β-折叠占2.49%(图4-B)。在PSIPRED V4.0在线预测网站,使用SWISS-MODEL在线同源建模,对SlCMR1蛋白的三级结构进行预测,结果证实其主要由α-螺旋和无规则卷曲组成(图4-C),二者预测的结果一致。
2. 4 SlCMR1蛋白跨膜结构分析结果
用SignalP 5.0在线网站分析S1CMR1蛋白,结果表明其可能含有信号肽的概率为0.11%,因此推测S1CMR1为非分泌蛋白;于TMHMM Server v.2.0在线预测网站中分析SlCMR1蛋白,发现其不含跨膜结构;WoLF PSORT在线预测,推测其定位在细胞核中。使用NetPhos 3.1在线预测分析,结果(图5)显示SlCMR1中共有130个分值在0.5以上可能发生磷酸化的氨基酸位点,其中丝氨酸磷酸化位点89个、苏氨酸磷酸化位点35个、酪氨酸磷酸化位点6个。
2. 5 SlCMR1蛋白系统发育进化分析结果
SlCmr1基因编码的蛋白序列在NCBI数据库中进行BLASTp同源性搜索比对,得到不同物种的CMR1蛋白序列。将SlCMR1蛋白序列与番茄匍柄霉(Stemphylium lycopersici,KNG52672.1)、小麦根腐离孺孢(Bipolaris sorokiniana,KAF5844733.1)、稻平脐蠕孢(Bipolaris oryzae,XP 007683728.1)、玉米大斑病菌(Setosphaeria turcica,XP 008022458.1)、芸薹生链格孢(Alternaria brassicicola,AEN02471.1)、圆核腔菌(Pyrenophora teres,CAA9962123.1)、偃麦草核腔菌(Pyrenophora tritici-repentis,XP 0019336 51.1)、枝孢菌(Clathrospora,KAF1946502.1)、小檗葫芦霉(Cucurbitaria berberidis,KAF1843946.1)、棘壳孢叶斑病菌(Pyrenochaeta sp.,OAL46131.1)、壳多孢属(Stagonospora sp.,OAK99817.1)和多主棒孢霉(Corynespora cassiicola,PSN62609.1)中的同源序列在MEGA 7.0中进行多重序列比对,比对结果采用邻接法构建系统发育进化树(图6)。同源性比对结果显示,SlCMR1蛋白序列与数据库中收录的番茄匍柄霉CMR1蛋白序列仅相差1个氨基酸,推测为不同菌株间的差异。
使用GeneDoc将相似性最高的几个物种的CMR1与SlCMR1蛋白进行多重序列比对,并将两相邻的ZnF_C2H2结构域和GAL4结构域标出(图7),于MEME在线预测网站中将SlCMR1蛋白与其相似性最高的几个蛋白序列进行搜索,找到3个相似性最高的片段,并对其进行标注(图8)。由图8可见,SlCMR1蛋白与不同物种的CMR1蛋白间同源性较高的Motif区域分别为a(3~52 aa)、b(57~106 aa)和c(818~867 aa)等3处,其中,a中包括2个相邻的ZnF_C2H2结构域,b中含有GAL4结构域,与保守结构域预测分析及多重序列比对结果一致。
2. 6 SlCmr1基因敲除载体构建
用菌株CS12的DNA为模板,使用上游引物Cmr1SY-F、Cmr1SY-R和下游引物Cmr1XY-F、Cmr1XY-R分别扩增出SlCmr1基因的上、下游片段,并用1%琼脂糖凝胶电泳进行检测(图9)。上、下游片段大小均与预期一致。将载体质粒与下游片段进行酶切、连接及转化,挑取单菌落进行PCR检测,将阳性克隆送至生工生物工程(上海)股份有限公司测序,得到测序正确的含有下游片段的重组载体pCX62-SlCmr1XY。再将上游片段与重组载体pCX62-Sl-Cmr1XY进行上述操作,得到测序正确的重组敲除载体pCX62-SlCmr1。
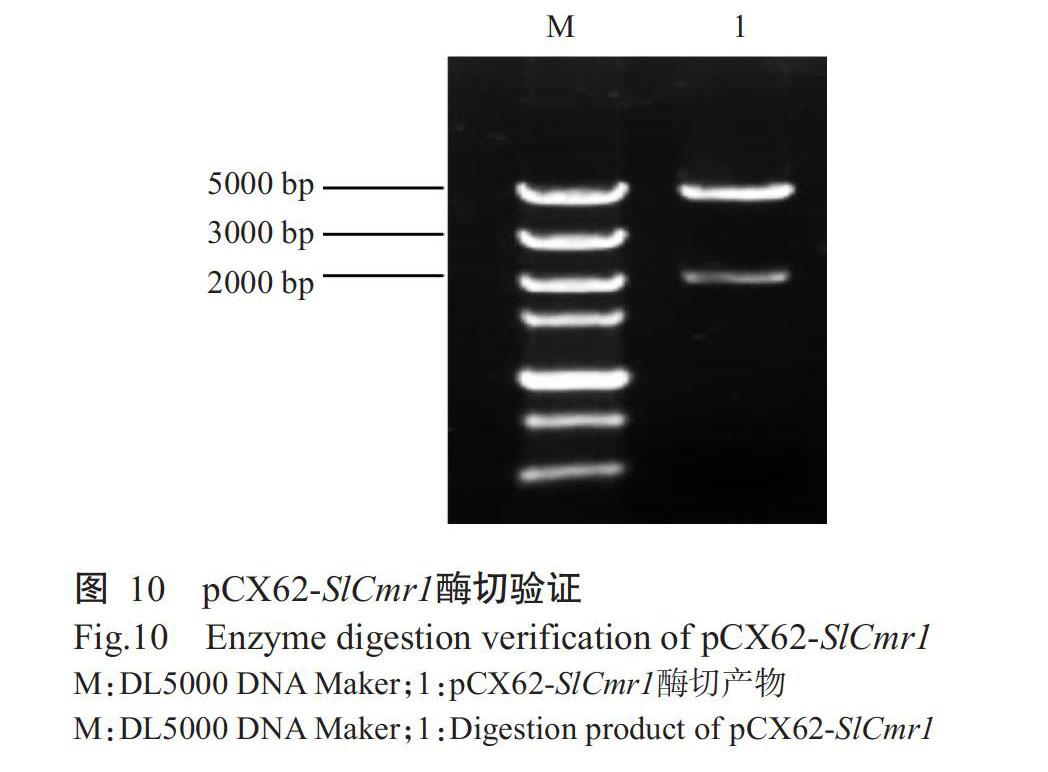
由于pCX62和上游片段中各有1个BamHⅠ酶切位点,因此将敲除载体pCX62-SlCmr1进行BamHⅠ单酶切验证(图10),得到2条明亮的条带,一条大小约为5000 bp,与pCX62载体、部分上游片段和下游片段相加的大小(4493 bp)相符,另一条带的大小约为2000 bp,与部分上游片段和潮霉素B相加的大小(1971 bp)相符。单酶切验证结果与重组载体测序结果一致,说明成功构建了敲除载体pCX62-SlCmr1,后续可使用该载体进行真菌遗传转化,进一步探究该基因的功能。
3 讨论
Cmr1广泛存在于真菌中,是一类重要的转录因子,但目前关于该转录因子功能的研究报道有限。有研究证明该转录因子及同源物正调控真菌中的黑色素合成,Cmr1基因敲除后,黑色素的合成被阻断(Schumacher,2016;Luo et al.,2018),另有研究表明Cmr1基因敲除后不仅抑制黑色素合成,还增加了橙色色素合成(Eliahu et al.,2007;Cho et al.,2012)。郑露(2010)发现引起大蒜白斑病的茄匍柄霉(S. solani)的致病力与其合成的橙色色素有关,该色素是一种非寄主专化性毒素。本课题组前期研究发现番茄匍柄霉的致病力也与病菌产生橙色色素的能力呈正相关,说明橙色色素可能是与匍柄霉致病有关的毒素。为了解番茄匍柄霉橙色色素合成的机制,本课题组前期对色素产生能力不同的番茄匍柄霉菌株进行了转录组测序,发现SlCmr1基因在致病力弱的菌株中表达量低,这一结果与链格孢中Cmr1同源基因Amr1敲除后橙色色素增加,致病力增强(Eliahu et al.,2007;Cho et al.,2012)的报道矛盾。SlCmr1基因的功能如何,是否与橙色色素合成及致病力有关,尚缺乏深入了解。本研究从高产橙色色素的番茄匍柄霉菌株CS12中克隆得到SlCmr1的DNA序列及CDS序列,通过生物信息學分析发现,SlCmr1基因编码蛋白序列全长1005 aa,与NCBI数据库中番茄匍柄霉的CMR1蛋白序列仅相差1个氨基酸,推测为不同菌株造成的差异。该蛋白包含2个相邻的ZnF_C2H2结构域和1个GAL4结构域,是典型的转录因子。ZnF_C2H2的DNA结合基序最初在转录因子TFIIIA中发现并报道,与5S RNA基因的内部控制区结合,调控转录(Miller et al.,1985)。GAL4含有Zn(II)2Cys6双核簇DNA结合基序,是真菌转录因子所特有的结构域(Todd and Andrianopoulos,1997)。Zn(II)2Cys6双核簇基序的缺失能使黑色素完全丢失,而ZnF_C2H2的缺失仅会导致黑色素合成减少(Tsuji et al.,2000)。在敲除了Cmr1基因的玉米小斑病菌中调控黑色素合成相关基因BRN1、BRN2和SCD1的表达被完全抑制,而聚酮合成酶基因PKS18的表达量仅表现降低,同时发现Cmr1基因的正、负链均能转录,并受2个MAPK基因Chk1和Mps1的调控(Eliahu et al.,2007)。在产黑色素短梗霉(Aureobasidium melanogenum)XJ5?1菌株中,Cmr1与PKS1基因启动子的TTCTCCA序列特异性结合,激活PKS1基因及黑色素合成相关基因T4HR1和SCD1的表达(Jiang et al.,2020)。说明在不同的真菌中,黑色素的合成可能由不同的聚酮合成酶(PKS)负责骨架的合成,其不同程度受Cmr1基因的调控。番茄匍柄霉产生橙色色素少的菌株中SlCmr1基因的表达量低,但其原因尚未明确。因此,本研究构建了SlCmr1基因的敲除载体,为后续对番茄匍柄霉菌株进行基因敲除以分析SlCmr1的功能打下了基础。
4 结论
SlCmr1可能是真菌调控色素合成的关键基因,在真菌的次级代谢产物合成中发挥重要作用。本研究成功构建了敲除载体pCX62-SlCmr1,为后续进一步探讨该基因在色素合成中的作用打下了基础。
参考文献:
李宝聚,周艳芳,李金萍,谢学文. 2010. 李宝聚博士诊病手记(三十)番茄匍柄霉叶斑病(灰叶斑病)的诊断与防治[J]. 中国蔬菜,(23):24-26. [Li B J,Zhou Y F,Li J P,Xie X W. 2010. Doctor Li Baojus diagnosis notes(30) Diagnosis and control of leaf spot of tomato caused by Stemphylium spp.(grey leaf spot)[J]. China Vegetables,(23):24-26.]
李煥宇,付婷婷,张云,吕天佑,李远,徐秉良. 2017. 5种方法提取真菌基因组DNA作为PCR模板效果的比较[J]. 中国农学通报,33(16):28-35. [Li H Y,Fu T T,Zhang Y,Lü T Y,Li Y,Xu B L. 2017. Effect comparison of five methods to extract fungal genomic DNA as PCR templates[J]. Chinese Agricultural Science Bulletin,33(16):28-35.]
郑露. 2010. 大蒜白斑病病原学、防治技术及其毒素致病机理研究[D]. 武汉:华中农业大学. [Zheng L. 2010. Etiology,control and phytotoxin activity of garlic leaf blight caused by Stemphylium solani[D]. Wuhan:Huazhong Agricultural University.]
Cho Y,Srivastava A,Ohm R A,Lawrence C B,Wang K O,Grigoriev I V,Marahatta S P. 2012. Transcription factor Amr1 induces melanin biosynthesis and suppresses virulence in Alternaria brassicicola[J]. PLoS Pathogens,8(10):e1002974(1-17). doi:10.1371/journal.ppat.1002974.
Eliahu N,Igbaria A,Rose M S,Horwitz B A,Lev S. 2007. Melanin biosynthesis in the maize pathogen Cochliobolus heterostrophus Depends on two mitogen-activated protein kinases,Chk1 and Mps1,and the transcription factor Cmr1[J]. Eukaryotic Cell,6(3):421-429. doi:10.1128/EC. 00264-06.
Fetzner R,Seither K,Wenderoth M,Herr A,Fischer R. 2014. Alternaria alternata transcription factor CmrA controls melanization and spore development[J]. Microbiology,160:1845-1854. doi:10.1099/mic.0.079046-0.
Jiang H,Chi Z,Liu G L,Hu Z,Zhao S Z,Chi Z M. 2020. Melanin biosynthesis in the desert-derived Aureobasidium melanogenum XJ5-1 is controlled mainly by the CWI signal pathway via a transcriptional activator Cmr1[J]. Current Genetics:Microorganisms and Organelles,66(1):173-185. doi:10.1007/s00294-019-01010-9.
Kihara J,Moriwaki A,Tanaka N,Tanaka C,Ueno M,Arase S. 2008. Characterization of the BMR1 gene encoding a transcription factor for melanin biosynthesis genes in the phytopathogenic fungus Bipolaris oryzae[J]. Fems Microbiology Letters,281(2):221-227. doi:10.1111/j.1574-6968. 2008.01101.x.
Luo C W,Zhao H Z,Yang X X,Qiang C C,Cheng J S,Xie J T,Chen T,Jiang D H,Fu Y P. 2018. Functional analysis of the melanin-associated gene CmMR1 in Coniothyrium minitans[J]. Frontiers in Microbiology,9:2658. doi:10. 3389/fmicb.2018.02658.
Miller J,McLachlan A D,Klug A. 1985. Repetitive zinc-binding domains in the protein transcription factor IIIA from Xeno-pus oocytes[J]. EMBO Journal,4(6):1609-1614. doi:10. 1002/j.1460-2075.1985.tb03825.x.
Schumacher J. 2016. DHN melanin biosynthesis in the plant pathogenic fungus Botrytis cinerea is based on two develop-mentally regulated key enzyme(PKS)-encoding genes[J]. Molecular Microbiology,99(4):729-748. doi:10.1111/ mmi.13262.
Todd R B,Andrianopoulos A. 1997. Evolution of a fungal regulatory gene family:The Zn(II)2Cys6 binuclear cluster DNA binding motif[J]. Fungal Genetics and Biology,21(3):388-405. doi:10.1006/fgbi.1997.0993.
Tsuji G,Kenmochi Y,Takano Y,Sweigard J,Farrall L,Furusawa I,Horino1 O,Kubo1 Y. 2000. Novel fungal transcriptional activators,Cmr1p of Colletotrichum lagenarium and pig1p of Magnaporthe grisea,contain Cys2His2 zinc finger and Zn(II)2Cys6 binuclear cluster DNA-binding motifs and regulate transcription of melanin biosynthesis genes in a developmentally specific manner[J]. Molecular Microbiology,38(5):940-954. doi:10.1046/j.1365-2958.2000.02181.x.
Wang Y L,Hu X P,Fang Y L,Anchieta A,Goldman P H,Hernandez G,Klosterman S J. 2018. Transcription factor VdCmr1 is required for pigment production,protection from UV irradiation,and regulates expression of melanin biosynthetic genes in Verticillium dahliae[J]. Microbio-logy,164(4):685-696. doi:10.1099/mic.0.000633.
(責任编辑 麻小燕)

