一种国产PD-L1诊断试剂盒与进口同类产品的临床一致性比对研究
杭红,任丽娜,施丽君
(上海药明奥测医疗科技有限公司,上海 200125)
宫颈癌(cervical cancer,CC)是非常常见的妇科恶性肿瘤之一,我国CC发病率高居世界第2位,每年新发病例在10万人以上,死亡病例约3万人,极大威胁着女性的健康[1]。人乳头瘤病毒(human papilloma virus, HPV)感染是CC发病的主要原因。目前,CC的治疗方法包括手术治疗、化疗、放疗、靶向治疗以及免疫治疗。传统治疗方式对早期CC的治疗效果较好,5年生存率可达91.5%,但对转移性和复发性CC的疗效十分有限[2]。免疫治疗通过刺激机体免疫系统提高其抗肿瘤免疫效应,已逐步成为CC治疗的新模式。
肿瘤免疫治疗成为当前肿瘤治疗领域的热点,其中以PD-1/PD-L1免疫检查点抑制剂的研究和应用为热点。PD-1是自凋亡的T细胞中发现的一种免疫抑制性受体,其主要配体为PD-L1,两者结合传导免疫抑制信号,导致免疫抑制性肿瘤微环境形成,使肿瘤细胞逃避机体的免疫监视和免疫杀伤[3]。PD-1/PD-L1抑制剂可以阻断两者的结合,阻断负向调控信号,使T细胞恢复活性,从而增强机体的免疫应答[4]。目前已有8款与PD-1/PD-L1相关的抗体药物在国内上市,适应症主要为黑色素瘤、肺癌、淋巴癌等。同时,国际上已有多款PD-1/PD-L1药物的伴随诊断产品上市[5-7],作为相应适应症的用药指导。不同试剂盒所用抗体、检测平台、评价方法以及相应的阳性阈值均不同,导致检测结果存在一定差异[8-11]。相较于国际市场,国内目前仅有3款进口PD-L1检测试剂盒获得国家药品监督管理局批准[12-13]。本研究自主开发了PD-L1(WD160)诊断试剂盒,通过与获批的PD-L1(22C3)试剂盒在CC组织样本中进行免疫组织化学染色比较,探究两种诊断试剂结果的一致性,并检测PD-L1在CC不同阶段的表达情况。
1 材料与方法
1.1 抗PD-L1单克隆抗体的制备抗PD-L1单克隆抗体制备的详细信息参见中国国家发明专利(专利号:CN109627338A;专利公布日:2019年4月16日)。以人PD-L1蛋白片段作为抗原,采用皮下注射方法免疫BALB/c小鼠,免疫2次后取血以梯度稀释ELISA测定血清抗体效价。选取抗体效价最高的小鼠进行细胞融合和筛选,获得单克隆细胞株WD160。通过WD160细胞上清液的制备和纯化,得到抗PD-L1单克隆抗体。在完成PD-L1(WD160)抗体的免疫组化验证后,从杂交瘤细胞中分离总RNA, 反转录成cDNA,根据特异性引物扩增VH、VL、CH和CL抗体片段,分别克隆至标准克隆载体中进行DNA测序。
1.2 临床研究对象收集2019年5月—2020年7月于河南省肿瘤医院、河南省人民医院和中国科学院大学附属肿瘤医院(浙江省肿瘤医院)就诊的有明确病理诊断的1 010例CC患者样本。除纳入临床上经H-E染色病理诊断为CC的石蜡包埋组织样本,以宫颈良性疾病41例及除CC以外肿瘤患者51例的石蜡包埋组织样本(取自同样3家医院)作为对照样本。排除采样量不足,无法溯源或被污染的样本。本研究已获得3家医院医学伦理委员会批准。
1.3 试剂与仪器抗PD-L1抗体试剂(克隆号WD160)和DAB染色液试剂盒,购自苏州药明泽康生物科技有限公司。使用方法参见其产品说明书。操作流程简述:样本于60~65 ℃烤片1~2 h,脱蜡水化后,高压修复3 min,3%过氧化氢处理10 min;抗人PD-L1抗体(一抗)孵育30 min,用二抗试剂盒中免疫显色试剂1孵育10 min,免疫显色试剂2孵育30 min;DAB显色3~5 min,DAB增强剂处理8 min,苏木素衬染后进行脱水、透明、封片。以PD-L1检测试剂盒为对比试剂(PD-L1 IHC 22C3 pharmDx)(购自美国丹科北美有限公司)。在该公司配套的AutoStainer Link 48全自动免疫组化染色仪上染色。
1.4 研究方法本研究共纳入1 102例临床诊断为CC的手术或活检患者、宫颈良性疾病及其他肿瘤(如舌鳞癌、乳腺癌、鼻咽癌等)患者,调取其经诊断后剩余的石蜡包埋组织样本,连续切片,分别用WD160和22C3染色。CC组织中PD-L1染色细胞的阅片标准如下[14]。
1.4.1 判读标准 由具备相应专业技术职务任职资格的两位病理医师分别于显微镜下观察染色切片,判断染色定位,并通过计数阳性染色的细胞数,按照公式联合阳性分数(combined positive score, CPS)=[PD-L1阳性细胞数(肿瘤细胞+免疫细胞)/可计数肿瘤细胞总数]×100进行组织学分析,判读PD-L1的表达情况。染色评估需在低倍、高倍镜下观察进行。样本中的活/可计数肿瘤细胞总数不少于100个。以CPS=1作为阳性判断值,CPS≥1为阳性,CPS<1为阴性。
1.4.2 CC组织PD-L1表达细胞计数时分子纳入/排除标准 细胞计数时,公式中分子的计数范围为PD-L1阳性细胞,包括肿瘤细胞和免疫细胞。其中任何染色强度的浸润性肿瘤细胞和完整或不完整的膜染色肿瘤细胞应纳入计数,未被染色的肿瘤细胞以及只有细胞质染色的肿瘤细胞不纳入计数。癌巢内以及相邻基质内任何强度膜/质染色的单核炎症细胞(mononuclear inflammatory cell, MIC)、淋巴细胞(包括淋巴细胞簇)和巨噬细胞纳入计数,未被染色的MIC、与宫颈上皮内瘤变(cervical intraepithelial neoplasia, CIN)相关的MIC、与包括鳞状上皮或腺黏膜、宫颈息肉和微腺体增生在内的良性细胞相关的MIC、与溃疡有关的MIC以及与肿瘤无关的其他病理过程中的MIC均排除于计数外。
1.4.3 CC组织PD-L1表达细胞计数时分母纳入/排除标准 细胞计数时,公式中分母的计数范围为可计数的肿瘤细胞总数,即所有活的肿瘤细胞均纳入计数,而坏死肿瘤细胞、所有种类的免疫细胞和CINⅠ~Ⅲ、良性细胞(包括鳞状上皮或腺黏膜、宫颈息肉和微腺体增生)、基质细胞(包括成纤维细胞)均予以排除。
1.5 统计学处理用R语言对结果进行统计学分析,绘制2×2矩阵计算两种试剂的符合率,用Kappa检验计算两种试剂的检测一致性。检验水准(α)为0.05。
2 结果
2.1 抗PD-L1抗体(WD160)的性能验证以人PD-L1蛋白片段为抗原免疫小鼠,制备抗PD-L1单克隆抗体(WD160)。通过ELISA鉴定抗体的亚型,结果显示WD160的抗体亚型为IgG1型。同时,抗体亲和力检测结果显示,在多肽摩尔浓度为0.82 μmol/L时,WD160的亲和力常数为6×10-7(mol/L)。用WD160进行免疫组化实验,检测PD-L1在组织中的表达。结果显示,在扁桃体质控组织中,PD-L1在隐窝上皮呈强阳性染色,在生发中心呈弱至中等强度的阳性染色,与相同浓度的参比PD-L1抗体丹科22C3结果一致(图1A)。同时,在肺癌组织中,无论是强度还是定位,WD160与22C3的染色效果都非常一致(图1B)。

注:A. 扁桃体组织的PD-L1染色;B. 肺癌组织的PD-L1染色。
2.2 目标人群临床基本特征的描述筛选临床上确诊为CC的患者为主要研究人群,其临床表现有白带异常、阴道出血、腰痛、下肢疼痛、贫血和发热等。CC的辅助检查方法有HPV检测、组织学检查、阴道镜检查、影像学检查及肿瘤标志物检查等,目前该病确诊的金标准为阴道镜或直视下的宫颈活检病理检查。
研究共纳入1 102例患者,年龄(51.88±11.38) 岁, 手术获取样本883例, 活检样本219例, 其中CC患者1 010例(鳞状细胞癌788例、腺癌153例、鳞腺癌12例及其他类型CC患者57例),宫颈良性疾病患者41例和其他类型肿瘤患者51例(表1)。

表1 研究对象基本病理特征
2.3 PD-L1在CC组织中的表达情况免疫组织化学结果显示,PD-L1染色阳性细胞呈棕黄色,主要表达于CC细胞以及肿瘤间质淋巴细胞。PD-L1在CC肿瘤细胞中染色以膜染色为主,全膜染色或半膜染色均可纳入计数(图2A);肿瘤相关免疫细胞指的是20倍同框下,浸润的肿瘤细胞周围染色阳性的免疫细胞,包括巨噬细胞及淋巴细胞(图2B)。
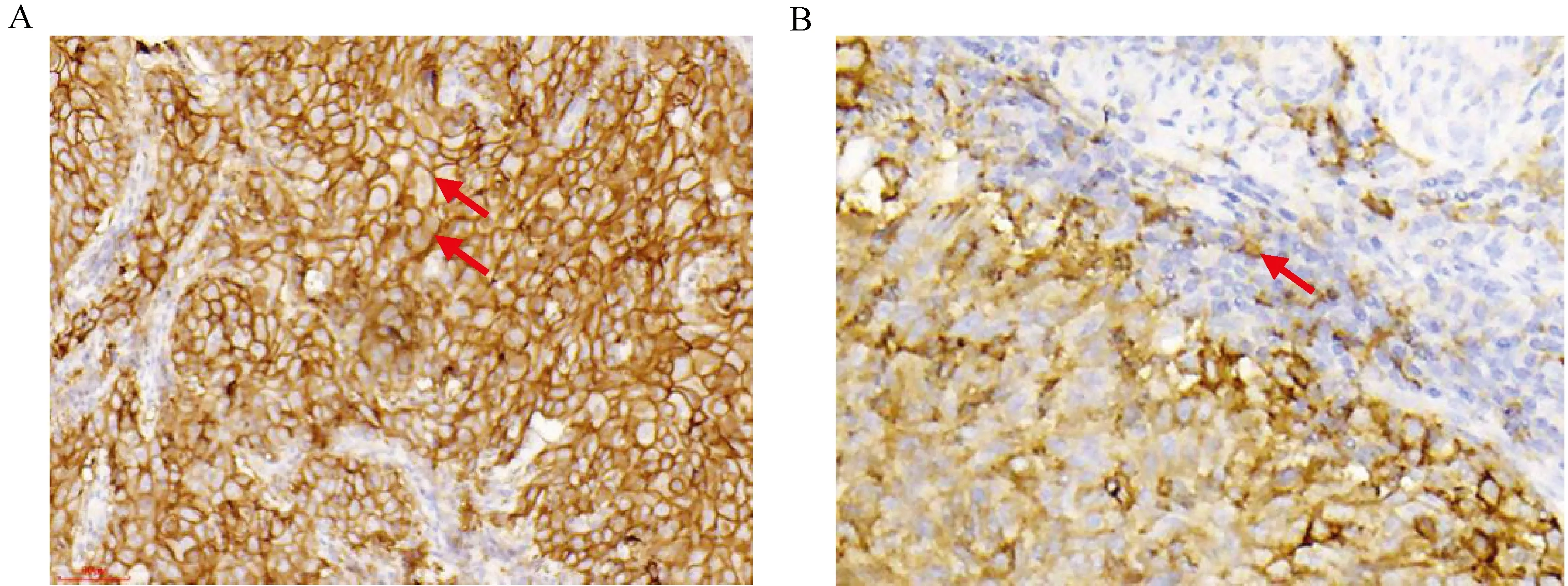
注:A. 肿瘤细胞的PD-L1染色;B. 肿瘤细胞周围免疫细胞的PD-L1染色。
根据CC中PD-L1的阅片标准,1 010例CC患者中,因不符合阅片标准无法判读的样本为61例;在可统计的949例CC样本中,PD-L1阳性表达(CPS≥1)的样本共有773例,阳性率为81.5%; 在PD-L1表达阳性的组织样本中,CPS不同分层的样本分布较为均匀(表2)。

表2 PD-L1表达水平在不同CC样本中的分布
2.4 WD160与22C3的符合率对可统计的949例CC样本进行统计学分析。结果显示,WD160与22C3试剂的阳性符合率为100.00%,阴性符合率为83.81%,总符合率为96.42%; 使用Kappa检验对两种试剂的一致性进行统计,K=0.889 6,两组数据的差异有统计学意义(P<0.05, 表3)。

表3 WD160和22C3的符合率计算的2×2矩阵
2.5 PD-L1分子在不同分期肿瘤组织中的表达差异共纳入浙江省肿瘤医院215例CC患者参与本次统计分析,因为各种原因(患者有信息不全、有治疗史、CC样本肿瘤细胞数少于100个等)有45例样本被剔除。根据CC国际妇产科协会(International Federation of Gynecology and Obstetrics, FIGO)分期标准,合格的170例样本的肿瘤分期情况如下(表4)。

表4 不同分期CC患者的PD-L1表达情况
对Ⅰ、Ⅱ、Ⅲ期共163例PD-L1阳性患者的CPS进行统计分析,结果显示临床Ⅰ期和Ⅱ期患者的CPS很接近,中位数分别为60和55,但差异无统计学意义(P=0.57)。而相对地,临床Ⅲ期患者的CPS显著降低,中位数为35,与另两组相比差异有统计学意义(P=0.005,P=0.03,P总=0.015)。由于Ⅳ期只有2例患者,故没有纳入统计分析。(图3)

注:PD-L1阳性细胞(WD160染色)在不同分期肿瘤组织(Ⅰ、Ⅱ、Ⅲ期)中的CPS统计箱线图。Kruskal-Wallis秩和检验示3组间的P总值为0.015。
3 讨论
PD-L1作为免疫治疗药物的靶点,其表达水平对筛选免疫治疗获益人群至关重要。国际上PD-L1检测试剂盒有4种,克隆号分别为22C3、28-8、SP263和SP142。目前还没有国产的PD-L1伴随诊断试剂盒应用于临床诊断。WD160的研发将有助于填补这一空白。值得一提的是,北京301医院韩为东教授在针对霍奇金淋巴瘤患者PD-1抗体联合用药研究的临床试验中,使用WD160试剂盒评估肿瘤样本的PD-L1表达水平,作为临床用药的参考指标,结果表明PD-L1高表达的患者PD-1抗体联合用药的效果优于单独化疗[15]。
本研究针对CC患者,以抗PD-L1(22C3)抗体试剂盒为标准,评价苏州药明泽康生物科技有限公司的抗PD-L1(WD160)抗体检测质量。使用这两种试剂进行CC组织样本的PD-L1免疫组织化学染色,并由专业的病理医师判读结果。两种试剂的判读标准及截止值一致,染色模式也相似,均表现为细胞膜染色。统计分析结果表明,两种试剂的阳性符合率为100.00%,阴性符合率为83.81%,总符合率为96.42%,K值为0.889 6且差异有统计学意义(P<0.05),说明两种试剂的检测结果具有较高的一致性。KEYNOTE158(NCT02628067)临床试验中,共纳入98例CC患者,其中82例为PD-L1表达阳性,即阳性率达83.7%[16]。一项仅针对中国CC人群的研究也表明,PD-L1在CC中高表达,阳性表达率可达81.30%[17]。本研究纳入的、可判读的949例CC患者的PD-L1阳性率达81.50%(表2),说明PD-L1试剂(WD160)可有效识别CC中相应阳性人群。PD-L1(WD160)与PD-L1(22C3)的阴性符合率为83.81%。分析染色结果不一致的34例样本,抗体染色强度不同为主要原因。
PD-L1的高表达导致肿瘤局部微环境免疫监视功能下降,促使肿瘤细胞的免疫逃逸。因此,PD-L1的表达水平对肿瘤发生发展以及预后改善都有着重要影响。在非小细胞肺癌组织中PD-L1的表达水平与免疫治疗效果正相关,PD-L1高表达已成为免疫治疗中单药治疗的新标准[18]。本研究对170例不同肿瘤分期患者的PD-L1阳性分布进行了初步评估,结果发现,Ⅰ、Ⅱ期患者的PD-L1阳性率没有差别,而Ⅲ期患者的PD-L1阳性程度显著降低(P总=0.015)。此结果与非小细胞肺癌中报道的结果存在差异,这可能与肿瘤类型不同有关。但需要指出的是,在肺癌组织的PD-L1染色情况判读中,只考虑了肿瘤细胞的PD-L1染色,而在CC中,PD-L1的判读标准是不但要纳入肿瘤细胞的表达情况,还要考虑到肿瘤细胞周围免疫细胞中PD-L1的表达水平,也就是整个肿瘤微环境中PD-L1的表达。究竟肿瘤细胞的PD-L1表达还是肿瘤微环境的PD-L1表达与肿瘤免疫治疗更相关,这是一个值得探讨的问题。PD-L1抗体药物已被用于晚期CC患者的治疗[19-20]。本研究发现PD-L1的表达在不同分期的CC中有差异,这种差异是否对CC患者的用药有指导意义,还需要进一步的临床研究。
综上所述,PD-L1(WD160)与PD-L1(22C3)的检测结果具有较高的一致性,可进一步作为CC免疫治疗药物的伴随诊断试剂,有助于药物疗效相关性和有效性的临床研究工作开展。

