外周血T细胞及双阴性T细胞在结直肠癌患者中的变化及临床意义
孙克娜,陈英剑,宋御繁,刘晓斐
(1.潍坊医学院 医学检验学院,潍坊 261053;2.中国人民解放军联勤保障部队第九六〇医院 检验科,济南 250031)
2018年全球癌症调查研究报告显示,结直肠癌(colorectal cancer,CRC)的发病率居第3位,病死率居第2位,发展中国家CRC发病率比发达国家高3倍[1]。我国是CRC发病的高危国家,但目前CRC的发病机制尚不完全明确,也无特异的早期诊断和治疗方法[2]。研究发现,免疫系统具有重要的抗肿瘤作用,机体免疫系统的抗肿瘤作用以T细胞及其亚群介导的细胞免疫为主[3]。然而,机体抗肿瘤作用的实现依赖于T细胞功能的正常发挥,免疫抑制可促进肿瘤的发生和发展[4]。双阴性T细胞(double-negative T cell,DNT)是近年来新发现的一种Treg,其表面既不表达CD4抗原也不表达CD8抗原。DNT占正常人外周血总淋巴细胞的1%~5%[5],在CRC患者中的表达规律尚无统一的结论。目前,DNT抗肿瘤作用成为研究的热点。本研究拟以健康人为对照,通过FACS检测术前、术后及不同临床分期CRC患者的T细胞亚群及DNT分布情况,分析CRC患者及其术后细胞免疫功能状况,探讨相关的作用及免疫机制,旨在为临床CRC的诊断和治疗提供参考依据。
1 资料与方法
1.1 一般资料收集2017年6月—2019年11月中国人民解放军联勤保障部队第九六〇医院确诊的93例CRC患者为CRC组,其中男性50例、女性43例,年龄(61.2±11.2)岁。患者中,结肠肿瘤40例、直肠肿瘤53例;病理类型:腺癌73例、黏液腺癌+印戒细胞癌20例;临床分期:Ⅰ+Ⅱ期61例、Ⅲ+Ⅳ期32例。另选取54例同期健康体检者作为健康组,其中男性29例、女性25例,年龄(60.7±13.4)岁。2组研究对象性别、年龄差异均无统计学意义(P>0.05)。样本按统一流程进行筛选(图1)。同时,将93例CRC患者按临床分期分为2组,即Ⅰ+Ⅱ期组、Ⅲ+Ⅳ期组,2组基线资料差异均无统计学意义(P>0.05)。

图1 样本筛选流程
1.2 试剂与仪器CD45-FITC/CD4-藻红蛋白(phycoeryth,PE)/CD8-藻红蛋白-德克萨斯红(phycoerythrin Texas red,ECD)/CD3-藻红蛋白藕联物(phycoerythrin coupling compound 5,PC5)和FC500流式细胞仪均购自贝克曼-库尔特公司。
1.3 方法采集健康者和CRC患者术前及术后第7天的空腹静脉血2 mL,置于含有EDTA抗凝剂的真空采血管中,在样本采集完成后6 h内检测。按照检测要求,向流式试管内分别加入10 μL单克隆抗体,随即加入100 μL抗凝血,振荡混匀,室温下避光孵育20 min,加入溶血剂溶解红细胞后,按照操作程序上机检测。检测时以CD45 /SSC 和 CD3 /SSC 圈定淋巴细胞和T细胞,每次检测前均用Flow Check对仪器流路、光路进行校准。
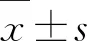
2 结果
2.1 CRC患者外周血T细胞亚群及DNT比例的FACS分析采用FACS分析CRC患者和健康者外周血T细胞亚群及DNT比例。结果显示,与健康组比较,CRC组CD3+T细胞和CD3+CD4+T细胞比例显著降低(P<0.05),DNT比例显著升高(P<0.05),CD3+CD8+T细胞比例差异无统计学意义(P>0.05),但有升高的趋势。(图2、表1)

注:A~D.分别为CRC组CD3+T细胞、CD3+CD4+T细胞、CD3+CD8+T细胞和DNT FACS散点图;E~H.分别为健康组CD3+T细胞、CD3+CD4+T细胞、CD3+CD8+T细胞和DNT FACS散点图。

表1 CRC组和健康组外周血T细胞亚群及DNT的分布
2.2 CRC患者手术前后外周血T细胞亚群及DNT的FACS分析为初步明确手术治疗后CRC患者外周血T细胞亚群及DNT比例的变化,采用FACS进行分析。结果显示,与术前比较,CRC患者术后CD3+CD4+T细胞比例显著升高(P<0.05),DNT比例显著降低 (P<0.05)。(图3、表2)

表2 CRC患者手术前后T细胞亚群及DNT的分布
注:A~D.分别为CRC患者手术前CD3+T细胞、CD3+CD4+T细胞、CD3+CD8+T细胞和DNT FACS散点图;E~H.分别为CRC患者手术后CD3+T细胞、CD3+CD4+T细胞、CD3+CD8+T细胞和DNT FACS散点图。
2.3 不同临床分期CRC患者外周血T细胞亚群及DNT的FACS分析为比较Ⅰ+Ⅱ期、Ⅲ+Ⅳ期CRC患者外周血T细胞亚群及DNT的分布差异,采用FACS进行分析。结果显示,与Ⅰ+Ⅱ期CRC组比较,Ⅲ+Ⅳ期CRC组DNT比例显著降低(P<0.05)(表3)。Ⅲ+Ⅳ期患者DNT虽显著降低,但与健康组比较表达水平仍升高(Z=5.72,P<0.05)。

表3 Ⅰ+Ⅱ期、Ⅲ+Ⅳ期CRC患者T细胞亚群及DNT的分布
3 讨论
肿瘤的发生、发展与机体免疫状态密切相关,恶性肿瘤患者免疫功能低下,肿瘤细胞容易增殖[5]。T细胞亚群的数量和比例是评价机体免疫状态的重要指标[6]。T细胞亚群的比例失衡和功能异常,可导致机体免疫紊乱并诱发一系列病理变化,包括肿瘤的发生、发展[7]。研究发现,基于分化抗原分子的不同,CD3+T总淋巴细胞大体可划分为CD4+和CD8+T细胞2个亚群[8]。CD4+T细胞为辅助性 T细胞,在细胞因子和抗原等的刺激下,进一步分化为Th2、Th17、滤泡辅助性T细胞、Treg、Th9和Th22,辅助机体完成抗肿瘤免疫[9]。CD8+T细胞可分为抑制性T细胞和CTL:一方面,CD8+T细胞通过自身抑制因子在免疫反应中发挥作用,使CD4+T细胞和B细胞功能受到抑制,从而抑制细胞免疫反应及体液免疫反应;另一方面,CD8+T细胞可通过颗粒酶/穿孔素等多种途径对突变细胞或肿瘤细胞进行特异性杀伤[10]。
研究发现,肠癌患者外周血CD3+和CD4+T细胞的比例明显下调,CD8+T细胞比例上调[11],这与本研究结果相似,说明CRC患者处于免疫抑制状态。本研究发现,CRC患者术后CD3+CD4+T细胞比例较术前明显升高,提示CD4+T细胞辅助参与的体液免疫相对增强。目前,随着T细胞亚群研究机制的不断深入,肿瘤免疫指标的检测和免疫治疗方案的制定越来越受到临床关注。肠镜病理检查对患者和医师要求较高,可能会出现穿孔、出血等不良反应,无法成为大规模使用的初筛工具。通过监测CRC患者T细胞亚群的表达,可进一步评估患者的抗肿瘤免疫功能,进而为判断患者预后及设计更为切实可行的治疗方案提供理论依据,该方法简便易行,有望今后在基层医院得到深入开展。
研究发现,在B16F10小鼠黑色素瘤模型中,DNT可抑制CD4+T细胞的杀伤功能,减少肿瘤组织中淋巴细胞浸润从而促进肿瘤生长,且小鼠体内DNT数量与肿瘤大小呈正相关[12-13],说明DNT有促进肿瘤生长的作用。另外,在研究DNT的肿瘤免疫治疗中发现,DNT对肿瘤细胞具有杀伤作用:(1)通过Fas/FasL途径诱导肿瘤细胞凋亡[14];(2)通过颗粒酶/穿孔素途经杀伤肿瘤细胞[15];(3)通过分泌细胞因子(如TNF-α、IFN-γ、IL-17和颗粒酶B)作用于肿瘤细胞[16]。(4)通过NK细胞活化性受体及其配体MHCⅠ类相关基因A途径直接杀伤肿瘤细胞[17-18];(5)通过肿瘤坏死因子相关凋亡诱导配体及其受体途径抑制肿瘤细胞增殖[19]。本研究发现,CRC组患者DNT比例显著高于健康组,并且Ⅲ+Ⅳ期CRC患者 DNT比例较Ⅰ+Ⅱ期患者明显降低。这些结果提示,DNT在CRC中可能发挥正向的杀伤肿瘤作用。患者手术后DNT比例显著降低,表明在CRC的发生和发展过程中可能存在DNT的调节紊乱或异常表达。
DNT作为一种独特的调节性细胞群,具有免疫抑制功能,可以选择性地抑制CD4+T细胞的mTOR信号转导,从而抑制CD4+T细胞的增殖和功能,其被称作“天生的抑制器”[20]。研究发现,OX40在CRC肠系膜淋巴结等部位高表达,并且能够调控CD4+T细胞向DNT转化,提高DNT的转化效率,并且抑制DNT凋亡[21-22]。这可能是CRC患者DNT升高而CD4+T细胞下降的原因。DNT的具体作用机制尚不完全明确,DNT是否还通过其他的途径对肿瘤细胞发挥作用,尚需进一步研究。同时,临床分期是决定CRC治疗效果和预后的重要依据,但传统诊断技术在CRC临床分期过程中可能存在主观因素的影响。如果能通过分子免疫学方法加以辅助分期,可能对CRC治疗和预后的准确判断更有意义。
综上所述,本研究证实了CRC患者存在细胞免疫功能紊乱及DNT高表达,而在晚期患者中出现DNT表达降低,这些结果为DNT在肿瘤免疫中的作用研究提供了一定的科学依据。CRC患者外周血T细胞及DNT检测有望成为评估术前机体免疫状态、手术预后及治疗效果的指标,为CRC的诊断、临床分期及制定免疫治疗策略提供新的思路和理论依据。

