食品生产监管中检验部分检查规范初探
弓耀忠 冯晓斌 曾品国
(1山西省检验检测中心,山西太原 030012)(2山西省市场监督管理局,山西太原 030006)
《食品安全法》第四十六条规定,食品生产企业应当制定并实施原料检验、半成品检验、成品出厂检验等检验控制要求,保证所生产的食品符合食品安全标准。第五十一条规定,食品生产企业应当建立食品出厂检验记录制度,查验出厂食品的检验合格证和安全状况,如实记录食品的名称、规格、数量、生产日期或者生产批号、保质期、检验合格证号、销售日期以及购货者名称、地址、联系方式等内容,并保存相关凭证。记录和凭证保存期限应当符合本法第五十条第二款的规定。第五十二条规定,食品、食品添加剂、食品相关产品的生产者,应当按照食品安全标准对所生产的食品、食品添加剂、食品相关产品进行检验,检验合格后方可出厂或者销售。GB 14881—2013 中第9 条对此制定了详细要求。
食品生产企业制定并实施原料检验、半成品检验、成品出厂检验等检验控制是保证所生产的食品符合食品安全标准的重要主体责任。作为监管检查人员,如何检查企业检验控制的主体责任落实情况,在实际检查中,检查人员的要求往往深浅不一、判定不一。为规范监管检查人员的检查内容、检查方法,提升检查质量,本文对食品生产监管中检验部分检查规范进行初探,以期对提升监管水平、夯实食品安全有所帮助。
通常情况下,检验部分检查的基本流程为:
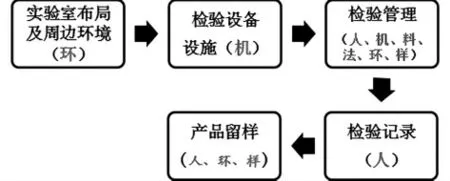
实际检查工作中可以根据检查需要,适当调整检查顺序和检查重点,确保检查工作的有效性。检查过程中应抓住人、机、料、法、环、样这条主线,结合被检查方可能存在的检验风险,进行相关信息采集、追溯,才能更有效的发现检验问题。例如,针对被检查方能力验证结果不满意或可疑的检验项目,可进行以下方面的检查:能力验证结果不满意或可疑时,有无原因分析?原因分析是否合理?采取了哪些改进措施?是否有效?跳出企业自己的原因分析,看企业是否从人、机、料、法、环、样各方面进行了原因排查,如果有遗漏的环节,可与企业进行沟通,深入了解,找全、找准导致能力验证结果不满意或可疑的原因。
企业检验能力的持续保持本质上是实验室检验人员能力的持续保持,这就要求检验人员相对稳定,每个检验项目应有至少有2 人熟练掌握该项目的检验方法。熟练的检验人员是人、机、料、法、环、样六要素中的核心,熟练的检验人员是可以驾驭和统领机、料、法、环、样五要素的检验人员。同样,检验能力不足也首先体现在检验人员的能力不足方面,其次才可能体现在机、料、法、环、样五要素方面。
1 检验设施设备
1.1 检查内容
自行检验应具备与所检项目适应的检验室和检验能力。
1.2 检查方法
1.2.1 对照生产许可档案,核对检验设备的名称、规格、数量和生产厂家。
1.2.2 打开电源开关,检查检验设备是否能够正常运行。
1.2.3 对照检验方法标准,检查大型精密仪器(如气相色谱、液相色谱、质谱、原子荧光分光光度计等)附带的检测器是否符合检验标准要求。
1.2.4 对照检验方法标准,检查是否具备相应的检验试剂。
1.2.5 观察仪器清洗设施(玻璃仪器清洗池、洗瓶等),确定是否具备相应的清洗能力。
1.2.6 观察冷凝管、水浴锅、电炉、高温炉以及其他辅助设备,观察是否有经常使用的痕迹。
1.2.7 检查计量检定情况、计量检定、校准证书的确认和合理应用情况,可以将偏差大的证书作为重点,看企业有无应用偏差,应用正确与否。
1.2.8 不同微生物培养需要的温度点不一,查看培养箱数量与校准温度点是否满足要求。
1.3 检查案例
1.3.1 检验设备不符合要求的
某实验室培养箱数量不足,不符合“检验设备的数量应与企业生产能力相适应”的要求;检验设备中缺少精确度为0.01 mg 的分析天平;理化前处理室中用于脂肪酸检测的水浴锅温控范围为5 ℃~65 ℃,无法达到规定的水浴温度80±1 ℃的要求;原子荧光光度计无法正常使用,现场未发现与其配套的数据处理工作站。
1.3.2 检验试剂菌株不足的
某实验室维生素B6项目检验未严格依照国家标准方法要求对吡哆醇、吡哆醛和吡哆胺进行检验,仅检测了吡哆醇;实验室缺少金黄色葡萄球菌、沙门氏菌、阪崎肠杆菌参照菌株或标准菌株,也未见沙门多价血清。
1.3.3 检验设备设施未检定或未校准
某实验室在用的22 把移液枪(规格为100 ul~1 000 ul的6 把,10 ul~100 ul的3 把、0.5 ul~10 ul的2 把、20 ul~200 ul 的6 把、0.5 ml~5ml 的4 把、30 ul~300 ul 的1 把)未进行校准;实验室在用的2台压力蒸汽灭菌器未见检定证书,有9 台微生物培养箱未提供校准或检定证书;编号为112 的培养箱实际使用温度为25 ℃,校准证书上标示校准温度为36 ℃。
2 检验人员
2.1 检查内容
检验人员应当具备相应的检验能力或资质。
2.2 检查方法
2.2.1 检查检验人员名单及档案,了解其学历、专业、工作岗位等情况,抽查部分检验人员,询问学习、工作情况,印证是否相符。
2.2.2 询问部分检验人员如何开展检验工作,要求其描述具体的检验方法,并要求其查找相关检验设备、玻璃仪器、化学试剂。发现检验人员不熟悉相关情况的,应当查证是否不具备检验能力,甚至是临时聘用、冒名顶替的检验人员。
2.2.3 现场考核检验能力。可以通过标准样品、盲样测试、现场加标、留样复测等方式考核检验人员是否具备相应的检验能力。
2.2.3.1 标准样品和盲样的制备、资质应当符合有关规定;
2.2.3.2 现场加标时,应全程录像,证明加标情况;
2.2.3.3 留样复测时应当抽取10 个以上的多品种留样,随机选取一种进行考核。抽取过程应全程录像,所取样品应有效整改标志信息,检验过程应全程跟踪、核对相关检验数据,防止被考核人员通过感官、标志性物质数据等方式猜测留样的种类。
2.3 检查案例
2.3.1 检验人员不足或能力不足
现场检验能力考核时,一名微生物检验人员不能独立完成沙门氏菌、阪崎肠杆菌现场模拟实验;6 名微生物检验人员无独立开展阳性样品的检验经历,且未提供具备相应检验能力的证明,不符合每个检验项目至少2 人以上具有独立检验能力要求。
2.3.2 检验人员质控能力不足
进行全项目检验能力比对验证时,反式脂肪酸、钙比对结果不满意,但未能提供相应纠正措施及措施效果评价记录;检验能力验证结果评价方法不规范,未对能力验证检验数据的偏差值进行核算,导致维生素B1、维生素K、硝酸盐的检验能力验证结果判定错误;成品检验报告、原始记录中,锰元素测定试样的锰含量处于标准曲线的测量范围之外。
2.3.3 现场检验能力考核,部分项目检验能力不足
现场检验能力考核显示,维生素C、维生素D、三聚氰胺、反式脂肪酸与总脂肪酸的比值的检验能力不足。
3 出厂检验
3.1 检查内容
应通过自行检验或委托具备相应资质的食品检验机构对产品进行出厂检验,建立食品出厂检验记录制度。出厂检验项目应当符合产品执行标准和审查细则的要求。
3.2 检查方法
3.2.1 检查出厂检验制度和相关检验规程,确定出厂检验项目、频次是否符合法律法规、产品标准以及审查细则的规定。对照生产许可档案,确定出厂检验方式(自行检验或委托检验)。
3.2.2 自行检验的,按照“检验设施设备”、“检验人员”的要求进行检查。
3.2.3 自行检验的,参照“生产记录”的检查方式,现场抽查取样记录、检验原始记录和检验报告,查证是否符合出厂检验的要求。
3.2.4 确定检验记录的真实性。根据检验记录上的签名,查找相关检验人员并当场签字,确定检查记录的真实性;检查大型仪器数据处理系统中的原始数据和仪器使用痕迹跟踪数据,核对是否与检验报告、检验原始记录相符合;检查化学试剂采购、保存、领用等票据和记录,确定其消耗量与生产批量是否匹配,是否符合出厂检验的需求。
3.2.5 出厂委托检验的,检查被检查方如何确定委托检验机构的资质,并查证委托检验报告封面是否有法定资质的标志(如CMA 等);抽查一定时期内的生产计划、成品出入库记录、销售记录等,核算成品批次与出厂委托检验报告份数的一致性,判定是否符合规定要求。
3.2.6 出厂检验的取样工作通常在生产线上完成。检查取样数量是否符合检验规程的要求。
3.3 检查案例
3.3.1 不检而编造记录和报告现象
10 个样品的碘元素检验原始记录显示,样品处理时间均为2020 年6 月10 日00:44:04;脱盐乳清粉与婴儿配方奶粉的三聚氰胺检验原始谱图完全相同;核算2017 年车间环境微生物沙门氏菌和阪崎肠杆菌检测中缓冲蛋白胨水培养基理论用量为112 275 mL,实际培养基配制记录中缓冲蛋白胨水共配制82 100 mL,配置量远少于理论用量。
3.3.2 少检现象
未对维生素A 进行平行样检验;维生素D 标准曲线均采用3 个标准系列浓度绘制,不符合国标中标准曲线应使用6 个标准系列浓度的要求;检验实际使用三聚氰胺检测柱650 支,根据产量计算需要三聚氰胺检测柱773 支,实际使用量小于需求数量;两批次产品出厂检验取样记录中取样数量为3罐,检验标准要求取样数量为5 罐。
3.3.3 记录信息不规范,可追溯性差
出厂检验报告缺少叶黄素的原始记录;检验项目的原始记录只保存了谱图,未保存积分后的数据报告,无法还原原始数据;检验原始记录中钙计算用吸光度与原始谱图中吸光度不一致。
3.3.4 使用过期试剂
使用过期试剂盒检测维生素B12、生物素、叶酸项目。
4 产品留样
4.1 检查内容
应建立产品留样制度,及时保留样品。
4.2 检查方法
4.2.1 检查是否制定产品留样制度,制度中是否规定了留样方式、留样数量、保存条件、使用规则和留样记录填写要求等内容。
4.2.2 检查留样间(库),确定留样品种、数量、保存条件是否符合规定要求。
4.2.3 参考“生产记录”的检查方法,确定一定时期内的留样批次,对比留样及留样记录,确定留样是否齐全。
4.3 检查案例
缺少幼儿配方乳粉(生产日期20160316,400g/盒)产品的留样;样品实际留样数量与留样记录不一致,第7 批次产品的留样数量少于留样记录,具无留样取用记录;留样室发现100g/罐规格的婴儿配方羊奶粉,而获得批准的婴幼儿配方乳粉产品品种明细中无该规格的产品。

